2. 教育部食品科学重点实验室南昌大学中德联合研究院
黄曲霉广泛分布于自然界, 极易引起物品霉变。食品等物品霉变除造成直接重大的经济损失外, 某些产毒株产生的毒素, 还可导致肿瘤高发, 严重危害人和动物健康〔1〕。目前主要利用化学防腐剂抑制真菌的生长, 化学防腐剂种类繁多, 广泛应用于食品方面的有山梨酸、苯甲酸、丙酸及其盐类以及纳它霉素等, 但这些防腐剂防霉效果不是很理想, 而且对人和动物多有潜在的毒性。中药活性成分肉桂醛、柠檬醛作为食品防腐剂已应用于食品工业, 但对其抗菌机制研究较少。本研究室实验表明, 中药活性成分肉桂醛、柠檬醛有良好的抗黄曲霉作用〔2-5〕。本文用高效液相色谱(HPLC)法测定了肉桂醛、柠檬醛作用黄曲霉后真菌细胞膜麦角固醇含量的变化, 以期探讨抗真菌的作用机制, 旨在为开发新型的食品天然防腐剂提供理论依据。
1 材料与方法 1.1 实验菌株黄曲霉菌为标准株(CCCCMID A2)[中国医学真菌中心(南京)]。
1.2 仪器与试剂yknm高效液相色谱仪(美国Gilching公司); 真菌培养箱; 紫外分光光度计等。肉桂醛(中国上海双喜香料制剂厂), 比重1.047~1.051 (批号: 20020401, 纯度> 95 %); 柠檬醛(德国Berlinrang Vnitden Augen de Haut vermiden公司)批号:002489 S20085632, 纯度98 %。, 比重01887~01889 (批号:002489 S20085632, 纯度> 98 %); 酮康唑(纯度: 200 mg/片, 批号:030418108, 西安杨森制药有限公司), 临用前将酮康唑研成细粉并溶于二甲基亚砜, 使其浓度为40 mg/ml; 麦角甾醇(美国Sigma公司), 用环己烷配成1.0 mg/ml, -20 ℃保存; 乙腈为色谱纯; 皂化剂:新鲜配制的含15 %NaOH的90 %乙醇溶液; 蔡氏培养液〔6〕; 其他试剂均为分析纯。
1.3 方法 1.3.1 菌液制备将试验菌株接种于蔡氏斜面, 26 ℃培养至快速生长早期, 活化2次, 此时菌苔覆盖斜面, 加入蔡氏液体, 吸管吹打菌苔使孢子游离于培养液中, 用500目无菌尼龙网过滤, 滤液经血细胞计数板计数及紫外分光光度计测定, 调整孢子浓度为106个/ml。
1.3.2 不同浓度药液的制备参照文献〔2, 5〕, 于无菌、直径为15 cm的平皿内分别加入柠檬醛9.16, 6.11μl, 肉桂醛6.364, 4.364μl, 酮康唑4μl, 将冷却至50 ℃左右的蔡氏固体培养基50 ml迅速倒入上述平皿内, 混匀(药物终浓度分别为:柠檬醛, 0.16, 0.08μg/ml; 肉桂醛, 0.13, 0.09μg/ml; 酮康唑, 3.2μg/ml), 待其凝固。
1.3.3 高效液相色谱HPLC法测定肉桂醛、柠檬醛对黄曲霉细胞膜麦角甾醇含量的影响(1)样品制备:将11311制备的菌液接种在含有不同浓度药物的蔡氏固体培养基中(孢子终浓度为104个/ml), 同时设不加药物为空白对照, 置26.5 ℃恒温培养3 d, 刮取平皿上的菌苔, 称菌湿重。各精密称取湿菌约0.5 g, 加磷酸盐缓冲液(PBS) 2.5 ml和皂化剂6 ml, 混匀, 80 ℃水浴皂化60 min。加石油醚(沸程30~60 ℃) 6 ml提取3次, 合并提取液, 加水6 ml洗涤2次, 醚层于60 ℃水浴挥干, 得未皂化脂〔7〕, 加环己烷溶解使溶液体积为1 ml/g湿菌, -20 ℃保存。(2)高效液相色谱条件:色谱柱:C8柱; 流动相:已腈-水(95: 5);流速, 1.0 ml/min; 检测波长283 nm, 采用外标法按峰面积进行定量。(3)标准曲线绘制:精密称取25 mg麦角甾醇标准品, 用环己烷溶解配成1.0 mg/ml作标准贮备液。用标准贮备液分别配制0.5, 0.25, 0.125, 0.0625, 0.0325, 0.01625 mg/ml等6份标准液, 在(2)中建立的色谱条件下进样20μl, 每个浓度进样2次, 以峰面积的均值为纵坐标, 样品浓度为横坐标作标准曲线, 进行回归处理。(4)精密度测定:在本实验条件下, 将0.25, 0.125, 0.0625 mg/ml的标准溶液分别于日内及日间进样, 测定日内及日间相对标准差。每个样品重复进样2次。(5)样品测定:将(1)中制备好的样品用本实验建立的色谱条件分别进样20μl, 每个样品进样2次, 测定样品中麦角甾醇的含量(n=3)。
1.4 统计分析采用SPSS 11.0软件进行分析。
2 结果 2.1 标准品麦角甾醇的出峰时间按本实验建立的色谱条件进样。结果显示, 麦角甾醇的出峰时间在16~17 min。
2.2 标准曲线麦角甾醇含量在0.5~0.01625 mg/ml范围内的线性回归方程为:y=47.436 36x + 0.507 256 (n=6, r=0.999 427), 麦角甾醇含量在此范围内与峰面积有很好的线性关系。
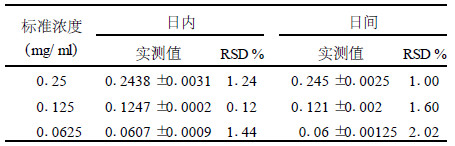
2.3 麦角固醇的精密度测定测定日内及日间相对标准差, 其RSD (相对标准差)分别在0.12 %~1.44 %, 1.0 %~2.02 %。说明测定结果的重现性好, 见表 1。
| 表 1 麦角固醇的精密度测定(x±s) |
2.4 肉桂醛、柠檬醛对黄曲霉细胞膜麦角甾醇含量的影响
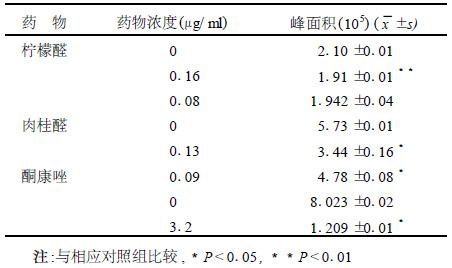
以酮康唑为阳性对照, 测定了肉桂醛、柠檬醛作用黄曲霉后麦角甾醇含量的变化。柠檬醛较高浓度0.16μg/ml、肉桂醛0.09μg/ml作用黄曲霉后, 麦角固醇含量较相应未用药组减低, 差异有统计学意义(P < 0.01), 见表 2。
| 表 2 用药前后黄曲霉麦角固醇含量比较(n=3) |
3 讨论
肉桂醛、柠檬醛是肉桂、山苍子油的主要成分, 且两者已分别用于化工、食品、粮食防腐、医疗卫生。实验表明, 两者有良好的广谱抗真菌作用特别是有高效的抗曲霉作用。张文娟〔8〕、罗曼〔9〕等研究了柠檬醛致黄曲霉的形态结构和某些宏观影响。
麦角甾醇是真菌细胞质膜的重要组成成分, 它是一种准平面体分子, 通过与磷脂结合稳定磷脂相, 从而增加膜的稳定性。麦角甾醇的缺乏, 必将引起真菌细胞膜功能异常, 甚至发生细胞破裂。目前用于检测细胞膜中麦角甾醇含量的方法有薄层层析法、高效液相色谱法等〔10〕。反向高效液相色谱分析法具有分析速度快、分离效能高、自动化程度好的特点而被广泛使用。本实验以酮康唑为阳性对照, 用反相液相色谱法测定了中药活性成分肉桂醛、柠檬醛作用黄曲霉后细胞膜麦角甾醇含量的变化。实验中发现, 一定浓度的药物作用后黄曲霉细胞膜麦角甾醇含量较阴性对照组减少, 随着药物浓度的增加, 麦角甾醇的含量也随之减少。表明药物影响了细胞膜麦角甾醇的生物合成, 从而抑制了黄曲霉的生长繁殖。至于药物抑制了麦角甾醇生物合成的哪一个环节或多个环节, 还有待进一步研究。通过测定真菌中麦角固醇含量, 有助于探讨抗真菌药物的作用机制, 并为中药活性成分的体外抗真菌作用研究提供方法。
| [1] | 潘崴, 庞广昌, 张昀. 黄曲霉毒素与食品安全[J]. 食品研究与开发, 2004, 25(6) : 11–13. |
| [2] | 谢小梅, 许杨, 付颖媛. 微量液基稀释法测定中药活性成分的体外抗曲霉菌活性[J]. 微生物学通报, 2003, 30(6) : 89–93. |
| [3] | 谢小梅, 许杨, 方建茹. 肉桂醛、柠檬醛对烟曲霉、黄曲霉细胞DNA、RNA的影响[J]. 中草药, 2005, 36(4) : 558–560. |
| [4] | 谢小梅, 张文平, 付颖媛, 等. 肉桂醛、柠檬醛抗曲霉菌作用机制的研究[J]. 中草药, 2004, 35(4) : 430–432. |
| [5] | 谢小梅, 方建茹, 许杨. 肉桂醛、柠檬醛抗黄曲霉作用的研究[J]. 食品科学, 2004, 25(9) : 32–34. |
| [6] | 陈世平. 真菌感染学[M]. 沈阳: 辽宁科学技术出版社, 2000: 538-539. |
| [7] | 刘洪涛, 高平挥, 曹永兵, 等. 气-质联用研究氟康唑对白念珠菌甾醇生物合成的抑制作用[J]. 中国药理学与毒理学杂志, 2002, 16(5) : 368–371. |
| [8] | 张文娟. 内桂醛抗黄曲霉作用及超微结构观察的研究[J]. 北京医科大学学报, 1995, 27(5) : 374. |
| [9] | 罗曼, 蒋立科, 吴子健. 柠檬醛对黄曲霉质膜损伤机制的初步研究[J]. 微生物学报, 2001, 41(6) : 723–730. |
| [10] | 罗曼, 蒋立科, 邹国林. 柠檬醛致黄曲霉孢子丧失萌发力的机制[J]. 中国生物化学与分子生物学报, 2002, 18(2) : 227–233. |
 2007, Vol. 23
2007, Vol. 23