2. 延边大学医院;
3. 日本东北食效科学研究所
茶多糖是一类从茶叶提取来的多糖类化合物, 具有增强免疫力、降血脂、降血糖、抗辐射、抗血凝、抗血栓等功效〔1, 2〕。我国和日本民间就有泡饮粗老茶治疗糖尿病的历史〔3〕。研究初步证实, 茶多糖是粗老茶叶降血糖的主要有效成分〔4〕, 但具体的作用机制尚不清楚。本文以茶多糖为材料, 探讨其对α-葡萄糖苷酶、α-淀粉酶和刷状缘囊泡葡萄糖转运能力的抑制作用, 旨在揭示茶多糖的降糖机制。
1 材料与方法 1.1 试剂和仪器酵母α-葡萄糖苷酶(日本和光公司); 猪α-胰淀粉酶type 1-A (美国Sigma公司)。Wallac 1 209 Rackbeta闪烁记数器、微量血糖侧定仪(德国Bayer公司); U -2 010型紫外分光光度仪(日本HITACHI公司)。
1.2 茶多糖的制备100 g绿茶用2 L蒸馏水侵泡过夜, 将提取液喷雾干燥得茶粉。将茶粉溶解, 用3倍体积95%的乙醇充分搅拌, 离心。沉淀物用75%的乙醇洗涤2次, 所得沉淀物再用蒸馏水溶解, 真空冷冻干燥, 得不含茶多酚的灰白色粗茶多糖, 其多糖含量为15.7% (蒽酮硫酸法)。
1.3 α-葡萄苷酶抑制活性的测定α-葡萄糖苷酶的抑制活性的测定采用渡边〔5〕等的方法, 测吸光度(A)400 nm和半抑制浓度(IC50)值。IC50定义为抑制酶活性50%时所需的抑制剂浓度。
1.4 α-淀粉酶抑制作用的测定将10 μl α-淀粉酶溶于4 ml含有50 mmol/ L NaCl、5 mmol/ L CaCl2、0.5/ L TritonX-100的pH 6.9, 25 mmol/ L Piperazine-N, N'-bis 2-ethanesulfonic acid缓冲液中作为酶保存液, 测定时用缓冲液稀释40倍使用。碘法〔6〕测定A700nm和IC50值。
1.5 刷状缘囊泡葡萄糖转运能力的测定将兔小肠浸泡于300 ml含200 mmol/ L甘露醇的pH 7.4, 2 mmol/ L HEPES[N-(2-hydroxyethyl) piperazine-N'-(2-ethanesulfonic acid)]-Tris缓冲液中, 刮取小肠黏膜, 在冰溶中高速匀浆2 min。匀浆液中加0.61 g固体MgCl2, 溶搅拌20 min后, 在4℃、3 000 g离心15 min, 所得上清在4℃、3 500 g离心30 min, 此沉淀液用10 ml含100 mmol/ L甘露醇、0.1 mmol/ L MgSO4的pH 7.4, 2 mmol/ L HEPES-Tris缓冲液溶解, 在4℃、35 000 g离心40 min, 所得沉淀用3倍体积含300 mmol/ L甘露醇、0.1 mmol/ L MgSO4的pH 7.4, 10 mmol/ L HEPES-Tris缓冲液重新溶解, 用25号注射针头反复抽吸, 即得刷状缘囊泡悬液。以3H-D-葡萄糖为底物, 用快速过滤法〔7〕测定刷状缘囊泡葡萄糖转运能力。抑制葡萄糖转运活性50%时所需的抑制剂浓度定义为IC50。
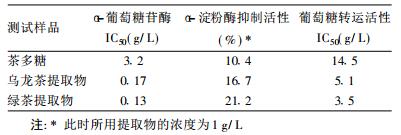
2 结果 2.1 茶多糖对α-葡萄糖苷酶和α-淀粉酶的抑制作用(表 1)| 表 1 茶多糖对α-葡萄糖苷酶、α-淀粉酶和葡萄糖转运活性的抑制作用 |
茶多糖具有较弱的α-葡萄糖苷酶和α-淀粉酶抑制活性。本实验同时测定了绿茶和乌龙茶提取物的α-葡萄糖苷酶抑制活性作为比较。
2.2 茶多糖对兔小肠刷状缘囊泡葡萄糖转运活性的影响茶多糖降低兔小肠刷状缘囊泡的葡萄糖转运活性, 且在较宽范围内呈剂量依赖性关系。随着浓度升高, 兔小肠刷状缘囊泡葡萄糖转运活性降低幅度明显减小, 呈直角双曲线关系。其对刷状缘囊泡葡萄糖转运的抑制作用为快速反应。
3 讨论有效地控制血糖是糖尿病治疗的基本目标。α-葡萄糖苷酶抑制剂是一组通过延缓糖的消化以降低餐后高血糖的口服降糖药, 其作用特点是在糖消化的最后一步抑制双糖降解为单糖〔5〕。α-淀粉酶抑制剂也能减慢食物淀粉在肠道中的消化, 抑制餐后血糖水平的升高, 因此, 也是近年来糖尿病口服药物开发研究的一个热点〔9〕。肠道对葡萄糖的吸收则以葡萄糖转运体的主动吸收来完成, 因此, 抑制葡萄糖转运活性也是降低餐后血糖的重要环节之一〔7〕。本研究结果表明, 茶多糖是α-葡萄糖苷酶和α-淀粉酶的弱抑制剂, 同时降低兔小肠刷状缘囊泡的葡萄糖转运活性, 从而能够通过延缓或减慢糖在肠道的消化和吸收来降低餐后高血糖。虽然茶多糖对α-葡萄糖苷酶和α-淀粉酶及刷状缘囊泡葡萄糖转运的抑制作用较弱, 但因为肠道中茶多糖浓度能达到较高水平, 经常饮用可能有助于降低餐后血糖的持续升高。
| [1] | 陈海霞, 谢笔钧. 茶多糖对小鼠实验性糖尿病的防治作用[J]. 营养学报, 2002, 24(1) : 85–86. |
| [2] | Tadakazu T, Tomoki U, Hitoshi K, et al. The chemical properties and functional effects of polysaccharides dissolved in green tea infusion[J]. Nippon Shokuhin Kagaku Kaishi, 1998, 45(4) : 270–272. DOI:10.3136/nskkk.45.270 |
| [3] | 刘强. 茶的保健功能与药用便方[M]. 北京: 金盾出版社, 1990: 31. |
| [4] | 汪东风, 谢晓凤. 粗老茶治糖尿病的药理成分分析[J]. 中草药, 1995, 26(5) : 255–257. |
| [5] | Watanabe J, Kawabata J, Kurihara H, et al. Isolation and identification of alpha-glucosidase inhibitors from T ochu-cha (Eucom mia ulmoides)[J]. Biosci Biotechnol Biochem, 1997, 61(1) : 177–178. DOI:10.1271/bbb.61.177 |
| [6] | Sawada S, Takeda Y, Kanamori M, et al. Purification and characterization of α-amylase inhibitors from the seeds of three cultivars of the genus Phaseolus[J]. Nippon Shokuhin Kagaku Kaishi, 2001, 48(3) : 182–188. DOI:10.3136/nskkk.48.182 |
| [7] | Vedavanam K, Srijayanta S, O'Reilly J, et al. Antioxidant action and potential antidiabetic properties of an isoflavonoid-containing soybean phytochemical extract (SPE)[J]. Phytother Res, 1999, 13 : 601–608. DOI:10.1002/(ISSN)1099-1573 |
| [8] | Layer P, Rizza PA, Zinsmeister AR, et al. Effect of a purified amy-lase inhibitor on carbohydrate tolerance in normal subjects and patients with diabetes mellitus[J]. Mayo Clin Proc, 1986, 61(6) : 442–447. DOI:10.1016/S0025-6196(12)61978-8 |
 2007, Vol. 23
2007, Vol. 23