2. 沈阳药科大学
克拉霉素是大环内酯类抗生素, 适用于革兰阳性菌、部分革兰阴性菌、厌氧菌及支原体、衣原体等非典型病原体所引起的感染。目前克拉霉素血药浓度的测定主要采用微生物法〔1〕及液相色谱法〔2, 3〕, 微生物法测定结果不够精确; 而液相色谱法样品处理繁琐, 血浆中内源性杂质常干扰测定, 定量检测限较高。为此, 我们建立了灵敏、简便、准确的液-液萃取, 液相色谱-串联质谱(LC/MS/MS)法测定人血浆中克拉霉素的浓度。
1 材料与方法 1.1 材料液相色谱-串联四极杆质谱仪:TSQ Quantum Dis-covery (美国Thermo Finnigan公司), 配有电喷雾离子化源(ESI源)以及Xcalibur 1.2系统软件, LC quan 2.0定量处理软件, Surveyor液相色谱系统; Turbo Vap蒸发仪(美国Zymark公司); YKH-型液体快速混合器(江西医疗器械厂); LG 10-2.4 A高速离心机(北京医用离心机厂)。克拉霉素及内标罗红霉素(沈阳药科大学); 乙腈为色谱纯, 其他为分析纯。
1.2 方法 1.2.1 色谱条件色谱柱:Diamonsil C18柱, 150 mm×4.6 mm, 5 μm; 流动相:乙腈-水-甲酸(体积比为85:15:0.2);流速:0.5 ml/min; 进样量:20 μl。
1.2.2 质谱条件离子源为电喷雾离子化源ESI源(+); 电喷雾电压4000 V; 加热毛细管温度380℃; 鞘气(N2)压力25 Arb; 辅助气(N2)压力5 Arb; 碰撞气(Ar)压力1.2 m Torr; 碰撞及诱导解离(CID)电压均为35 V; 扫描方式为选择反应监测(SRM); 扫描时间为0.3 s; 定量离子反应分别为:克拉霉素质荷比(m/z) 748→158, 罗红霉素质荷比(m/z) 837→158。
1.2.3 血浆样品处理取200 μl血浆, 分别加入100 μl乙腈-水(体积比为50:50), 100 μl内标溶液(罗红霉素, 浓度为4 mg/L), 200 μl的0.5 mol/L Na2CO3溶液, 混匀, 加3 ml提取溶剂正己烷一二氯甲烷-异丙醇(体积比为300:150:15), 涡流混合l min, 往复振荡15 min; 3500 r/min离心5 min, 分取上层有机相于另一试管中, 于40℃氮气流下吹干, 残留物加入200 μl流动相溶解, 涡流混合, 取20 μl进行液相色谱-质谱-质谱联用仪(LC/MS/MS)分析。
1.2.4 样品分析分别取6名受试者的空白血浆0.2 ml, 除不加内标外, 其他按方法1.2.3操作; 将一定浓度的标准溶液和内标溶液加入空白血浆中, 依同法操作; 取受试者给药后的血浆样品, 依同法操作。
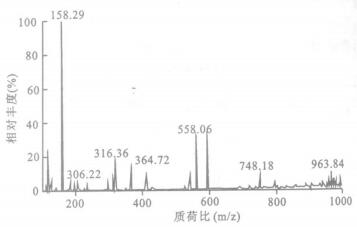
2 结果与分析 2.1 方法的选择性在ESI (+)离子化方式下, 克拉霉素和内标罗红霉素主要生成[M+H]+准分子离子峰m/z 748和m/z 837。选择性对[M+H]+进行二级质谱分析, 得到的主要碎片离子均为m/z 158(图 1), 将其作为定量分析时监测的产物离子。
|
图 1 克拉霉素[M+H]+的产物离子全扫描质谱图 |
克拉霉素和内标罗红霉素的保留时间均为2.07 min (图 2); 空白血浆中的内源性物质不干扰克拉霉素和内标罗红霉素的测定。

|
图 2 克拉霉素(A)和内标罗红霉素(B) SRM色谱图 |
2.2 标准曲线和定量下限
取空白血浆0.2 ml, 分别加入标准系列100 μl, 使相应克拉霉素血浆浓度分别为1, 10, 20, 50, 150, 500, 1000, 2500, 5000 μg/L, 按方法"1.2.3"操作, 以待测物浓度为横坐标, 待测物与内标物的峰面积比值为纵坐标, 用加权(1/x2)最小二乘法进行回归运算, 求得的直线回归方程即为标准曲线。克拉霉素的线性范围为1~5000 μg/L, 典型的线性回归方程Y=0.000 786 4+0.001 118 71X, r=0.999 5, 定量下限为1 μg/L。
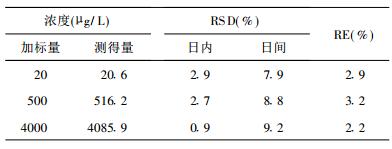
2.3 精密度与准确度取空白血浆0.2 ml, 按2.2中方法配制低、中、高3个浓度(浓度分别为20, 500, 4000 μg/L)的质量控制(QC)样品, 每个浓度进行6个样本分析, 连续测定3 d, 根据当日的标准曲线, 计算QC样品的浓度及方法精密度与准确度。结果表明, 克拉霉素的日内和日间相对标准偏差(RSD)分别 < 2.9%和9.2%, 日间相对偏差(RE)在3.2%之内。
2.4 提取回收率与样品稳定性分别取克拉霉素低、中、高等3种浓度(浓度分别为20, 500, 4000 μg/L)的质量控制(QC)样品, 以提取后的色谱峰面积与未经提取直接进样获得的色谱峰面积之比考察样品的提取回收率, 每一浓度进行6样品分析, 3种浓度下样品的提取回收率分别为71.7%, 64.1%和69.5%, 内标的提取回收率为64.2%。
分别取克拉霉素低、中、高3种浓度(浓度分别为20, 500, 4000 μg/L)的质量控制(QC)样品(每浓度3个分析样本), 在室温放置24 h后测定。结果表明, 处理后的克拉霉索样品溶液在室温放置24 h内稳定(RE在±4.5%之内)。
| 表 1 人血浆中克拉霉素的精密度与准确度(n=l8) |
3 小结
文献报道〔2, 3〕, 采用高效液相色谱(HPLC)测定血浆中的克拉霉素含量, 所需血浆样品在1.5~2.0 ml, 为了排除血浆样品中内源性杂质的干扰, 其色谱分离时间在9 min以上, 定量检测限在50 μg/L以上。本文建立的测定血浆中克拉霉素浓度的液相色谱-串联质谱法, 采用选择反应监测(SRM), 提高了方法的选择性和灵敏度, 测试时仅用血浆0.2 ml, 定量检测限为10 μg/L; 同时提高了分析测试速度, 每个样品的测定时间仅为2.7 min, 适合于大批量生物样品的测定。
| [1] | 高科攀, 史振祺, 蒋新国. 克拉霉素片剂人体生物利用度研究[J]. 中国现代应用药学杂志, 2004, 21(1) : 38–40. |
| [2] | 张红, 李华, 李艳艳, 等. 克拉霉素血药浓度HPLC测定方法和生物等效性研究[J]. 中国临床药理学与治疗学杂志, 2004, 9(7) : 792–794. |
| [3] | 李军, 张晓坚, 刘广炼. 克拉霉素药代动力学的研究[J]. 数理医药学杂志, 2000, 13 : 244–240. |
 2007, Vol. 23
2007, Vol. 23