2. 山西大学环境医学与毒理学研究所
SO2被吸收进入体内后, 首先在体液中转化成为它的代谢衍生物-亚硫酸盐和亚硫酸氢盐(分子比为3:1)。SO2对动物和人的作用, 实质上是通过这些体内衍生物对组织、细胞及生物大分子的损伤而达到的〔1, 2〕。而细胞内许多抗氧化酶活性的改变和膜脂质过氧化的损伤一直被认为是许多毒物的作用机制之一。本室研究表明, SO2吸入可引起大鼠脑组织和红细胞超氧化物歧化酶(SOD)活性下降、脂质过氧化(LPO)作用增高〔3, 4〕。SO2与人类健康关系密切, 对其毒作用机制及防护研究非常重要。因此, 本文研究了SO2体内衍生物对中国仓鼠肺成纤维细胞(CHL)中过氧化氢酶(CAT)、SOD酶活性及LPO水平的影响以及抗坏血酸(维生素C, VC)的保护作用。
1 材料与方法 1.1 实验材料CHL细胞(中国军事医学科学院提供)。
1.2 细胞培养本实验所用CHL细胞在含5% CO2, 37 ℃恒温箱中培养。用以细胞培养的RPMI 1640(美国Gibco公司)培养液中含10%小牛血清, 青霉素100 Iu/ml, 链霉素100 μg/ml, 传代时以0.2%胰酶液消化。
1.3 药物处理 1.3.1 SO2衍生物处理细胞传代, 培养12 h后进行药物处理:对照组5 ml/瓶磷酸缓冲液, 实验组分别用亚硫酸盐溶液处理, 浓度分别为5, 10, 15, 20 mmol/L, 4 h后, 弃去处理液。用磷酸缓冲液洗涤细胞, 换上新鲜培养液, 细胞仍置于5% CO2, 37 ℃恒温箱中培养。分别在12, 24 h取上清液用于脂质过氧化水平测定; 并分别在12, 24, 36, 48 h取各组细胞消化, 1 250 r/min离心10 min, 加入5 ml超纯水溶解细胞, 置-80 ℃冰箱中, 冻融二次, 取出并破碎细胞, 进行酶活性测定。
1.3.2 VC处理细胞传代, 培养12 h后进行药物处理:对照组5 ml/瓶磷酸缓冲液, 实验组分别用不同剂量VC和磷酸缓冲液处理, VC剂量分别为0.05, 0.1, 0.25, 0.5 mmol/L, 4 h后, 弃去处理液。将其分为3组, 1组细胞经消化、离心、破碎后立即测定酶活性; 另外2组用磷酸缓冲液洗涤细胞, 换上新鲜培养液, 将细胞置于5% CO2, 37 ℃恒温箱中培养。分别在12, 24 h取上清液测定脂质过氧化水平, 并测定各组细胞酶活性。
1.3.3 SO2衍生物和VC处理细胞传代, 培养12 h后进行药物处理, 先用0.1 mmol/L的VC处理15 min后, 加入不同剂量的SO2衍生物, 浓度为5, 10, 15, 20 mmol/L, 4h后, 弃去处理液, 分别在12, 24 h测定脂质过氧化水平和酶活性。
1.4 CAT活性测定采用过氧化氢(H2O2)分解反应的一级速率常数来测定CAT的活性〔5〕。即在一定的时间间隔Δt内测定H2O2在240 nm处的吸光度A1、A2, 并用下列公式计算:K/g蛋白质=2.3/Δt (a/b × lg A1/A2)(Sec-1)。
式中:K-速率常数; Δt-时间间隔; a-稀释倍数; b-溶液中蛋白质含量; A1、A2分别-时间t1、t2时的吸光度。
1.5 SOD活性测定采用改进的VC终止法, 420 nm测A值〔3, 4〕。邻苯三酚自氧化率的A值控制在0.06~0.07/min。SOD活性以单位/mg (蛋白质)(U/mg protein)表示。
1.6 脂质过氧化作用的测定通过测定硫代巴比妥酸反应物(TBARS)的水平, 以1, 1, 3, 3-四乙氧基丙烷为标准, 计算脂质过氧化产物-TBARS的含量〔3, 4〕。主要步骤为:在样品反应管中加入4 ml 10%三氯乙酸, 1.6 ml 0.67%硫代巴比妥酸(TBA), 细胞上清液0.4 ml, 在95~100 ℃保温40 min, 水浴冷却后, 3 000 r/min离心10 min, 取上清液在532 nm测A值。
1.7 蛋白质含量测定 1.8 统计分析应用t检验法检验实验组与对照组之间的差异。
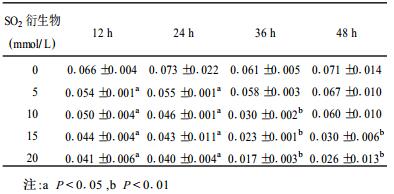
2 结果 2.1 SO2衍生物对CHL细胞CAT活性的影响(表 1)| 表 1 同浓度SO2衍生物对CHL细胞CAT活性的影响(K/g蛋白, x±s) |
如表 1所示, 实验组细胞在12, 24 h时酶活性都显著降低。其中5 mmol/L组随着时间的延长, 细胞酶活性逐渐恢复。而10, 15, 20 mmol/L组细胞却随时间延长而降低, 在36 h时酶活性显著降低。在48 h时, 酶活性有所回升, 5, 10 mmol/L组已分别恢复到对照组的93%和83%, 15和20 mmol/L组也比36 h时稍有升高, 但与对照组比较, 差异有统计学意义(P < 0.01), 这可能与NaHSO3在细胞中已被代谢或转化有关。但高剂量组细胞的酶活性恢复较少, 可见, 高剂量SO2衍生物对CHL细胞CAT的损伤较为严重。
2.2 VC对CHL细胞CAT活性的影响在VC处理4 h后弃去处理液, 立即测定CAT活性, 0, 0.05, 0.1, 0.25, 0.5 mmol/L组的计算值分别为(0.060±0, 002), (0.060±0.000), (0.063±0.004), (0.058±0.001), (0.059±0.001), 实验组与对照组比较, 差异无统计学意义; 继续培养12 h后, CHL细胞CAT活性明显升高, 5个剂量组的计算值分别为(0.059±0.001), (0.065±0.001), (0.072±0.002), (0.066±0.005), (0.068±0.005), 实验组与对照组比较, 差异有统计学意义(P < 0.05);培养24 h后CAT活性基本恢复, 与对照组比较, 差异无统计学意义。可见, VC对CAT活性有一定的增强作用, 但由于VC是一种不太稳定的还原剂, 因而被很快地转化或代谢而失去活性。
2.3 VC对SO2衍生物引起的CHL细胞CAT活性变化的干预(表 2)| 表 2 VC对SO2衍生物引起的CHL细胞CAT活性变化的干预(K/g蛋白, x±s) |
如表 2所示, VC和SO2衍生物共同作用后, CAT活性仍然呈下降趋势。但在培养12 h的细胞中, 加入VC的5, 10 mmol/L组都显著高于未加VC组的CAT活性; 在培养24 h的细胞中, 10, 15 mmol/L组与未加VC组差异有统计学意义(P < 0.05), 其他组差异无统计学意义。说明VC对低剂量SO2衍生物所造成的CAT活性降低有一定的干预作用, 但对高剂量造成的损伤不起作用或作用微弱。
2.4 CHL细胞中SOD的测定本实验中, 对照组和SO2衍生物处理组均未能检测到SOD的存在。这可能是由于CHL细胞中没有SOD, 也可能是由于含量低而无法用本实验的方法检测。
2.5 SO2衍生物对CHL细胞脂质过氧化的影响(表 3)| 表 3 VC对SO2衍生物引起的CHL细胞LPO变化的干预(nmol/ml, x±s) |
如表 3所示, SO2衍生物处理后细胞脂质过氧化水平均有增高, 处理12 h时10, 15 mmol/L与对照组比较, 差异有统计学意义, 20 mmol/L组与对照组比较, 差异有统计学意义(P < 0.01);24 h时, 5 mmol/L组与对照组比较, 差异有统计学意义(P < 0.05), 其余各组差异均有统计学意义(P < 0.01)。
2.6 VC对SO2衍生物引起的CHL细胞LPO变化的干预如表 3所示, VC和SO2衍生物共同作用后, 12和24 h时各组细胞脂质过氧化水平随SO2衍生物浓度增高仍然呈上升趋势, 且12 h时, 15和20 mmol/L组与对照组比较, 差异有统计学意义(P < 0.05, P < 0.01)。但是, 与同剂量的不加VC组比较却均有降低, 且10, 15, 20 mmol/L组比不加VC组有显著降低。24 h时, 加VC的组脂质过氧化水平较不加VC组的低, 但差异均无统计学意义。
2.7 VC对CHL细胞脂质过氧化的影响VC处理12 h时, CHL细胞脂质过氧化水平均有不同程度的降低, 0, 0.05, 0.1, 0.25, 0.5 mmol/L组的计算值分别为(0.387±0.002), (0.376±0.017), (0.328±0.0.5), (0.356±0.005), (0.376±0.011) nmol/ml, 且0.10, 0.25 mmol/L组与对照组比较, 差异有统计学意义(P < 0.05), 但处理24 h时, 各组均与对照组比较, 差异无统计学意义。
3 讨论SO2进入体内后, 主要以SO32-和HSO3-的形式发挥其生物学作用。而后者极易形成三氧化硫阴离子自由基(SO3-·), 进而形成过氧自由基(O2-)、羟自由基(OH·)等〔6〕。CAT中含有巯基(-SH), 易受自由基攻击〔7, 8〕, 自由基还攻击生物膜使不饱和脂肪酸发生过氧化〔9〕。本实验以SO2代谢衍生物对CHL细胞进行处理后, 发现CAT活性降低, LPO水平增高, 呈现一定的剂量-效应关系。从而进一步验证了SO2的自由基损伤学说〔10〕。本实验未能检测到SOD, 其原因有待进一步研究。
Etlik Ozdal等研究表明, VC、维生素E (VE)对SO2引起的红细胞脂质过氧化有保护作用〔11〕。本实验研究发现, VC单独处理后, 各组CAT活性只在12 h时显著升高, 同时LPO水平降低, 但是只有0.10, 0.25 mmol/L组与对照组比较, 差异有统计学意义。可见, 一定剂量的VC在一定时间范围内可以增强CHL细胞抗氧化酶的活性, 并降低其脂质过氧化水平。
VC和SO2共同作用后, CAT活性仍然呈下降趋势, 但添加VC的组CAT活性普遍高于相应的未加VC组, 且培养12 h时5, 10 mmol/L组及24 h时10, 15 mmol/L组与未加VC差异有统计学意义, 且VC也降低了SO2衍生物引起的LPO水平, 且12 h时10, 15, 20 mmol/L组比未加VC组有显著降低。说明VC对SO2衍生物所造成的CAT活性降低和LPO水平增高有一定的影响作用。
| [1] | Meng ZQ, Zhang L Z. Cytogenetic damage induced in human lymphocytes by sodium bisulfite[J]. Mutat Res, 1992, 298 : 63–69. DOI:10.1016/0165-1218(92)90030-4 |
| [2] | 孟紫强. 环境毒理学[M]. 北京: 中国环境科学出版社, 2000: 353-358. |
| [3] | 孟紫强, 张波. 二氧化硫吸入对大鼠血红细胞的氧化损伤作用[J]. 环境与健康杂志, 2001, 18(5) : 262–264. |
| [4] | 孟紫强, 张波. 二氧化硫吸入对大鼠脑组织细胞的氧化损伤作用[J]. 中国环境科学, 2001, 21(5) : 464–467. |
| [5] | Mitsunobu F, Yamaoka K, Hanamoto K, et al. Elevation of antioxidant enzymes in the clinical effects of radon and thermal therapy for bronchial asthma[J]. J Radiat Res, 2003, 44(2) : 95–99. DOI:10.1269/jrr.44.95 |
| [6] | 夏寿萱, 魏康, 章扬培. 分子放射生物学[M]. 北京: 原子能出版社, 1992: 89-92. |
| [7] | 送荣梁.自由基对生物大分子损伤及防护的研究进展[M].自由基生命科学进展:第2集.北京:原子能出版社, 1994:3-6. |
| [8] | 郭明, 徐亚丽, 刘明, 等. 几种农药对棉花过氧化氢酶过氧化物酶活性影响[J]. 农业环境保护, 2001, 20(1) : 10–12. |
| [9] | 孟紫强. 氧化应激效应与SO2全身性毒作用研究[J]. 中国公共卫生, 2003, 19(12) : 1422–1424. |
| [10] | 孟紫强, 张波, 秦国华. 二氧化硫对小鼠不同组织器官的氧化损伤作用[J]. 环境科学学报, 2001, 21(6) : 768–773. |
| [11] | Etlik O, Tomur A, Tuncer M, et al. Protective effect to antioxidant vitamins on red blood cell lipoperoxidation induced by SO2 inhalation[J]. J Basic Clin Physiol Pharmacol, 1997, 8(1-2) : 31–43. |
 2007, Vol. 23
2007, Vol. 23