2. 江西南昌科技大学
中性粒细胞(PMNs)在机体防御细菌感染时起着关键作用, 为了行使它们的功能, 细胞必须对胞外刺激作出反应〔1〕。膜电位和离子通道在非兴奋性细胞的信号转导中起重要作用。许多研究证明, 分布在中性粒细胞膜上的离子通道在胞外刺激和细胞趋化、氧化应激等反应过程中起着重要的作用〔2-4〕。K+通道具有不同亚型, 大多数研究集中于可兴奋性细胞的K+通道, 而对非兴奋性细胞的研究较少, 这就需要利用电生理技术观察和研究PMNs胞膜上K+通道的电流活动。本文采用膜片钳技术研究了人外周血中性粒细胞K+通道的特性, 为进一步阐明膜电位和离子通道在中性粒细胞功能中的作用提供基础数据。
1 材料与方法 1.1 外周血PMNs分离采用重复梯度密度离心的方法分离PMNs。从10名健康志愿者(南方医科大学在校本科生, 年龄在17~24岁, 男女不限)取外周静脉血5 ml, 乙二基四乙酸二钠(EDTA-Na2)抗凝, 用磷酸盐缓冲液(PBS)等倍稀释, 按10:3的比例加入淋巴细胞分离液(北京鼎国生物技术发展中心), 2 000 r/ min, 离心20 min。吸取白膜层, 再加入原体积的红细胞裂解液混匀, 静置20 min后离心沉淀细胞。将粗提纯的中性粒细胞悬液置于Percoll分离液(美国Pharmacia公司)上, 以75%和60% percoll液密度梯度离心收集PMNs, 1 250 r/ min, 15 min, 取65%与75% Percoll液界面之间的中性粒细胞, 用PBS洗涤, 去除残余Percoll胶粒, 获得PMNs。
1.2 电生理学记录微电极采用拉制仪PC-10(NARIS -AGE)两步拉制, 充灌电极液后入水测其阻抗为7~10 MΩ, 电极液与浴槽液成分均为(mmol/ L) 140 NaCl、5 KCl、1.2 CaCl2、1.2 MgCl2、10 Hepes、0.001河豚毒素(Tetrodotoxin, TTX)、0.2 CdCl2。通过三维液压操纵器使微电极接触细胞, 负压吸引形成1 GΩ的高阻密封, 细胞封接成功后, 即可进行细胞贴附式单通道记录。通过CEZ -2400型膜片箝放大器(CEZ2400, NIHONKOHDEN)对中性粒细胞单通道电流进行在线记录, 放大倍数设定为500 mV/ pA, 低通滤波频率为1 KHz。
1.3 统计分析应用SPSS10.0软件进行分析。统计方法除指明外均采用方差分析(ANOVA), P < 0.05为差异有统计学意义。
2 结果 2.1 中性粒细胞的电压依赖性K+通道的单通道电流(图 1)
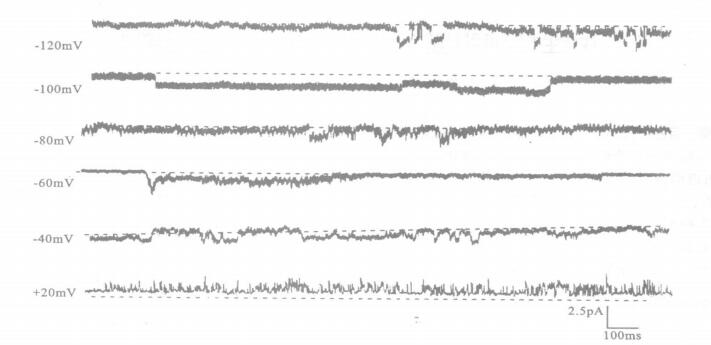
|
图 1 不同钳制电压下记录到的PMNs的K+单通道电流 |
在细胞贴附式记录中, 当施以不同的钳制电压时, 在所封接的膜片上记录到外向通道电流。通道开放时, 伴有明显的噪声增大。在电极钳位电压为+ 20~-70 mV的范围内, 对3例细胞的通道电流进行统计分析得到该通道的电导值为56 pS。
2.2 中性粒细胞胞膜上两种不同的K+单通道电流特性比较(图 2, 3)
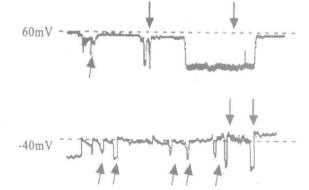
|
注: ↓为非电压依赖性的K+单通道电流; ↗为电压依赖性的K+单通道电流 图 2 在钳制电压为-60 mV和-40 mV时记录到的2种K+单通道电流 |
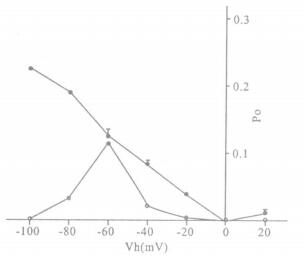
|
注: 图中横轴为不同钳制电压(Vh), 纵轴为开放概率(Po); ·代表电压依赖性K+通道; o空心圆圈代表非电压依赖性K+通道 图 3 2种K+通道随电压变化的开放概率比较 |
在贴附式膜片钳记录中发现, PMNs膜上存在2种不同的K+通道电流, 一种具有电压依赖性, 电导值γ=56pS; 一种是非电压依赖性的K+通道, 平均电流为-7.12+ 0.8pA。非电压依赖性的K+通道通常在钳制电位接近PMNs静息膜电位(-60 mV)时有较多的开放, 越偏离静息膜电位, 越不容易观察到这种电流的开放。
3 讨论有文献〔5〕报道, K+通道在PMNs功能执行过程中起重要作用。本实验用膜片钳单通道的记录方式研究了PMNS的K+通道的特性, 由于电极液与浴槽液内含有0.001 mmol/ L TTX和0.2 CdCl2mmol/ L, 分别阻断电压依赖性的Na+通道和Ca2+通道, 而Cl-通道在膜上分布很小, 一般单通道记录方式不容易记录到, 故本实验记录到的电流为K+通道电流。本实验发现, PMNs胞膜上存在2种不同的K+通道, 一种是电压依赖性的K+通道, 此通道对电压具有依赖性, 具有内向整流特性, 提示此类型的K+通道功能可能与维持PMNs的静息膜电位有关。另一种是非电压依赖性的K+通道, 此通道对电压不敏感, 具有外向整流特性, 主要在钳制电位接近PMNs静息膜电位(-60 mV)时有较多的开放, 越偏离静息膜电位, 越不容易观察到这种电流的开放, 推测与钙离子的激活有关。David Soto〔5〕等研究也表明, 与钙离子激活有关的K+和Cl-通道开放与细胞体积有关, 细胞在低渗溶液中, 体积增大, 激活钙离子流入, 钙离子的流入反过来激活钙依赖性的K+和Cl-通道, KCl和水分的丧失, 使得细胞恢复到正常的体积, 说明分离PMNs时对PMNs的影响不是很大。PMNs的许多功能例如极化和迁徙都与胞内钙离子浓度增加有关〔6〕, 细胞容积的变化也许是这些功能所必需的。而与细胞容积有关的非电压依赖性的K+通道在极化和趋化性中可能起着关键作用。当细胞出现自发或诱导极性时, 胞内钙离子浓度增加, 是否可以激活非电压依赖性的K+通道, 使细胞体积稳定到原来的状态, 减少细胞的极化现象, 其机制还有待于进一步研究。
| [1] | Verena Niggli. Signaling to migration in neutrophils: Importance of localized pathways[J]. The International Journal of Biochemistry & Cell Biology, 2003, 35 : 1619–1638. |
| [2] | Andreas S, Redwan M, FRCPath, et al. Involvement of ion channels in human eosinophil respiratory burst[J]. J Allergy Clin Immunol, 2000, 106 : 272–2793. DOI:10.1067/mai.2000.107752 |
| [3] | Inka Heiner, Jörg Eisfeld, Andreas Luckhoff. Role and regulation of TRP channels in neutrophil granulocytes[J]. Cell Calcium, 2003 : 533–540. |
| [4] | Andrei L, Kindzelskii Howard R. Petty ion channel clustering enhances weak electric field detection by neutrophils: apparent roles of SKF96365-sensitive cation channels and myeloperoxidase trafficking in cellular responses[J]. Eur Biophys J, 2005, 35(1) : 1–26. DOI:10.1007/s00249-005-0001-2 |
| [5] | David Soto, Nria Comes, Elisa Ferrer, et al. Modulation of aqueous humor outflow by ionic mechanisms involved in trabecular meshwork cell volume regulation[J]. Invest Ophthalmol Vis Sci, 2004, 45(10) : 3650–3661. DOI:10.1167/iovs.04-0060 |
| [6] | Kindzelskii AL, Petty HR. Intracellular calcium waves accompany neutrophil polarization, formylmethionylleucylphenylalanine stimulation, and phagocytosis: a high speed microscopy study[J]. J Immunol, 2003, 170(1) : 64–72. DOI:10.4049/jimmunol.170.1.64 |
 2007, Vol. 23
2007, Vol. 23

 , 蔡春青1, 吴航宇1
, 蔡春青1, 吴航宇1