雌二醇(17β-Estradiol)是天然雌激素的重要成分, 为防止儿童性早熟等问题, 食品中尤其是畜禽产品的雌二醇检测不容忽视。胶体金免疫层析技术(GICA)在检测小分子有机物方面越来越受到重视。其基本原理是胶体金颗粒能够稳定吸附蛋白质, 而蛋白质的生物活性无明显变化, 所以它可以取代酶标记抗体〔1, 2〕。本实验采用标记有雌二醇单克隆抗体的胶体金颗粒与相对应的固定在硝酸纤维膜上的雌二醇结合物相结合, 固定有雌二醇结合物的检测线处就显现明显的颜色〔3, 4〕。本法具有灵敏度高、特异性强、简便快速、成本较低、结果容易判读等优点, 适用于样品的初步筛选。
1 材料与方法 1.1 试剂与仪器氯金酸(上海化学试剂厂); 牛血清白蛋白、卵清白蛋白、兔抗鼠多抗(天津联星生物公司); 雌二醇标准品、雌二醇单抗、17β-Estradio l-6-one6-(o-car-bo xymethvyox ime)美国Sigma公司); 其他试剂均为国产分析纯。硝酸纤维膜、玻璃纤维膜(美国Millipore公司); Beckman Du530分光光度计(德国Beckman公司); 低温高速离心机(军事医学科学院); 点膜机(美国Bio-Dot公司)。
1.2 方法 1.2.1 胶体金的制备用三蒸水溶解氯金酸, 使其终浓度为0.1 g/L。先进行沸水浴, 待氯金酸溶液煮沸后, 每100 ml加入1%柠檬酸三钠2.5 ml, 再沸水浴下快速搅拌, 直到氯金酸溶液的颜色稳定, 继续沸水浴10 min〔5〕, 冷却至室温后, 用透射电镜镜检并用分光光度计检测颗粒均匀度及粒度。最后置于4 ℃冰箱保存备用。
1.2.2 最适标记蛋白量的确定用0.2 mol/L K2CO3将胶体金溶液调至pH为8.2, 然后取试管9支, 分别加入1.0 ml胶体金溶液。将雌二醇抗体逐级稀释后, 各取等体积稀释液顺序加入上述试管中, 混匀, 另设一不加抗体的对照管。放置10 min, 在各管中加入0.1 ml的10% NaCl, 混匀后静置2 h。观察各管中胶体金溶液变化, 未加蛋白及加入量不足的溶液颜色由红变蓝, 而加入蛋白量达到或超过时的溶液则保持不变。标记蛋白量即为最低稳定胶体金溶液不变色的蛋白量基础上再加20%。
1.2.3 胶体金探针的标记将抗体用0.005 mol NaCl溶液透析过夜, 离心除去蛋白沉淀, 调至0.5 mg/ml。取胶体金100 ml, 用0, 2 mol/L K2CO3将胶体金溶液调至pH为9.0, 磁力快速搅拌下缓慢加入2.4 ml稀释的雌二醇抗体, 继续搅拌10 min, 加入牛血清白蛋白(BSA), 使其最终浓度为1%, 再搅拌10 min。将初步制得的胶体金探针以4 000 r/mm离心20 min; 弃沉淀, 上清以10 000 r/min离心60 min; 弃上清, 沉淀用0.01 mol/L的磷酸盐缓冲液(PBS)(含1%牛血清白蛋白)重新悬浮; 同前离心洗涤2次, 将沉淀用0.01 mol/L的PBS (pH 8.2, 含1% BSA, 0.02% NaN3)悬浮, 4 ℃保存备用。
1.2.4 抗原的合成小分子物质难以固定在硝酸纤维膜上, 只有使它连上大分子物质才能较好地固定。本实验采用混合酸酐法制备完全抗原。雌二醇-6-肟43 mg, 加入三正丁胺50μl, 二氧六环4 ml, 冰浴冷却到10 ℃以下, 加入氯甲酸乙酯15μl〔6〕。4~10 ℃下反应30 min。配制卵清白蛋白(OVA)溶液(OVA 10 mg, 3 ml水, 3 ml二氧六环, 1 mol/L氢氧化钠0.3 ml)。将配制好的OVA溶液加入反应液, 4 ℃冰浴搅拌6 h, 反应过程中, 用氢氧化钠维持pH值为8。反应完毕后, 将反应液加入透析袋, 透析2 d。将透析液调至pH 4.5, 冰箱4 ℃, 放置4天, 有黄色沉淀出现。离心收集沉淀, 冷冻干燥, 4 ℃冰箱保存。将OVA溶于透析液内作为参比, 用紫外光谱法对雌二醇-6肟-OVA进行定性检验。经紫外测定证明蛋白质已与雌二醇衍生物结合。
1.2.5 胶体金免疫层析试纸条制备测试条由玻璃纤维膜、硝酸纤维膜、加样纸、吸水纸4部分组成。将玻璃纤维膜裁成6 mm的细条, 然后放入含1% BSA、1% Tween-20的PB液中浸泡30 min, 37 ℃烘干, 最后将胶体金探针灌注已处理好的玻璃纤维膜上, 真空干燥备用。在硝酸纤维膜上用点膜机将上述抗原和兔抗鼠IgG喷成2条线, 分别为检测线和对照线, 经真空干燥后, 用1% BSA、0.01 mol/L PBS (pH 9.0)封闭2 h, 以0.01 mol/L PBS洗涤, 再真空干燥。将30 mm吸水纸、25 mm硝酸纤维膜、6 mm玻璃纤维膜、15 mm加样纸, 由顶部依次粘于PVC板上, 裁成细条备用。
1.2.6 检测与判读样品:含已知浓度雌二醇样品的乙醇溶液分为3组, 第1组不加雌二醇, 第2组为0.2 μg/ml雌二醇, 第3组为0.4 μg/ml雌二醇。将加样纸一端插入待测液, 湿润后取出, 水平放置, 约3~5 min, 观察结果。如试纸条硝酸纤维膜上仅对照线呈一条紫红色带为阳性; 如出现2条紫红色带为阴性; 如质控线不出现紫红色带, 无论检测线是否出现, 测试结果均无效。
2 结果与分析 2.1 胶体金颗粒大小选择胶体金颗粒吸附蛋白并显示检测结果, 其大小是重要影响因素之一。胶体金颗粒的大小, 由制备胶体金时加入的柠檬酸三钠量决定, 当柠檬酸三钠加入越多, 胶体金颗粒也越多, 但颗粒直径越小, 反之胶体金颗粒越大。胶体金颗粒小, 结合蛋白量少, 反应结合率低, 另外难以显示明亮清晰的颜色, 影响显色效果; 胶体金颗粒大, 其结合蛋白后不稳定, 不易保存, 另外其结合蛋白后难以通过膜〔7〕。本实验选用的胶体金颗粒直径约为15 min, 既可以通过膜, 反应彻底, 又易保存, 反应结果显色清晰。
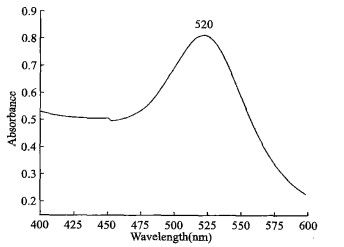
2.2 胶体金颗粒鉴定胶体金颗粒大小及均一程度是检测结果可靠的基础, 制备完毕后须经质量鉴定才能应用。用Beckman Du 530分光光度计对胶体金进行扫描, 发现其主峰宽度较小, 表明制备的胶体金颗粒较均匀, λmax为520 nm (图 1), 表明其粒度约为15 nm〔8〕。用电镜观测结果(图 2)与分光光度计测定结果一致。电镜观测是鉴定胶体金颗粒粒径及分布的标准, 但这种方法不便用于日常工作使用, 而用分光光度计测定操作简便, 更适合实验室日常使用。
|
图 1 胶体金的可见光谱图 |
|
图 2 胶体金电镜图 |
2.3 最适蛋白量
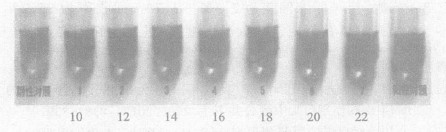
阴性对照为未加抗体管, 1~7管抗体浓度分别为10, 12, 14, 16, 18, 20, 22 μg/ml, 阳性对照为胶体金溶液。可见, 本实验最适标记蛋白量为20 μg/ml (图 3)。
|
阴性对照为未加抗体管; 阳性对照为胶体金溶液 图 3 胶体金与雌二醇抗体结合浓度确定实验 |
2.4 E2-OVA浓度
用PBS (pH7.4)溶解E2-OVA浓度为0.05~1.0 mg/ml, 喷在硝酸纤维膜上作检测线, 发现E2-OVA浓度越高, 检测液中也需要越高浓度的E2与之竞争, 检测灵敏度也就越低。但是, E2-OVA浓度低于0.5 mg/ml, 检测线颜色太弱, 难用肉眼分辨。
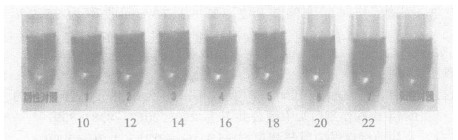
2.5 检测限本实验的检测限是以完全看不见检测线为最低检测限〔9〕。将雌二醇标准品用甲醇配制成0.4, 0.2, 0.1, 0.05 μg/ml 4个标准溶液, 用上述检测方法进行检测(图 4)。由图可见, 最低检测线为100 ng/ml。

|
图 4 试纸条检测样品 |
2.6 对比实验
取30份样品, 检测分为3组, 第1组不加雌二醇, 第2组加0.2 μg/ml雌二醇, 第3组加0.4 μg/ml雌二醇, 分别用GICA法与气质联用法(GC/MS)检测。实验结果显示, 第1组2种方法均未检出; 第2组GICA法阳性9粒, 阴性1粒, GC/M S法阳性10粒; 第3组2种方法均检测阳性。由此可见, 与标准检测方法相比, GICA法准确度为96.67%。
2.7 交叉反应试验实验结果显示, 与己烯雌酚、炔雌酚、壬基酚、阿特拉津及双酚A等环境内分泌干扰物中的环境雌激素无交叉反应, 表明该方法具有良好的特异性。
3 小结目前, 关于雌二醇的检测有气、液相色谱和光谱、质谱等方法, 但其仪器昂贵、操作复杂、检测时间较长。本文建立的免疫胶体金层析法具有灵敏度高、特异性强、简便快速、成本较低、结果容易判读等优点, 且无需任何仪器, 操作简单, 适用于样品的初步筛选。
| [1] | Dykman LA, Bogatyrev VA. Colloidal gold in solidphase aβays[J]. Biochemistry (Moscow), 1997, 62 : 350–356. |
| [2] | Hayat MA. In Colloidal Gold: Principles, Methods and Applica -tions; Academ ic Preβ[M].San Diego Avcad Preβ, 1989: 15-19. |
| [3] | Horton JK, Swinburne S, O.Sullivan MJ. A novel rapid, singlestep immunochromatographic procedure for the detection of mouse immunoglobulin J[J]. Immunol Methods, 1991, 140 : 131–134. DOI:10.1016/0022-1759(91)90135-3 |
| [4] | Dequaire M, Degrand C, Lmaoges B. An electrochemical, metalloim -munoaβay based on a colloidal gold label[J]. Anal Chem, 2000, 72 : 5521–5528. DOI:10.1021/ac000781m |
| [5] | Horisberger M, Rosset J. Colloidal gold, a useful marker for transmiβion and scanning electron microscopy J[J]. Histochem Cy -tochem, 1997, 25(4) : 295. |
| [6] | 姜玲, 章文才, 柯云, 等. 抗槲皮素抗体的研制[J]. 中国免疫学杂志, 2000, 16(5) : 383–385. |
| [7] | Deng Y P, Zhao H Q, Jiang L. Applications of nanogold particles in biomimetic engineering[J]. China Basic Sci, 2009, 9 : 1–17. |
| [8] | 彭剑淳, 刘晓达, 丁晓萍. 可见光光谱法评价胶体金粒径及分布[J]. 军事医学科学院院刊, 2000, 24(3) : 11. |
| [9] | Pei Zhou, Yitong Lu. Nanocolloidal gold-based immunoassay for the detection of the N-Methylcarbamate pesticide carbofuran[J]. Agric Food Chem, 2004, 52 : 4355–4359. DOI:10.1021/jf0499121 |
 2007, Vol. 23
2007, Vol. 23
