2. 厦门大学生命科学学院
铜锌超氧化物歧化酶(Cu, Zn-SOD)因为可以消除O2-·而被广泛应用于延缓衰老和控制炎症, 但是由于多种因素影响, 尤其是Cu, Zn-SOD具有种质特异性以及在体内停留时间短(通常只有6~10 min), 使得Cu, Zn-SOD的应用受到很大限制。定点突变技术是改造、优化基因常用的手段, 也是研究蛋白质结构和功能之间复杂关系的有效方法, 在医学上还可用于基因治疗等。目前常用的定点突变方法有寡核苷酸引物介导的定点突变、重叠延伸PCR定点突变及盒式突变等〔1〕。但由于这些方法操作繁琐, 意外突变多等缺陷, 使定点突变的实验受到一定限制。本研究采用一种近年来新的定点突变技术-快速PCR定点突变方法成功地对hCu, Zn-SOD进行了基因改良(将hCu, Zn-SOD基因中非活性中心的Cys111密码子突变为Ala密码子, 以提高其稳定性), 同时对该定点突变技术要点进行探讨。
1 材料 1.1 菌株与质粒E.coliDH5α, 由本实验室保存。质粒pESOD (含hCu, Zn -SOD基因、Ampr基因以及EcoRI酶切位点, 整个质粒约3.3 kb)由本实验室构建, 并转化于E.coliDH5α保存。
1.2 主要试剂Pfu高保真DNA聚合酶(深圳晶美生物工程有限公司); DpnI酶(河南华美生物工程有限公司); 小量质粒快速抽提纯化试剂盒(上海博亚生物技术有限公司); DNA Marker, T4DNA连接酶, Eco RI等常规酶(上海Sangon公司)。
1.3 pESOD质粒提取及鉴定用质粒快速抽提纯化试剂盒从含pESOD质粒的E.coliDH5α转化菌里提取pESOD质粒, 取部分质粒用EcoRI酶切后琼脂糖电泳鉴定, 另取部分质粒送上海博亚生物技术有限公司测序。
1.4 定点突变 1.4.1 引物设计根据hCu, Zn -SOD基因序列和定点突变的要求(将hCu, Zn -SOD中第111位Cys的密码子TGC突变为Ala密码子GCC)设计出一对包含突变位点的引物(正、反向) P1和P2, 具体序列如下:P1:5′CTCTCAGGAGAC-CATGCCATCATTGGCCGCAC 3′; P2:5′GTGCGGCCAAT-GATGGCATGGTCTCCTGAGAG 3′。下划线的碱基为突变位置。所有引物均由上海博亚生物技术有限公司合成。
1.4.2 PCR定点突变整个反应体系为50μl, 其中含无菌去离子水41μl, 10 ×Pfu Polymerase Buffer (含Mg2+)5μl, 20 μmol/L P1、P2引物各1μl, pESOD质粒1μl (约100 ng), Pfu DNA聚合酶1μl (5 U); 反应条件为:94℃预变性3 min; 然后94℃变性1 min, 65℃ 30 s, 72 ℃延伸7 min, 25个循环; 最后72℃延伸7 min, 4 ℃保存。
1.4.3 转化用Dpn I限制性内切酶处理PCR反应产物, 直接转化感受态的E.coliDH5α, 涂布培养后随机挑3个菌落并提取相应质粒, 由上海博亚生物技术育限公司测序, 测序引物P3:5′ACTCAGGTACTGGGAGTG 3′。
2 结果 2.1 提取的质粒经EcoR I酶切后琼脂糖电泳质粒大小为3300bp左右, 证明所提取的质粒就是p ESOD质粒, 见图 1。
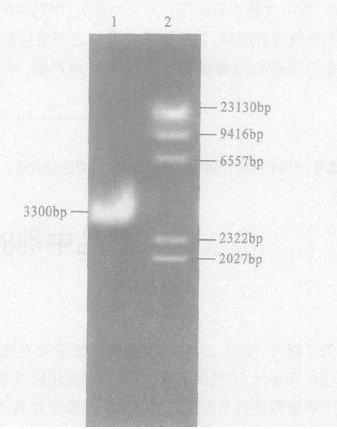
|
图 1 pESOD质粒经EeoRI酶切后琼脂糖电泳 |
2.2 PESOD质粒测序的部分结果
所测序列与文献〔2〕报道的hCu, Zn -SOD序列对比完全一致, 证明pESOD质粒内含的hCu, Zn -SOD基因完全正确。
2.3 定点突变后3个质粒测序结果及突变前后序列对比(图 2)

|
A :突变后的hCu , Zn - SOD 基因序列;B : hCu , Zn - SOD 基因序列 图 2 hCu, Zn-SOD基因突变前后部分序列对比 |
3个质粒的测序结果有2种, 分别和文献〔2〕的hCu, Zn -SOD序列对比:其中1个质粒测序结果和hCu, Zn -SOD基因序列完全一致, 说明突变未成功; 另外2个质粒分别有2个碱基和hfu, Zn -SOD因序列不同, 也就是Cys的密码子TGC变成了Ala的密码子GCC, 其他序列与hCu, Zn -SOD基因一致, 符合预期要求; 图 2中没有短线条相连的部分为突变前后2序列的不同之处。
3 讨论通过快速PCR定点突变, 本研究实现了把hCu, Zn -SOD基因中的Cys111突变为Ala111。整个突变过程只需要1次PCR反应、1次Dpn Ⅰ酶解和1次转化, 即完成了定点突变, 无需对PCR产物进行末端处理, 也无需进行亚克隆等, 大大减少了传统定点突变的工作量, 而突变成功率较高(本次实验随机挑取的3个菌落中有2个是阳性突变菌落), 尤其适用于大肠埃希菌来源的DNA。
快速PCR定点突变的技术要点:(1)准备突变的质粒必须是甲基化。(2)引物是一对包含突变位点的互补的(正、反向)核苷酸链, 而且要比一般的PCR引物(18 bp~21 bp)长, 一般要在25 bp以上, 因为引物中含有突变位点, 和模板不能完全匹配。(3)须要高保真的DNA聚合酶如Pfu Turbo聚合酶。(4) PCR产物要用Dpn Ⅰ酶充分酶切消化, 以提高突变检出率。(5) PCR延伸步骤时间要充足; 因为Pfu DNA聚合酶扩增速率为0.5 kb/min, 比Taq酶慢1倍左右。(6)高保真Pfu DNA聚合酶酶量要比普通PCR所需的Taq酶多一些; 因Pfu DNA聚合酶不但扩增速率较慢, 而且一步法PCR定点突变扩增的是整个质粒, 故所需的总时间比一般的PCR时间要长很多, 适当增加酶量以补充长时间高温下的酶活力损失。(7)克隆子最后需经测序验证; 高保真不等于100%保真。本研究挑选测序的3个菌落中有1个是未突变的阴性菌落, 故后续的测序步骤不能省略。
| [1] | 罗师平, 冷希岗. 基于PCR的体外诱变技术[J]. 国外医学生物医学工程分册, 2005, 28(3) : 188–192. |
| [2] | Sherman L, Dafni N, Lieman-Hurwitz, et al. Nucleotide sequence and expressionof human chromosome 21 -encoded superoxide dis2 mutase mRNA[J]. PNAS, 1983, 80(18) : 5465–5469. DOI:10.1073/pnas.80.18.5465 |
 2007, Vol. 23
2007, Vol. 23
