铅具有显著的神经发育毒性。毒理学实验和人群流行病学调查表明, 铅能对神经系统造成不可逆性损害, 严重损坏海马神经元, 影响学习、记忆及行为发育〔1, 2〕。硒有防止铅吸收和加速其排泄的作用, 因此, 硒有可能成为有效防治铅神经毒性的重要资源〔3〕。为了解硒拮抗铅神经毒性的效果和研究其拮抗作用机制, 同时也为更多有效地利用硒, 本试验对体外原代培养的Wistar乳鼠海马神经元进行低剂量PbCl2和Na2SeO3染毒, 观察低水平铅、硒单独和联合作用对神经细胞生长和存活的影响。
1 材料与方法 1.1 材料 1.1.1 试剂解剖液、种植培养液、无血清培养液[由98% Neurobasal培养基和2%B27(美国Gibco公司)无血清培养基添加剂和1%的青霉素、链霉素和0.05 mol/L的谷氨酰胺(美国Sigma公司)组成]; 胰酶、DNase Ⅰ、左旋多聚赖氨酸和台盼兰(美国Sigma公司); PbCl2(上海试四赫维化工有限公司); Na2SeO3(天津化学试剂研究所)。神经元特异性烯醇化酶(NSE)抗体和神经丝蛋白(NF)抗体(北京中山生物技术有限公司)。
1.1.2 仪器CO2细胞培养箱(美国Shel Lab公司); 全自动图像分析系统(德国KONTRON公司); 图像摄录输入仪(日本JVC公司); 倒置显微镜(德国ZEISS公司)。
1.1.3 动物出生24 h内Wistar大鼠(中山大学北校区动物中心)。
1.2 方法 1.2.1 海马神经细胞的分散、移植和培养参考文献〔4〕, 将乳鼠全身消毒后分层剪开头皮和颅骨, 暴露两侧脑半球, 分开颞叶皮层, 暴露并取出海马回, 置解剖液中; 清洗后剪碎成糊状, 0.125%胰酶消化20 min, 终止消化后离心、过筛、CO2培养箱内培养。第2 d更换无血清培养液, 以后每隔2 d换液1次, 每次更换一半培养液。培养第2, 3, 4, 5, 6和7 d在倒置显微镜下观察细胞生长情况。
1.2.2 分组及染毒设对照组、Pb组、Se组、Pb+Se组和先Pb后Se组。对照组加入30 μl的磷酸盐缓冲液, Pb组加入30 μl Na2SeO3, Pb+Se组同时加入PbCl2和Na2SeO3各30 μl, 先Pb后Se组于培养第2 d换液时加入30 μl的PbCl2, 次日半量换液并加入30 μl的Na2SeO3。使PbCl2、Na2SeO3的终浓度分别为1×10-5 mol/L和2×10-6 mol/L。以后换液时补入相应量的PbCl2或Na2SeO3, 维持终浓度不变。
1.2.3 神经元存活率的测定每次到培养的时间终点, 收集细胞, 洗涤定容后取10 μl细胞悬液台盼兰拒染法进行镜下活细胞计数, 获得各个剂量组不同时间终点的活细胞总数, 再分析与同一观察时间的对照组的活细胞总数, 比较计算各组细胞的相对存活率。
1.2.4 神经元突起的测定倒置显微镜下(200×), 随机选择3个视野, 利用图像自动分析仪测量形态可辨的所有神经元突起的长度。
2 结果 2.1 海马神经元形态观察对照组和单独硒作用组的海马神经元镜下呈圆形, 体积小, 透亮, 散在分布; 培养2 h后开始贴壁, 6 h后绝大部分细胞已贴壁, 光晕明显; 12 h细胞几乎全部贴壁, 且长出短小的突起; 2 d后细胞有明显增长的突起, 胞体饱满多数呈梭形、锥形, 胞浆丰富, 核大, 核仁隐约可见, 背景中可见极少数扁平状多边形的神经胶质细胞铺垫; 5~6 d细胞相互间搭连成片, 胞体间突起连接成网状逐渐明显; 7 d神经元数目不等地聚集成团, 突起联结成网。与对照组比较, 单独硒作用组的神经元胞体更丰满, 神经元突起更长、更粗壮。
铅单独作用组(10-5 mol/L)的神经元生长改变情况如下:(1)贴壁减少:24 h后, 培养基中悬浮细胞数目较对照组多, 贴壁细胞数减少, 致使细胞在培养皿底部分布不均匀; (2)生长迟缓:第3 d与对照组比较, 散在分布的小体积圆形透亮细胞仍然较多, 形态和大小与细胞刚种植时的情形无明显差别; (3)出芽延迟:对照组12~24 h即可见短小突起, 铅细胞种植后第2 d才开始看见细胞变成梭形, 伸出短小突起; (4)碎片增多:倒置显微镜下的视野中悬浮细胞和死亡细胞的碎片较多, 培养后第7 d, 培养皿中的神经元已极其稀疏; (5)成团提前:正常神经元在本培养条件下第7 d可见明显的成团现象, 铅组于第4 d即可见神经元细胞5~10个聚齐成团, 第5 d可见成团细胞中间神经元边界模糊, 核仁消失, 部分出现裂解, 第7 d成团神经元消失, 皿中细胞数目显著减少。
铅硒同时作用组神经元生长的改变情况与铅作用组相似, 也出现了贴壁减少、生长迟缓、碎片增多和成团提前的改变, 但是二者不完全相同, 铅硒同时作用组神经元出芽晚于对照组但较铅组早, 培养第6和第7d, 贴壁神经元数目明显较铅组多。先加铅后加硒作用组早期改变与铅组相同, 但从培养第4 d开始, 与铅组相比, 贴壁神经元数目增多, 细胞碎片减少, 突起较多且较为粗壮。
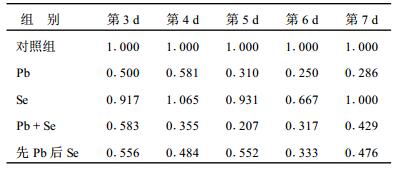
2.2 海马神经元存活率分析(表 1)| 表 1 Pb、Se对海马神经元存活率的影响(%) |
表 1可见, 10-5 mol/L铅引起神经元存活率明显下降; 单独硒(2×10-6 mol/L)对海马神经元存活率的影响不明显; 铅硒同时孵育组, 存活率最低, 提示使用的硒作用剂量可能偏高。
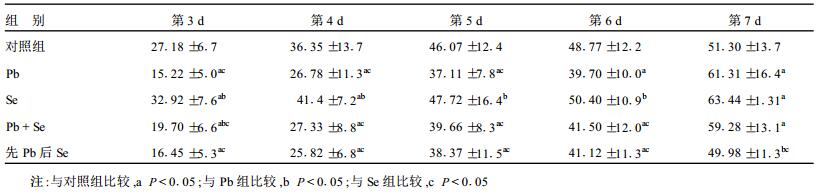
2.3 海马神经元突起长度分析(表 2)| 表 2 Pb、Se对海马神经元突起长度的影响(μm, x±s) |
表 2可见, 10-5 mol/L铅明显抑制了原代培养的海马神经元突起生长(P < 0.05), 单独硒(2×10-6 mol/L)作用有明显促进海马神经元突起生长的作用, 尤其在神经元突起生长早期(P < 0.05);铅和硒共同孵育时, 培养早期硒能拮抗铅对神经元突起延伸的抑制(P < 0.05), 但随着培养时间延长, 这种拮抗作用变得不明显。
3 讨论低剂量的铅一方面可以引起包括神经细胞在内的多种细胞发生凋亡〔4, 5〕, 另一方面可以通过多种途径引发神经元死亡〔6, 7〕。因此, 本研究所观察到的铅抑制体外培养的神经元的存活, 应该是铅诱导神经元凋亡和诱发神经元坏死共同作用的结果。本次实验发现, 硒对体外培养的海马神经元突起的生长有很明显的促进作用, 但作用机制不清楚, 硒是否在神经元生长发育过程中参与了对神经细胞粘附因子(NCAM)表达调控需进一步研究。本实验中未观察到硒对体外培养的海马神经元的存活有明显的影响。铅硒共育组较铅组在神经元突起长度上存在差异, 尤其在生长早期, 提示硒对铅抑制神经元突起生长具有一定的拮抗作用, 至于这种拮抗作用随培养时间延长而逐渐减弱至不显著, 认为可能与铅的毒作用剂量过高有关, 从神经元存活率的结果也能反映这一点, 由于高剂量的铅导致对神经元生长的累积毒效应已经超过了硒的拮抗能力。提示应进一步降低铅的毒作用剂量再进行观察研究。
| [1] | Stewart WF, Stewat BS, Simon D, et al. Neurobehavioral function and tibial and chelatable lead levels in 543 former organolead workers[J]. Neurology, 1999, 52(8) : 1610–1617. DOI:10.1212/WNL.52.8.1610 |
| [2] | 胡前胜, 董胜璋, 任铁玲, 等. 儿童齿铅与智商关系流行病学研究[J]. 环境与健康杂志, 1999, 16(1) : 16. |
| [3] | Nehru B, Dua R. The effect of dietary selenium on lead neurotoxicity[J]. J Environ pathol toxicol oncol, 1997, 16(1) : 47–50. |
| [4] | De la Fuente H, Portales-Perez D, Baranda L, et al. Effects of arsenic, cadmium and lead on the induction of apoptosis of normal human mononuclear cells[J]. Clin Exp Immunol, 2002, 129(1) : 69–77. DOI:10.1046/j.1365-2249.2002.01885.x |
| [5] | He L, Pobenz AT, Medrano CJ, et al. Lead and calcium produce rod photoreceptor cell apoptosis by opening the mitochondrial permeability transition pore[J]. J Bio Chem, 2000, 275 : 12175–12184. DOI:10.1074/jbc.275.16.12175 |
| [6] | Adonaylo VN, Oteiza PI. Lead intoxication:antioxidant defense and oxidative damage in rat brain[J]. Toxicology, 1999, 135 : 77–85. DOI:10.1016/S0300-483X(99)00051-7 |
| [7] | 李茂进. 铅影响学习记忆的研究进展[J]. 国外医学卫生学分册, 2000, 27(3) : 139–143. |
 2007, Vol. 23
2007, Vol. 23