2. 军事医学科学院放射医学研究所;
3. 江苏省肿瘤医院B超室
细胞凋亡是电离辐射导致造血系统损伤的主要方式。预防与控制造血干/祖细胞大量凋亡, 有效恢复机体造血功能, 在未来可能爆发的核事故、核战争以及肿瘤放射治疗副反应控制等领域都具有十分重要的意义〔1〕。造血细胞信号转导过程受蛋白质酪氨酸磷酸酶(protein tyrosine phosphotases, PTP)的调控〔2〕。过钒酸钠(pervanadate, Per)作为PTP特异性抑制剂, 参与细胞内多条信号通路信息的传递过程的调节〔3〕。通过改变PTP活性调控造血细胞受体信号转导通路, 可能成为继重组人粒细胞集落刺激因子(G-CSF)、促红细胞生成素(EPO)、重组血小板生长因子(TPO)等细胞因子之外的促进辐射造血损伤修复的发展方向〔4〕。本研究观察Per对照射后BET-2细胞线粒体膜电位改变及细胞凋亡的影响, 探讨调控造血细胞受体信号通路中PTP活性对造血细胞电离辐射损伤的保护作用。结果报告如下。
1 材料与方法 1.1 材料 1.1.1 BET-2细胞BET-2细胞为促红细胞生成素(EPO)依赖的鼠源性髓系白血病细胞株(军事医学科学院第3研究所张明伟惠赠)。悬浮于含10%马血清的1 640完全培养基中, 加入EPO至终浓度为2 U/ml, 置37℃, 5% CO2孵箱培养, 隔日换液, 取指数生长期细胞用于试验。
1.1.2 主要试剂与仪器罗丹明123、四甲基偶氮噻唑蓝(MTT, 美国Sigma公司)。原钒酸钠(NaVO3)、双氧水(H2O2):用双蒸水配制为200 mmol/L的储存液, 过滤除菌, 4℃保存。促红细胞生成素(EPO)活性为1×105U/mg, 纯度 > 95%, 由北京放射医学研究所汤仲明教授提供。MODEL 450型酶联仪(美国BIO-RAD公司); FACSCalibur型流式细胞仪(美国Becton Dickson公司)。
1.2 方法 1.2.1 照射条件军事医学科学院放射医学研究所60Co γ射线照射源, 一次照射剂量分别为3, 5 Gy, 剂量率为1.48~1.57 Gy/min。
1.2.2 Per制备〔5〕将200 mmol/L原钒酸钠50 μl及200 mmol/L H2O250 μl加入400 μl 1 640培养液中, 21℃水浴反应15 min, 加入5 μl H2O2酶终止反应。用1 640培养液稀释成应用液现配现用。
1.2.3 MTT方法将待测细胞用RPMI 1 640培养液洗涤3次, 台盼兰染色计数活细胞, 用上述完全培养基分为无Per组及Per实验组(Per终浓度为5 μmol), 调整细胞浓度至3×105/ml, 每孔100 μl加入96孔板中; Per用RPMI 1 640递减稀释后, 每孔加入100 μl, 每组做3个复孔, 37℃培养48 h, 加MTT (50 mg/ml)20 μl, 继续培养4 h, 离心, 弃上清, 加入200 μl二甲基亚砜(DMSO), 振荡助溶, 在MODEL 450酶联仪上测492, 630 nm双波长的A值, 以Per浓度指数为横坐标, 以A值纵坐标绘图。应用ORIGI Nversion2.94软件中Logistic程序进行拟合处理分析。
1.2.4 细胞线粒体膜电位(ΔΨm)测定〔6〕取1×105细胞, PBS洗涤2次, 加入罗丹明123储存液至终浓度为10 μmol/L, 室温下平衡30 min, PBS洗涤3次, PBS稀释至细胞浓度为1×105/ml, 上机检测, 激发光波长为488 nm, 计数1×104个细胞, 测定细胞相对荧光强度, 数据经流式细胞仪Kolmogorov-Smirnov Statistics软件进行结果分析。
1.2.5 细胞凋亡检测按德国宝灵曼公司Annexin-V-FLUOS凋亡分析试剂盒说明书进行。取约1×106细胞, PBS洗涤, 200 g×5 min, 弃尽上清, 重悬于100 μl Annexin-V-FLUOS标记缓冲液[1 000 μl溶液Ⅲ中预先加入20 μl Annexin-V-FLUOS单抗及20 μl 50 Lg/ml溴化丙锭(PI)]中, 避光, 室温放置10~15 min, 加溶液Ⅲ(100 mmol Hepes/NaOH, pH 7.4, 140 mmol NaCl, 5 mmol CaCl2)0.4 ml, 上机检测。
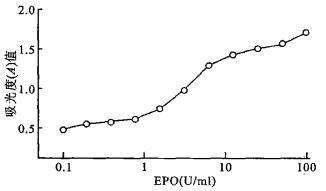
2 结果 2.1 BET-2对EPO细胞增殖反应性(图 1)
|
图 1 BET-2对EPO的增殖反应性 |
培养基中EPO浓度 < 015 U/ml时, BET-2细胞增殖停止; 在1~2 U/ml之间即有良好促增殖作用; EPO浓度 > 4 U/ml, 其促增殖能力已达饱和。表明BET-2细胞对EPO有较好的依赖性, 保持了稳定的生物学特性。
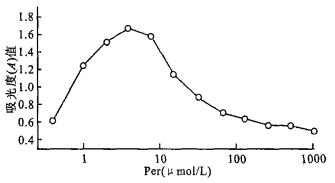
2.2 Per对BET-2细胞增殖反应性(图 2)当Per浓度 < 0.05 μmol/L时, 对细胞无明显效果; Per≥62.5 μmol/L时, 导致细胞死亡; 而在1~31.25 μmol/L时可明显促进BET-2细胞在缺乏EPO状况下的增殖。提示适量Per具有细胞因子样作用, 可促进BET-2细胞增殖。因此, 在下述实验中, 使用Per的终浓度为5 μmol/L。
|
图 2 BET-2对Per的增殖反应性 |
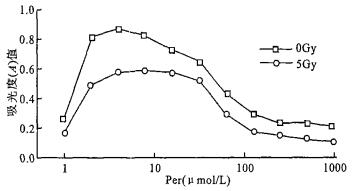
2.3 Per对电离辐射所致BET-2细胞增殖抑制的影响(图 3)
对于未照射的BET-2细胞, 适当浓度Per可明显促进BET-2细胞在缺乏EPO状况下的增殖; 对于5 Gy γ射线照射后的BET-2细胞, 1~31.25 μmol/L的Per仍能明显促进BET-2细胞在缺乏EPO状况下的增殖。提示电离辐射可能导致细胞信号转导过程中负调控)酪氨酸磷酸酶作用的增强, 抑制细胞的增殖。
|
图 3 照射前后BET-2细胞对Per增殖反应性 |
2.4 Per对电离辐射后BET-2细胞MMP改变的影响
未处理的BET-2细胞相对荧光强度为181.11±8.99, 3 Gy照射细胞相对荧光强度为164.20±8.70, 5 Gy照射细胞相对荧光强度为130.93±9.10, 组间比较差异均有统计学意义(P < 0.01), 表明随着照射剂量增加, 细胞线粒体膜电位(ΔΨm)呈逐渐下降的趋势。5 Gy照射12 h后细胞相对荧光强度为102.63±8.56, 而照射即刻加入Per (终浓度为5 μmol/L), 细胞相对荧光强度为168.37±9.15(未处理的BET-2细胞相对荧光强度为183.59±14.22), 组间比较差异有统计学意义(P < 0.01), 表明Per可明显缓解照射后BET-2细胞线粒体膜电位(ΔΨm)下降的程度。
2.5 Per对电离辐射后BET-2细胞凋亡的影响5 Gy照射后12 h, 存活细胞(LL象限)比例为67.29%, 凋亡及坏死细胞(UL+UR+LR象限)达到32.71%;照射后即刻加入Per (终浓度为5 μmol/L), 存活细胞93.43%, 凋亡及坏死细胞仅为6.57%, 组间比较差异有统计学意义(P < 0.01), 表明Per可显著减少照射后BET-2细胞凋亡的发生。
3 讨论研究表明, 凋亡细胞在表现出明显的核凋亡之前, 线粒体失去其跨膜电势-线粒体膜电位(MMP), 这种膜电位的崩解出现在许多类型的细胞中。线粒体膜电位的改变是细胞凋亡效应阶段前的一个重要标志〔6, 7〕。
本研究结果表明, 电离辐射可导致鼠源性EPO依赖的BET-2细胞线粒体膜电位(ΔΨm)下降, 抑制细胞增殖, 诱导细胞凋亡。而在照射后即刻加入适量PTP特异性抑制剂Per, 则可明显缓解受照后BET-2细胞线粒体膜电位(ΔΨm)下降趋势, 显著减少电离辐射诱导的细胞凋亡, 有效促进受到辐射损伤BET-2细胞的存活、增殖。Per对辐射损伤后的BET-2细胞有一定的保护作用。
结果提示, 电离辐射可能直接或间接地激活了蛋白质酪氨酸磷酸酶(PTP)负调控过程, 从而引发造血细胞受体增殖信号抑制, 导致细胞线粒体膜电位(ΔΨm)下降, 可能是辐射诱导细胞凋亡的机制之一〔8〕。
| [1] | 罗庆良, 从玉文, 郝静, 等. 造血因子与急性放射病[J]. 解放军医学杂志, 2005, 30(3) : 186–190. |
| [2] | Cohen J, Oren-Young L, Klingmuller U, et al. Protein tyrosine phosphatase 1B participates in the down-regulation of erythropo-ietin receptor signalling[J]. Biochem J, 2004, 377(Pt 2) : 517–524. |
| [3] | Tonks NK. Redox redux:revisiting PTPs and the control of cell signaling[J]. Cell, 2005, 121(5) : 667–670. DOI:10.1016/j.cell.2005.05.016 |
| [4] | Lawson AE, Bao H, Wickrema A, et al. Phosphatase in hibition promotes antiapoptotic but not proliferative signaling pathways inery-thropoietin-dependent HCD57 cells[J]. Blood, 2000, 96(6) : 2084–2092. |
| [5] | 从玉文, 陈家佩, 邵源. 辐射后造血细胞对造血因子增殖反应性变化的研究[J]. 军事医学科学院院刊, 1999, 23(2) : 119–122. |
| [6] | 张海涛, 张海风, 祝其锋, 等. 鲎血细胞多肽诱导HL-60细胞凋亡时线粒体膜电位的变化[J]. 中国癌症杂志, 2002, 12 : 123–126. |
| [7] | Tefano Salvioli, Cristiana Barbi, Jurek Dobrucki. Opposite role of changes in m it ochondrial membrane potential in dif ferent apoptotic processes[J]. FEBS Letters, 2000, 469 : 186–190. DOI:10.1016/S0014-5793(00)01266-7 |
| [8] | Paling NR, Welham MJ. Tyrosine phosphatase SHP-1 acts at different stages of development to regulate hematopoiesis[J]. Blood, 2005, 105(11) : 4290–4297. DOI:10.1182/blood-2004-08-3271 |
 2007, Vol. 23
2007, Vol. 23
