2. 吉林大学在职研究生;
3. 吉林省长春市疾病预防控制中心
2.
单核细胞增生李斯特菌(单增李氏菌)是一种人畜共患致病菌, 使人和动物患脑膜炎、脑炎、败血症及造成怀孕妇女流产、死胎等疾病, 病死率很高。该菌广泛存在于土壤、人和动物的粪便中, 很容易污染食品而引起食物中毒和李斯特病暴发。此外, 由于该菌在4 ℃冰箱保存的食物中也可生长繁殖, 故其危害性进一步增大〔1〕, 其致病因子为李氏溶血素O (Hly)和内化素〔2〕。随着我国冷藏、速冻食品消费量的迅速增多, 食品中单增李斯特菌的潜在危险性也越来越大, 应用常规方法检验耗时费力, 程序复杂〔3〕。采用聚合酶链反应(PCR)法检测, 8 h内可完成检测过程, 可大大缩短检测时间。报告如下。
1 材料与方法 1.1 材料(1)菌株:标准菌株3株, 实验菌株79株, 均为吉林省疾病预防控制中心微生物室提供的国家食品污染物监测网吉林省样品分离株, 并经《国家食源性疾病监测网工作手册》方法鉴定为单增李氏菌的菌株。(2)主要试剂:DNA提取试剂盒, 溶菌酶、Taq酶、琼脂糖(美国Promega公司); 核苷酸混合物(dNTP)、溴化乙锭(EB)溴酚蓝DNA标准标志物(大连宝生物工程有限公司); 引物、石蜡油(上海生工生物工程公司); 科玛嘉李斯特菌显色培养基(郑州博塞生物工程有限责任公司); 李斯特菌增菌肉汤(LB1, LB2;北京陆桥技术有限责任公司); 其他化学试剂为国产或进口分析纯。(3)主要仪器:TGRADIEN T型PCR扩增仪(德国BIOMETRA公司); Gel Doc 2001型凝胶成像系统(美国Bio-Rad公司); DYY-型稳压稳流电泳仪、DYY-31 CA型水平琼脂糖电泳槽(北京六一仪器厂); 752型紫外光栅分光光度计(山东高密分析仪器厂); 微量加样器2, 20, 100, 1 000 μl (法国GILSON公司)。
1.2 方法 1.2.1 菌种准备标准菌株(冻干)用生理盐水复苏后, 分别接种于李斯特菌增菌肉汤(LB)和科玛嘉李斯特菌显色培养基上, 30 ℃培养24 h和35 ℃培养24 h。显色培养基上可见在单增李氏菌的菌落周围形成蓝色菌落并带透明的晕环; 取1 ml李斯特菌增菌肉汤用于DNA的提取。
1.2.2 模板DNA制备根据试剂盒说明书进行。
1.2.3 PCR扩增(1)引物:针对单核细胞增生李斯特菌溶血素基因(hlyA)设计引物, 委托上海生物工程技术服务有限公司合成。特异性引物序列如下:上游(F):5′-GCCTG2-CAAGTCCTAAGACGCCAATC-3′; 下游(R):5′-CTTG-CAACTGCTCTTTAGTAACAGC-3′。(2)反应体系:20 μl。H2O (二馏灭菌水)12.8 μl, 10 ×buffer2.0 μl, Mg2+(25 mol/ L)2.0 μl, 4 ×dNTP (10 mmol/ml)1.6 μl, Primer (30 pmol/ μl)各0.25 μl, TaqE (2.5 U/ μl)0.1 μl DNA (20-30 ng/ μl)1.0 μl。(3)扩增条件:预变性94 ℃ 5 min, 变性95 ℃ 60 s, 退火63 ℃ 60 s, 延伸72 ℃ 60 s, 30个循环, 再延伸72 ℃ 8 min, 20 ℃中止。(4)结果观察:PCR产物用1.5%琼脂糖凝胶, 100 V电压电泳, 溴化乙锭(EB)染色, 凝胶成像分析仪中观察扩增结果, 扩增片段长度为706 bp。(5) DNA定量:根据文献〔4〕, 采用紫外分光光度计法测定模板DNA的浓度为0.33 g/L。
1.3 特异性检测将本实验室保存菌种:金黄色葡萄球菌、普通大肠埃希菌、蜡样芽胞杆菌、枯草杆菌(ATCC 9 372)、沙门菌(DVI-EQAS)、绿脓杆菌(ATCC 15 442-5)与单核细胞增生李斯特菌, 采用试剂盒方法提取DNA, 按照上述条件进行PCR扩增, 观察比较结果。
2 结果 2.1 不同退火温度下单增标准菌株PCR扩增结果(图 1)
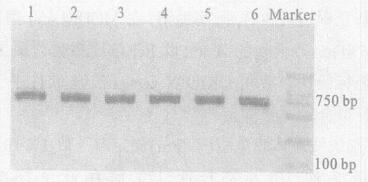
|
Marker :DL 2000; 1~6 :退火温度分别为60.2, 60.9, 62, 63, 64.4, 65.6 ℃ 图 1 标准菌株在不同退火温度下的PCR扩增图谱 |
图 1可见, 所选择的6种退火温度下, 均可获得最佳的扩增结果。
2.2 敏感度检验(图 2)
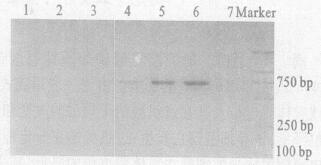
|
Marker :DL 2000; 1~6 :DNA浓度分别为0.0033, 0.033, 0.33, 3.3, 33, 330 ng/ L; 7 :阴性对照 图 2 不同浓度实验菌株的PCR扩增图谱 |
图 2可见, 将模板DNA (0.33 g/L)以10倍梯度进行稀释, 当模板DNA浓度在3.3, 33, 330 ng/L时均可见到扩增条带, 表明方法的检测下限为3.3 ng/L DNA。
2.3 特异性检验(图 3)
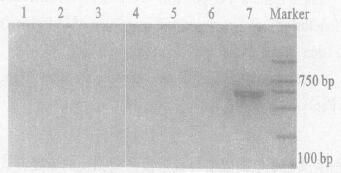
|
Marker :DL 2000;1~7 :分别为金黄色葡萄球菌、普通大肠埃希菌、蜡样芽胞杆菌、枯草杆菌、沙门菌、绿脓杆菌和单核细胞增生李斯特菌 图 3 不同菌株的扩增图谱 |
图 3可见, 不同菌株PCR扩增结果中, 只有单核细胞增生李斯特菌在706 bp处有目的片段扩增, 其余菌种未见到扩增条带, 表明该检测方法具有较好的特异性。
3 讨论本试验采用的PCR法检测LM, 选用毒力基因作为扩增靶序列, 容易将LM与其他细菌区分。溶血素为LM的主要致病因子, 由hly基因编码, hly基因在LM中相对保守。试验选取hly基因下游片断设计1对引物, 退火温度选择63 ℃, 延伸72 ℃, 经30个循环扩增, 检测低限为3.3 pg/ μl DNA, 表明此种方法检测LM具有较高的灵敏性; 只有单核细胞增生李斯特菌在706 bp处有目的片段扩增, 其余菌种未见扩增。说明该检测方法具有较好的特异性。用PCR方法检测食品中的单增李斯特菌, 操作简便、快速、检测成本低, 且有较高的灵敏性特异性, 适宜于食品中单增李斯特菌的快速筛选。
| [1] | 顾振华. 食品中李斯特菌食物中毒[J]. 上海预防医学, 2001, 13(3) : 136–138. |
| [2] | 张明, 陈玉真, 陈敏, 等. 应用PCR技术检测李斯特菌致病基因[J]. 中国公共卫生, 2002, 18(3) : 370–371. |
| [3] | 冉路. 食源性致病菌及食源性疾病[J]. 中国食品卫生, 2001, 13(4) : 42–44. |
| [4] | Gudrun A rappold.脉冲场凝胶电泳:方案//希尔德布兰特.分子医学技术[M].北京:科学出版社, 2000:79-86. |
 2007, Vol. 23
2007, Vol. 23
