胰岛素抵抗(insulin resistance,IR)是指胰岛分泌的胰岛素敏感性下降以及维持血中葡萄糖水平恒定的能力下降,即正常剂量的胰岛素产生低于正常生物学效应的一种状态。IR是一种慢性、低水平的炎症状态。脂肪细胞是胰岛素靶细胞,是分泌炎症因子的主要场所,在炎症反应发生时,会分泌多种炎症因子,这些炎症因子可通过内分泌和旁分泌途径引起胰岛素信号转导受阻,从而引发IR[1 – 2]。而IR会引起机体一系列改变,在Ⅱ型糖尿病、高血压、肥胖的患者血浆中炎症因子的释放增加,如TNF–α、IL–6水平明显升高,使机体处于慢性炎症状态[3 – 4]。因此炎症和IR关系密切,相互影响。干预炎症过程已经成为改善胰岛素抵抗的新途径。表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)具有降糖、降脂和改善胰岛素抵抗的作用,但其作用机制尚未完全明确[5]。本研究以油酸诱导的胰岛素抵抗SW872脂肪细胞为模型,观察EGCG对胰岛素抵抗脂肪细胞的葡萄糖摄取,葡萄糖转运因子4(glucose transporter type 4,GLUT–4)、肿瘤坏死因子(tumor necrosis factor–α,TNF–α)、白介素–6(interleukin–6,IL–6)和C反应蛋白(C–reactiveprotein,CRP)表达的影响,探讨EGCG改善胰岛素抵抗的作用及可能机制,为EGCG作为保健食品或药品开发利用提供科学依据。
1 材料与方法 1.1 主要试剂与仪器SW872前脂肪细胞株(美国ATCC);EGCG(纯度> 95 %,高效液相色谱仪鉴定)(南昌利丰工贸有限责任公司);Dulbecco’s modified Eagle media:nutrient mixture F–12(DMEM/F12)培养基(美国Gibco公司);胎牛血清(杭州四季青公司);二甲基亚砜(dimethyl sulfoxide,DMSO)、油酸和胰酶(美国Sigma公司);荧光标记的2–脱氧葡萄糖(2–NBDG)(美国Invitrogen公司);GLUT4抗体(美国Abcam公司);TNF–α、IL–6 酶联免疫吸附剂测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(南京建成生物工程研究所);CRP(美国Biocheck公司)。CO2培养箱(日本SANYO公司);DYY–Ⅲ–11型三恒电泳仪(北京六一仪器厂);激光共聚焦显微镜(日本Nikon公司);ABI–PRRISMTM 7500 fast PCR仪(英国Applied Biosystems公司);酶标仪(美国Bio–RAD公司)。
1.2 脂肪细胞培养与诱导分化将SW872前脂肪细胞置于含10 %胎牛血清的DMEM/F12培养基的培养瓶中培养,每天换液1次,细胞汇合达70 %~80 %时,25 g/L胰酶消化后,传代至24孔板中,当细胞汇合达80 %~90 %时,加入0.6 mmol/L油酸诱导分化,作用72 h后,SW872前脂肪细胞被诱导分化为成熟脂肪细胞;再加入1.0 mmol/L油酸孵育24 h后,SW872成熟脂肪细胞进入IR状态。将诱导分化的SW872成熟脂肪细胞和经1.0 mmol/L油酸孵育后的SW872成熟脂肪细胞置于无血清的DMEM/F12培养基中培养。
1.3 分组与处理实验设5组,对照组(SW872成熟脂肪细胞),模型组(1.0 mmol/L油酸诱导24 h的成熟脂肪细胞),EGCG低、中、高剂量组(同时加入1.0 mmol/L油酸和25、50、100 μmol/L EGCG)。
1.4 指标与方法 1.4.1 葡萄糖转运实验玻片在75 %酒精中浸泡过夜,将玻片放入24孔板内,加入少许明胶,覆盖底部即可,使玻片与板底充分贴合。1~2 h后从培养箱中取出,吸出明胶加入1 mL细胞悬液,接种1 × 105个细胞到24孔板中,24 h后,磷酸盐缓冲液(phosphate buffered saline,PBS)清洗2遍,加入1 μL胰岛素,放入培养箱培养15 min后,再用PBS清洗3遍;用2–NBDG染色,染料浓度100 μmol/L,每孔100 μL,孵育30 min后,在激发波长为488 nm,发射波长为525 nm条件下,用激光共聚焦显微镜观察细胞胞浆的荧光强度变化情况;实验重复3次。
1.4.2 GLUT4蛋白表达检测采用Western-blot法,提取总蛋白,二喹啉甲酸法(bicinchoninic acid,BCA)测定浓度后将蛋白浓度调成一致,加上样缓冲液 100 ℃ 变性5 min,聚丙烯酰胺凝胶电泳分离蛋白,后转至聚偏氟乙烯膜上,用1 % BSA的TBST(Ttis-buffered saline and Tween 20)室温下封闭 1 h,一抗 (稀释倍数1 ∶ 1 000)4 ℃ 孵育过夜,二抗(稀释倍数1∶7 500)室温孵育1 h后显影成像分析;实验重复5次。
1.4.3 脂肪细胞TNF–α、IL–6、CRP mRNA表达水平检测采用RT–PCR法,Trizol法提取总RNA,RT–PCR扩增目的基因;引物TNF–α:上游5′–TGT CTC AGC CTC TTC TCA TT–3′,下游5′–AGA TGA TCT GAG TGT GAG GG–3′;IL–6:上游5′–GCC ACT GCC TTC CCT ACT TCA–3′,下游5’–GAC AGT GCA TCA TCG CTG TTC A–3′;CRP:上游5′–TAT TTT CTC GTA TGC ACC A–3′,下游5’–TTT CCA ATG TCT CCC ACC AG–3′;β–actin,上游5′–AGG GAA ATC GTG CGT GAC–3′,下游5′–CGC TCA TTG CCG ATA GTG–3′。反应参数:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环,数据采用2–ΔΔCT方法进行分析,β–actin作为参照。实验重复3次。
1.4.4 脂肪细胞TNF–α、IL–6、CRP分泌量检测采用ELISA法,对照组和EGCG处理组脂肪细胞37 ℃、CO2培养箱中孵育24 h后,取培养上清液用1.5 mL EP管收集,3 000 r/min离心10 min去除颗粒和聚合物,采用试剂盒检测细胞上清液中TNF–α、IL–6、CRP含量;同时设置标准孔和样本孔,每样本设2个平行孔,在波长450 nm处检测吸光度(A)值,并绘制标准曲线;实验重复4次。
1.5 统计分析数据以
与对照组比较(图1A),模型组脂肪细胞对葡萄糖的摄取明显降低,荧光强度明显减弱(图1B);表明给予油酸后胰岛素敏感性明显降低,葡萄糖摄取能力下降,油酸诱导后成功建立了SW872脂肪细胞胰岛素抵抗模型。与模型组比较,EGCG中、高剂量组脂肪细胞荧光强度明显增加(图1D、E);表明EGCG能够明显增加胰岛素敏感性,促进脂肪细胞对葡萄糖摄取。
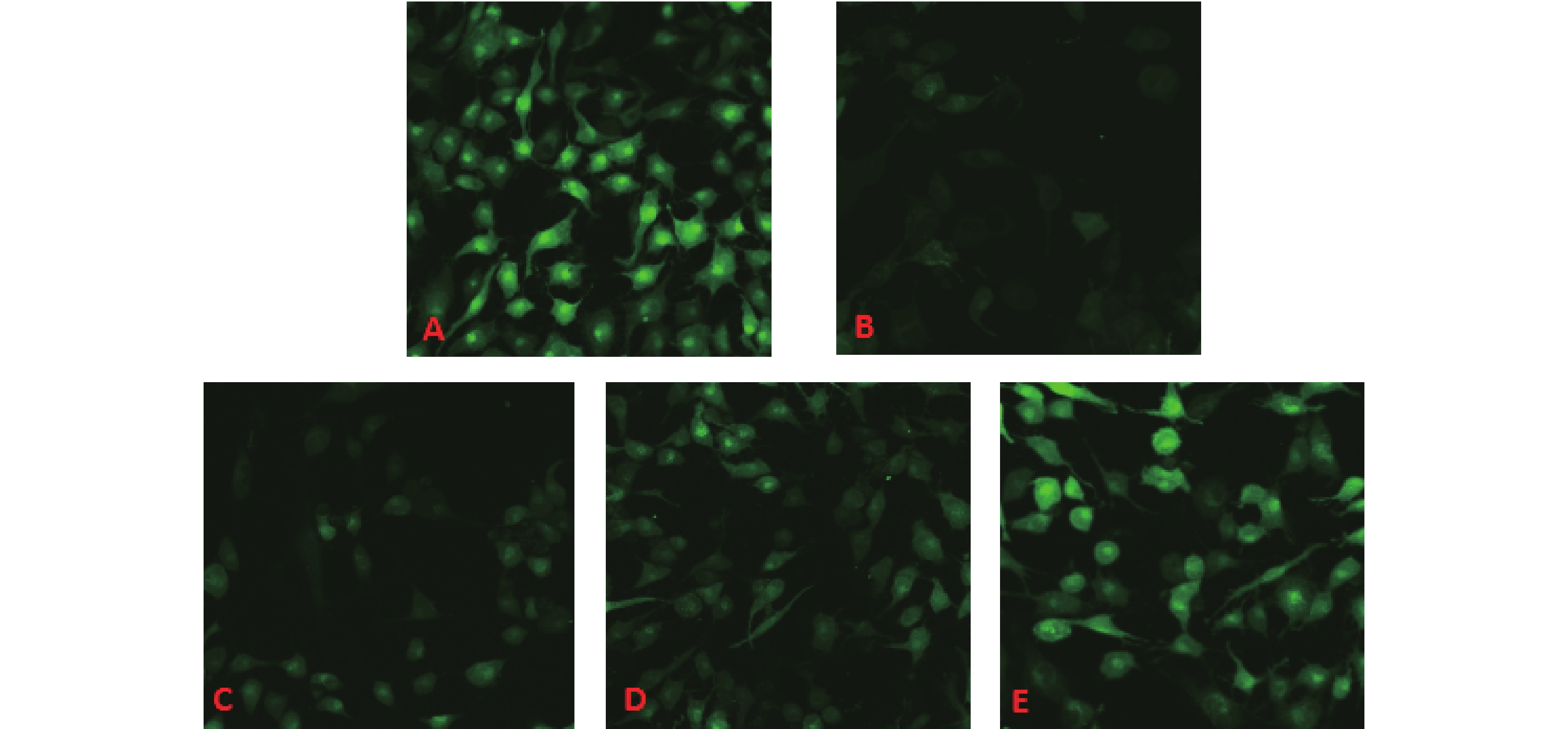
|
注:A:对照组,B:模型组,C、D、E:EGCG低、中、高剂量组。 图 1 EGCG对胰岛素抵抗脂肪细胞葡萄糖摄取影响 |
2.2 EGCG对胰岛素抵抗脂肪细胞GLUT4蛋白表达影响(图2)
对照组,模型组,低、中、高剂量EGCG组脂肪细胞中GLUT4蛋白表达分别为(0.68 ± 0.08)、(0.37 ± 0.05)、(0.47 ± 0.08)、(0.57 ± 0.07)、(0.60 ± 0.09);与对照组比较,模型组脂肪细胞中GLUT4蛋白表达明显下降(P < 0.05);与模型组比较,EGCG中、高剂量组脂肪细胞中GLUT4蛋白表达明显增加( P < 0.05)。

|
注:1:对照组,2:模型组,3~5:EGCG低、中、高剂量组。 图 2 EGCG对胰岛素抵抗脂肪细胞GLUT4蛋白表达影响 |
2.3 EGCG对胰岛素抵抗脂肪细胞炎症因子mRNA表达影响(表1)
与对照组比较,模型组脂肪细胞中TNF–α、IL–6、CPR mRNA表达明显增高(P < 0.01);与模型组比较,EGCG中、高剂量组脂肪细胞中TNF–α和IL–6的mRNA表达下降( P < 0.01),EGCG高剂量组脂肪细胞中CRP mRNA表达降低( P < 0.05)。
|
表 1 EGCG对胰岛素抵抗脂肪细胞中炎症因子mRNA表达影响(
|
2.4 EGCG对胰岛素抵抗脂肪细胞炎症因子分泌量影响(表2)
与对照组比较,模型组脂肪细胞TNF–α、IL–6、CPR分泌量明显增高(P < 0.01);与模型组比较,EGCG中、高剂量组脂肪细胞TNF–α和IL–6分泌量量明显降低( P < 0.01),呈现一定的剂量–反应关系;与模型组比较,EGCG高剂量组脂肪细胞CRP分泌量明显降低( P < 0.05)。
|
表 2 EGCG对SW872胰岛素抵抗细胞炎症因子分泌量影响(pg/mL, |
3 讨论
炎症是肥胖状态下诱导胰岛素抵抗的关键因素,近年来肥胖相关的炎症状态成为胰岛素抵抗和2型糖尿病发病机制的关注焦点[4]。导致炎症的炎症因子主要有TNF–α、IL–6和CRP等。TNF–α是脂肪细胞中最先鉴定出来的炎症因子,其在局部脂肪细胞中的表达与胰岛素抵抗在一定程度上呈正相关[6],TNF–α直接抑制脂肪细胞中葡萄糖转运蛋白GLUT4,降低细胞葡萄糖转运能力,从而引起胰岛素抵抗。研究表明TNF–α在肥胖小鼠和人的脂肪细胞中表达明显增加,并可以促进IR,在封闭TNF–α后,可显著改善胰岛素的敏感性,这也是第一次发现促炎症因子与IR有紧密联系[7 – 8]。IL–6是除TNF–α外与IR关系最为紧密的炎症因子,二者可协同作用。机体长期过量分泌IL–6会损伤胰岛β细胞功能,而引起IR[2, 9]。有研究证明,IL–6可以抑制磷脂酰肌醇–3激酶与IRS–1的结合,也可降低葡萄糖转运蛋白GLUT4,减少葡萄糖摄取[10]。CRP是一种在机体受到感染或组织损伤时血浆中急剧上升的蛋白质,是公认的炎症标志物。TNF–α、IL–6可促进肝脏分泌CRP,同时CRP浓度升高又可促进TNF–α、IL–6释放[11]。研究表明,CRP浓度与胰岛素敏感性呈负相关,与空腹胰岛素、胰岛素原呈正相关,说明CRP也是导致IR的原因之一[12]。
本研究结果显示,经油酸培养后的SW872脂肪细胞葡萄糖摄取能力较对照组明显降低,表明油酸培养后的脂肪细胞存在明显的胰岛素抵抗;中、高剂量EGCG组脂肪细胞葡萄糖摄取能力明显提高,说明EGCG增强了SW872胰岛素敏感性,促进脂肪细胞对葡萄糖的摄取;与对照组比较,模型组脂肪细胞GLUT4蛋白表达量明显降低,TNF–α、IL–6、CRP mRNA表达量和分泌量均明显增高;与模型组比较,EGCG高、中剂量组脂肪细胞GLUT4蛋白表达量明显增加,而TNF–α、IL–6表达量和分泌量均明显降低,EGCG高剂量组CRP的mRNA表达量和分泌量降低。提示,EGCG能够有效促进葡萄糖摄取和增强胰岛素敏感性,进而改善胰岛素抵抗,其机制可能与EGCG能够降低脂肪细胞中炎症因子表达有关。
| [1] | 闻颖, 戴岭, 吕鹏, 等. 姜黄素对脂肪细胞脂联素及抵抗素表达影响[J]. 中国公共卫生, 2010, 26(10): 1248–1250. DOI:10.11847/zgggws2010-26-10-16 |
| [2] | Tsigos C, Papanicolaou DA, Kyrou I, et al. Dose-dependent effects of recombinant human interleukin-6 on glucose regulation[J]. Journal of Clinical Endocrinology and Metabolism, 1997, 82(12): 4167–4170. DOI:10.1210/jcem.82.12.4422 |
| [3] | 金善姬, 熊英环, 许梅花, 等. 脂肪细胞因子于胰岛素抵抗及肥胖关系[J]. 中国公共卫生, 2014, 30(1): 50–52. DOI:10.11847/zgggws2014-30-01-15 |
| [4] | Gregor MF, Hotamisligil GS. Inflammatory mechanisms in obesity[J]. Annual Review of Immunology, 2011, 29(1): 415–445. DOI:10.1146/annurev-immunol-031210-101322 |
| [5] | Tachibana H. Molrcular basis for cancei chemoprevention by green tea polyphenol EGCG[J]. Forum of nutrition, 2009, 61(61): 156–169. |
| [6] | 李瑞珍, 温宇, 夏治, 等. Visfatin对SW872脂肪细胞炎性因子分泌和表达的影响[J]. 实用儿科临床杂志, 2009, 24(19): 1474–1479. |
| [7] | Hotamisligil GS, Shargill NS, Spiegelman BM. Adipose expression of tumor necrosis factor-alpha: direct role in obesity-linked insulin resistance[J]. Science, 1993, 259(5091): 87–91. DOI:10.1126/science.7678183 |
| [8] | Hotamisligil GS, Arner P, Caro JF, et al. Increased adipose tissue expression of tumor necrosis factor-alpha in human obesity and insulin resistance[J]. Journal of Clinical Investigation, 1995, 95(5): 2409–2415. DOI:10.1172/JCI117936 |
| [9] | 佟宇, 王晶. 黄芪甲苷对脂多糖诱导肝细胞损伤保护作用[J]. 中国公共卫生, 2014, 30(6): 753–755. DOI:10.11847/zgggws2014-30-06-18 |
| [10] | Senn JJ, Klover PJ, Nowak IA, et al. Interleukin-6 induces cellular insulin resistance in hepatocytes[J]. Diabetes, 2002, 51(12): 3391–3399. DOI:10.2337/diabetes.51.12.3391 |
| [11] | 闫贻忠, 张眉, 刘佳铭, 等. 新疆维吾尔族居民hsCRP、IL-6与代谢综合征关系[J]. 中国公共卫生, 2014, 30(3): 317–320. DOI:10.11847/zgggws2014-30-03-20 |
| [12] | 张豫文, 洪洁. 炎症因子与胰岛素抵抗[J]. 诊断学理论与实践, 2010, 9(1): 90–94. |
 2018, Vol. 34
2018, Vol. 34


