2. 徐州市中心医院 江苏 徐州 221000
2. Xuzhou Central Hospital, Xuzhou 221000 China
宫颈癌主要由持续的人类乳头状瘤病毒(HPV)感染引起[1]。每年约有50万例新发病例,我国新发病例高达13.15万,是第四大最常见的癌症[2]。放射治疗能够提高盆腔局部控制率和生存率,因此成为宫颈癌重要的治疗手段[3]。但是,宫颈癌的复发率仍高于20%,一线及二线化疗的缓解率仅为15%~16%[3]。复发性/转移性宫颈癌由于既往的手术、放化疗等的治疗史,在进展后的治疗方案选择上比较棘手,所以导致宫颈癌的预后差,是宫颈癌死亡的主要原因[4]。
自20世纪初以来,砷化合物一直被用于治疗各种疾病,大量的研究数据表明,三氧化二砷(arsenic trioxide,ATO)是治疗急性早幼粒细胞白血病的有效抗癌药物[5],同时,美国FDA在2000年批准ATO作为难治性/复发急性早幼粒细胞白血病患者的一线治疗方案[6]。在血液肿瘤中取得了显著的效果,越来越多的研究开始转向实体瘤的治疗,在其他实体肿瘤中应用最好是肝癌,它在单一用药和联合药物、体内外,甚至在临床试验中的都表现出了良好的疗效[7]。根据相关研究,ATO对卵巢癌、胃癌、乳腺癌、直肠癌和肝癌都有治疗效果[8]。通过国内外的研究都证实了ATO的抗肿瘤作用,并且是安全有效的[7, 9-10]。此外,临床研究数据表明,ATO可以抑制动物体内多种实体肿瘤的生长,但是,ATO的作用及机制尚未完全阐明,因此,我们以ATO作为放疗增敏剂观察其放疗增敏作用,并深入探讨了其可能的作用机制[11],为临床放疗增敏提供依据。
放射治疗的目的在于提高肿瘤控制率、降低正常组织的并发症[12]。电离辐射能导致 DNA损伤、遗传不稳定性和细胞死亡[13-14]。研究显示,电离辐射引起的DNA双链断裂损伤是DNA损伤最严重的损伤形式[15]。基因组学和蛋白质组学TCGA分析已经确定了DDR通路的不同基因组突变的频率,DDR通路的改变有望成为抗癌治疗中的生物标志物[16]。放疗在杀伤肿瘤细胞的同时,也可造成机体正常细胞的损害,引起多种并发症[17]。因此,寻找放射增敏剂成为了临床工作中的一项难题。
1 材料与方法 1.1 实验细胞人宫颈癌细胞Siha、Hela(中科院上海细胞库);三氧化二砷(购自徐州医科大学附属医院)
1.2 主要试剂与仪器DMEM培养基(江苏凯基生物技术有限公司);胎牛血清(美国CLARK Bioscience公司);双抗(链霉素和青霉素)和胰酶(江苏博立达科技有限公司);CCK-8试剂盒、二喹啉甲酸(BCA)工作液、彩虹Marker、细胞裂解液、蛋白酶抑制剂、细胞凋亡检测试剂盒、化学发光(ECL)工作液(江苏康美生物科技股份有限公司);cDNA和qPCR试剂盒(武汉塞维尔生物科技有限公司);PTEN抗体(美国CST公司);RAD51抗体(美国CST公司);qPCR引物(上海生工生物工程有限公司);流式细胞仪(美国BD FACSVerse公司);电泳仪(美国Bio-Rad公司);CFX 96 扩增仪(美国Bio-Rad公司);CFX qPCR扩增仪(美国Bio-Rad公司);恒温培养箱(美国Thermo公司);Varian Truebeam医用电子直线加速器(美国Varian公司)。
1.3 细胞培养在37℃、5% CO2的培养箱中,将人宫颈癌细胞接种到含有1%链霉素和青霉素以及10%胎牛血清的DMEM培养基中。当细胞密度增长到80%~90%时,进行1∶2传代。
1.4 筛选最佳的ATO的浓度将细胞接种于96孔板中,待细胞附着后分别加入浓度为0、0.5、1、2、4、8 μM的ATO处理,孵育24 h后加入CCK-8试剂,培养箱中孵育2 h。利用酶标仪在450 nm波长处测定吸光度值,从而计算半数抑制浓度(IC50)值。
1.5 平板克隆实验取生长对数期的细胞制成细胞悬液并计数,按放疗剂量0、2、4、6、8 Gy(6 MV X线;500 cGy/min;射野大小为 40 cm × 40 cm; SSD = 100 cm)分为6个组,于六孔板中分别接入细胞,每组设置3个平行样本,每个剂量组分别设置放疗组和放疗 + 给药组,待细胞贴壁后加入1 μM的ATO,24 h后进行照射。照射后继续培养11~13 d后固定、染色、计数含50个细胞以上的克隆数。
存活分数的计算方法为:处理组克隆形成率/对照组克隆形成率采用“多靶单击模型” 拟合细胞存活曲线计算放射增敏比(SER)。“ 多靶单击模型”方程:SF=1−(1−e−D/D0)N, Dq=D0logN,其中SF为细胞存活率,D为放射剂量(Dy),D0致死量Dq代表准域剂量,N为外推数。
1.6 流式细胞术检测细胞周期和凋亡使用不含EDTA的胰酶消化各组细胞(含放疗的分组给予4 Gy照射[18],放疗 + 给药的分组,经ATO处理24 h后,进行4 Gy的照射,后续分组实验条件相同),后用预先冷却的磷酸盐缓冲液(PBS)洗涤2次,加入70%乙醇进行细胞固定,并在4℃条件下固定细胞过夜。去除乙醇后,加入500 μL PI/RNase A染色工作液,置于室温避光条件下孵育30~60 min,通过流式细胞仪进行细胞周期的检测。再次使用不含EDTA的胰酶来消化各组细胞,使用预冷PBS洗涤2次,加入500 μL的Binding Buffer轻轻搅拌制备单细胞悬液,加入5 μL的Annexin V-FITC和PI混匀。最后,通过流式细胞仪检测细胞凋亡现象。
1.7 免疫荧光染色细胞在六孔板爬片上生长,各组处理后的细胞用4%的甲醛固定,用1%的Triton X-100进行通透。用PBS洗涤细胞,用5% BSA封闭,然后与一抗(兔抗γH2AX(cat no:
将各组细胞加入适量蛋白裂解液和蛋白酶抑制剂(100:1)。随后将细胞悬液转移至离心管中,进行震荡,冰上裂解30 min,然后以4℃离心15 min,收集上清液,并使用BCA蛋白浓度测定试剂。完成SDS-PAGE电泳后,将蛋白质转移至硝酸纤维素膜上,用5%脱脂奶粉封闭120 min。后分别加入PTEN(cat no:9188L 1∶
取各组细胞加入1 mL Trizol充分吹打混匀,冰上静置10 min,加入200 μL氯仿烈振荡15 s,静置5 min。4℃,离心15 min,取上清,加入等体积的异丙醇,冰上静置5 min,4℃,离心10 min。弃上清,1 mL 75%乙醇洗涤RNA沉淀2次,室温下风干5~10 min,加入适量的DEPC水溶解RNA。进行逆转录和qPCR反应。
1.10 统计学处理比较分析组间细胞凋亡和细胞周期数据,用GraphPad Prism 8统计进行数据分析。实验重复3次,数据用均数 ± 标准差表示。组间比较采用非配对t检验分析,P < 0.05有统计学差异。
2 结 果 2.1 ATO以浓度依赖的方式抑制人宫颈癌细胞增殖CCK-8实验结果表明,随着不同浓度的ATO加入,细胞增殖抑制效果逐渐明显。根据Siha细胞和Hela细胞在450 nm处的光密度(OD值)显示,利用GraphPad Prism5软件计算得出ATO处理24 h后的半数抑制浓度(IC50)分别为4.08 μM和4.29 μM(图1)。为避免药物自身的毒性影响,最终选择大于20%IC50的最小值,即1 μM,为最终给药浓度。
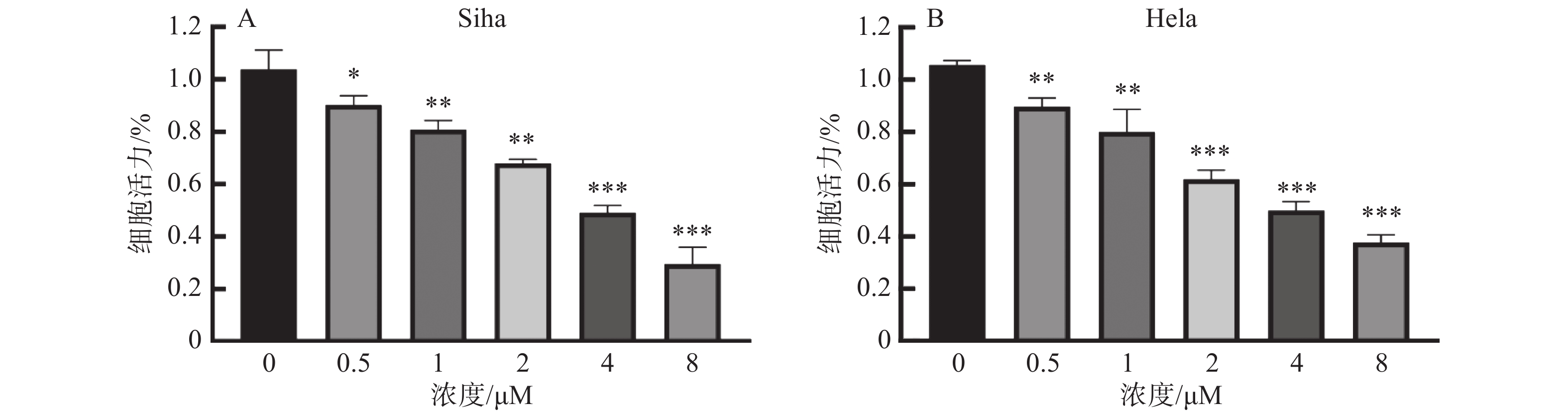
|
图 1 三氧化二砷对人宫颈癌细胞增殖的影响 Figure 1 Effects of arsenic trioxide on the proliferation of cervical cancer cells |
平板克隆实验结果显示,ATO能显著提高人宫颈癌细胞的放疗效果。经ATO处理后,平均细胞致死剂量(D0)著下降,同时生存曲线的肩部(Dq)变小(图2)。通过多靶单击模型计算出放射增敏比(SER)分别为1.37、1.30(表1),表明ATO在体外对人宫颈癌细胞有明显的放射增敏作用。
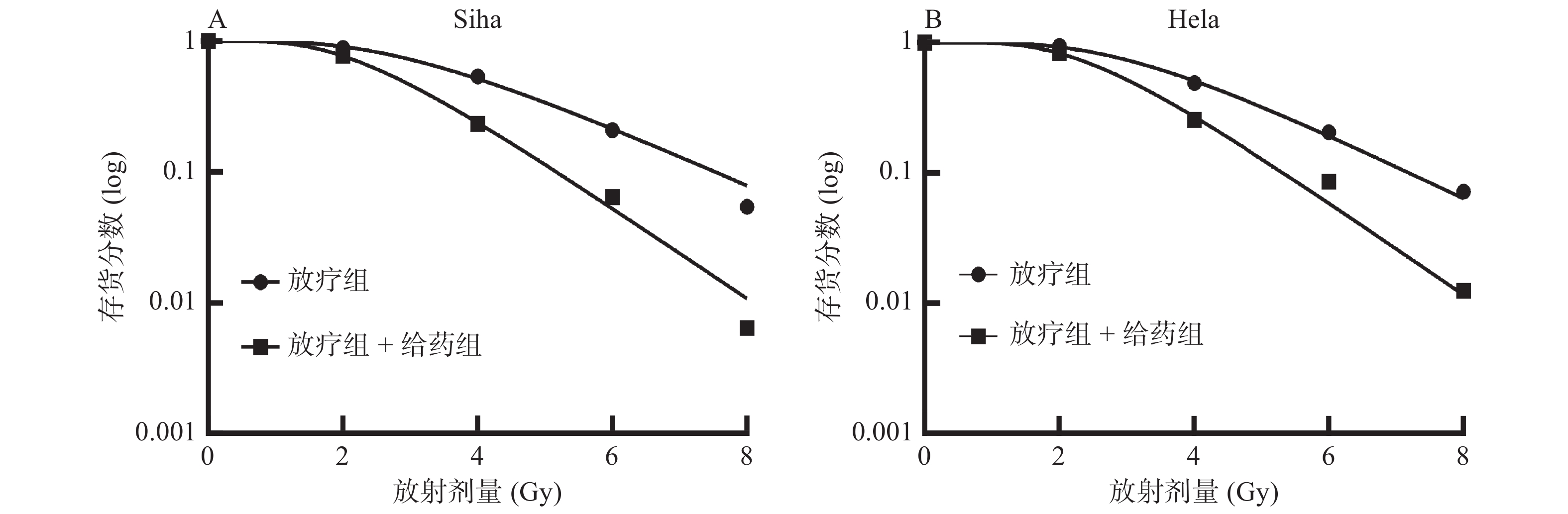
|
图 2 Siha、Hela细胞集落形成法-细胞存活曲线 Figure 2 Survival curves of Siha and Hela cells determined by colony formation method |
|
|
表 1 照射后Siha和Hela细胞存活曲线的主要参数 Table 1 Main parameters of Siha and Hela cell survival curves after irradiation |
流式细胞仪分析显示,经处理后的Siha细胞,与对照组相比,放疗组和给药组的G2/M期的比例增加,由10.37%分别增加到13.35%和16.25%(t=5.354、P < 0.05;t = 8.311,P < 0.01),放疗 + 给药组的G2/M期显著增到28.89%(t=10.27,P < 0.001),组间差异具有统计学意义(P < 0.05),见图3,表2;在Hela细胞中,与对照组相比,放疗组和给药组的G2/M期的比例增加,由5.48%增加到12.45%和12.91%(t=4.646、6.166,P < 0.01),放疗 + 给药组的G2/M期显著增高到30.44%(t=14.38,P < 0.001)见图3,表3。这说明了ATO可以显著增强放射诱导的细胞周期阻滞。
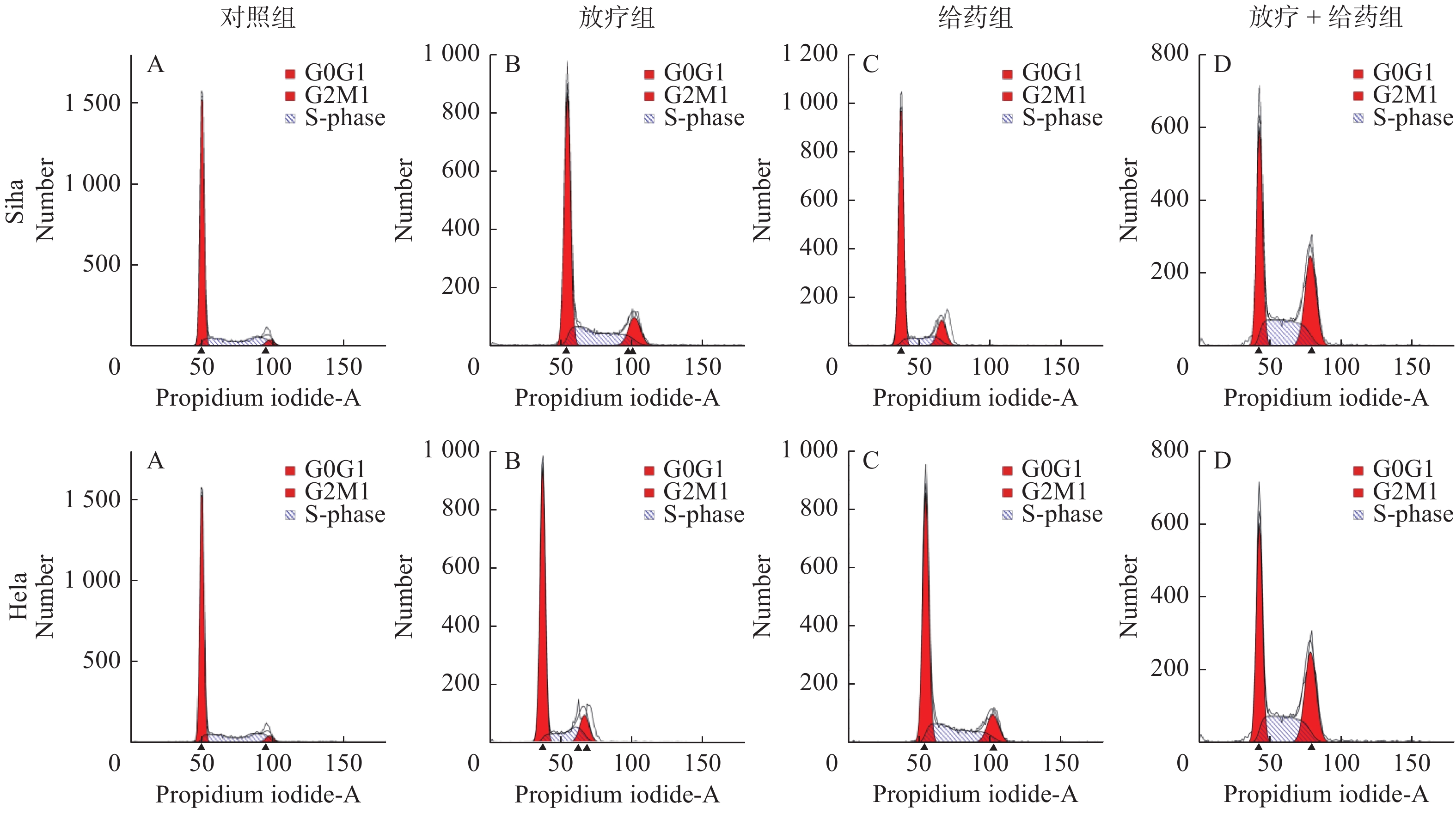
|
图 3 流式细胞仪检测PI染Siha、Hela细胞的细胞周期 Figure 3 PI-stained Siha and Hela cells cycles determined by flow cytometry 注:给药时间与照射时间间隔24 h。 |
|
|
表 2 三氧化二砷和放疗对Siha细胞周期和凋亡的影响( |
|
|
表 3 三氧化二砷和放疗对Hela细胞周期和凋亡的影响( |
细胞凋亡是检测ATO体外抗肿瘤的主要方法。因此,对Siha、Hela细胞分别进行了凋亡实验检测,统计了各组细胞的凋亡情况(图4)。Siha细胞经过放疗 + 给药处理24 h后,由4.03%增加到14.17%(t=14.66,P < 0.001)(表2);Hela细胞经过放疗 + 给药处理24 h后,由4.16%增加到17.06%(t=23.93,P < 0.001)(表3)。表明ATO可以显著增强射线对人宫颈癌细胞的杀伤作用。
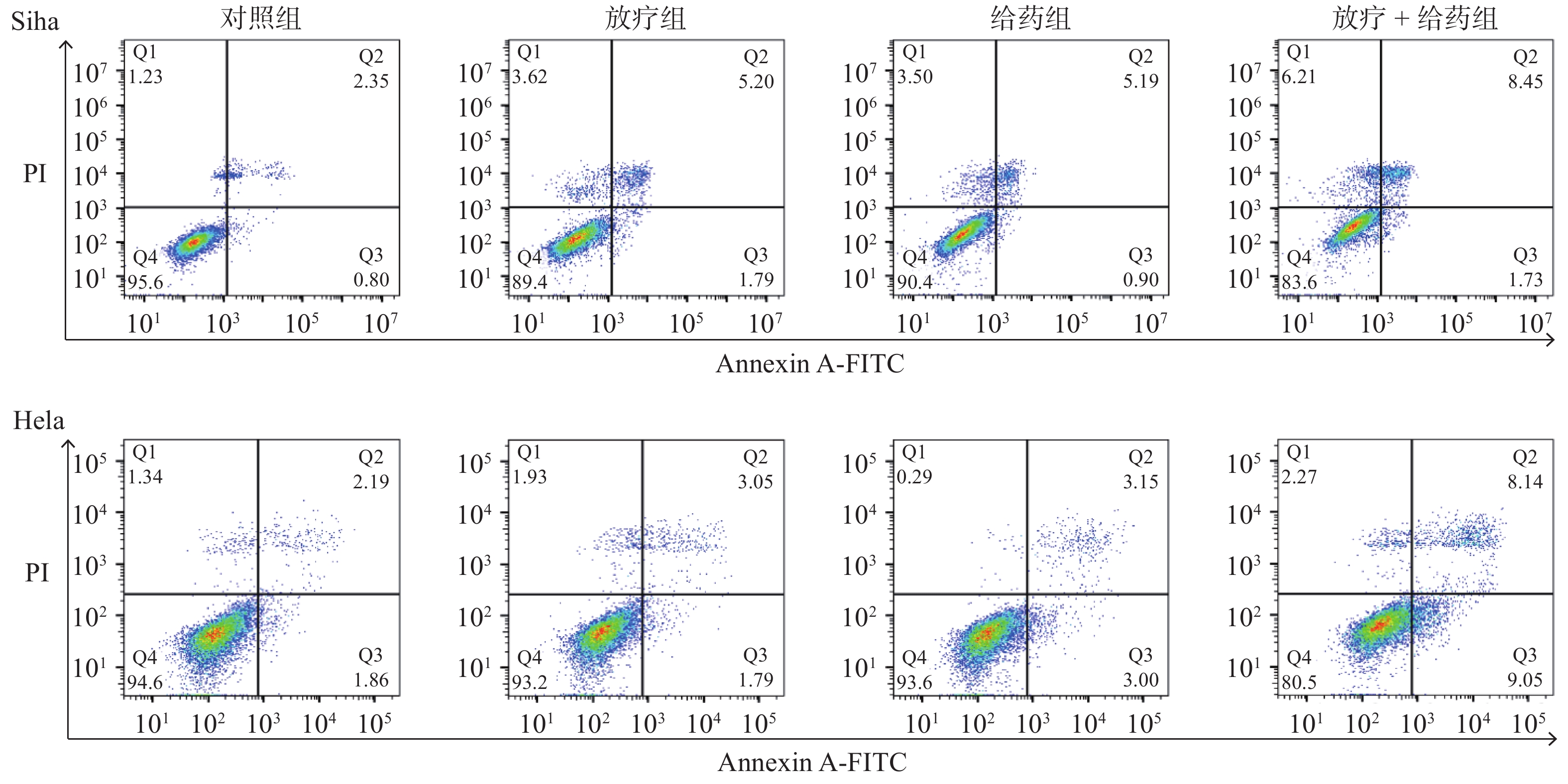
|
图 4 流式细胞仪检测AnnexinV和PI双染Siha、Hela细胞的凋亡 Figure 4 Apoptosis of Annexin V and PI double-stained Siha and Hela cells determined by flow cytometry 注:给药时间与照射时间间隔24 h。 |
对各组细胞γH2AX进行免疫荧光检测结果显示,放疗组、给药组都会引起γH2AX焦点的增加,但是放疗 + 给药组的γH2AX的焦点明显升高(图5)。这提示ATO会增强射线导致的DNA双键断裂。
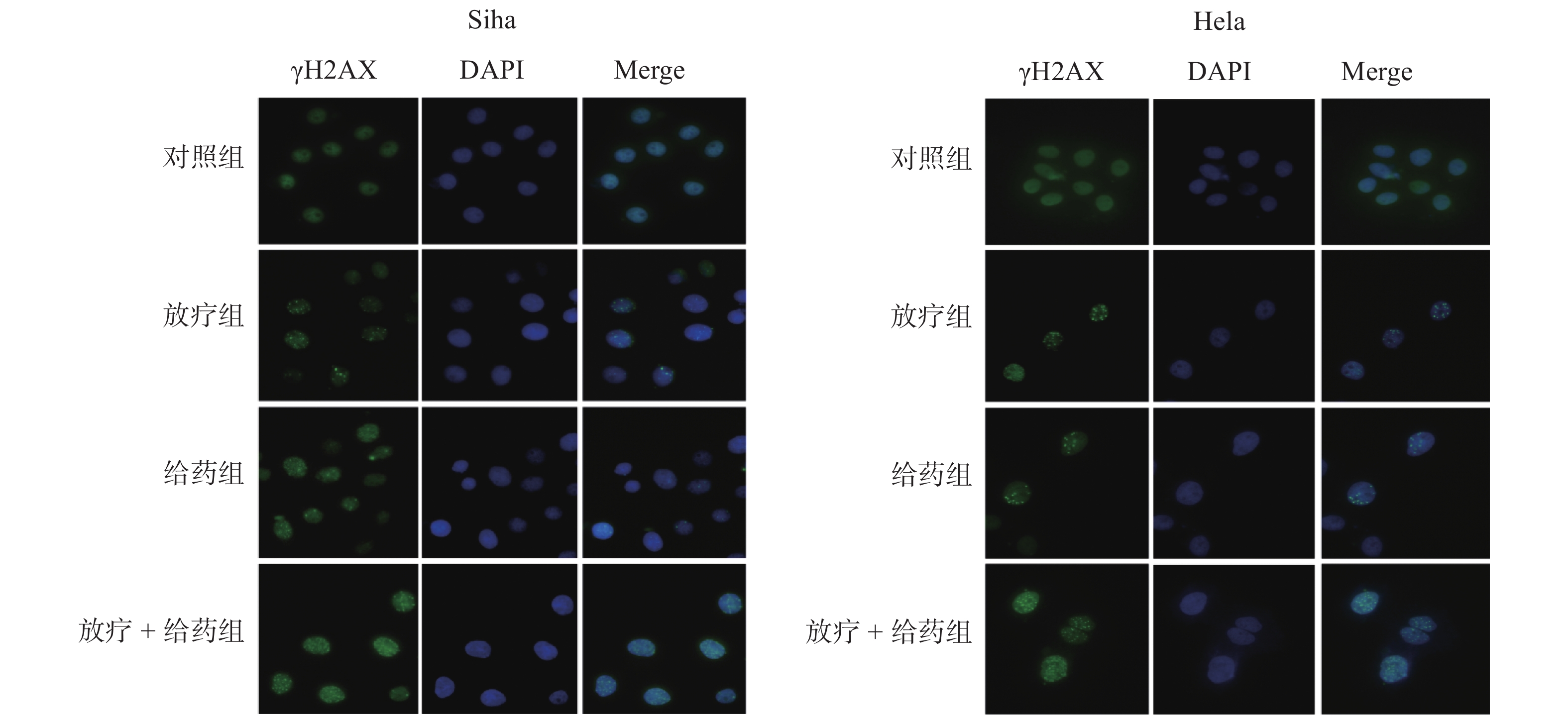
|
图 5 免疫荧光实验检测细胞内的γH2AX Figure 5 Intracellular γH2AX determined by immunofluorescence assay |
放疗敏感期是在细胞的G2/M期,Cyclin B1是G2/M期的关键蛋白。此时人宫颈癌细胞受到照射发生DSBs后,细胞进行DNA损伤修复。在这个过程中,同源重组修复途径是主要途径,RAD51同源重组修复途径中的关键蛋白。通过阅读文献我们知道了射线会导致PTEN的减少,而PTEN又通过影响参与DSBs损伤修复因子RAD51的重塑,从而间接影响DNA DSBs损伤的修复[19]。通过蛋白免疫印记(WB)对Cyclin B1、PTEN和RAD51进行验证,结果显示:Siha、Hela细胞各组细胞Cyclin B1、PTEN、RAD51蛋白表达水平比较,差异具有统计学意义(P < 0.05)。与对照组相比,G2/M期相关蛋白Cyclin B1蛋白表达显著上调,且上调水平具有统计学差异(P < 0.05)。结合前文细胞周期的结果,证实了ATO阻滞细胞周期在G2/M期。PTEN、RAD51蛋白的表达下调,下调水平具有统计学差异(P < 0.05)(图6、图7)。进一步提示ATO通过抑制DNA损伤修复途径来起到放射增敏的作用。
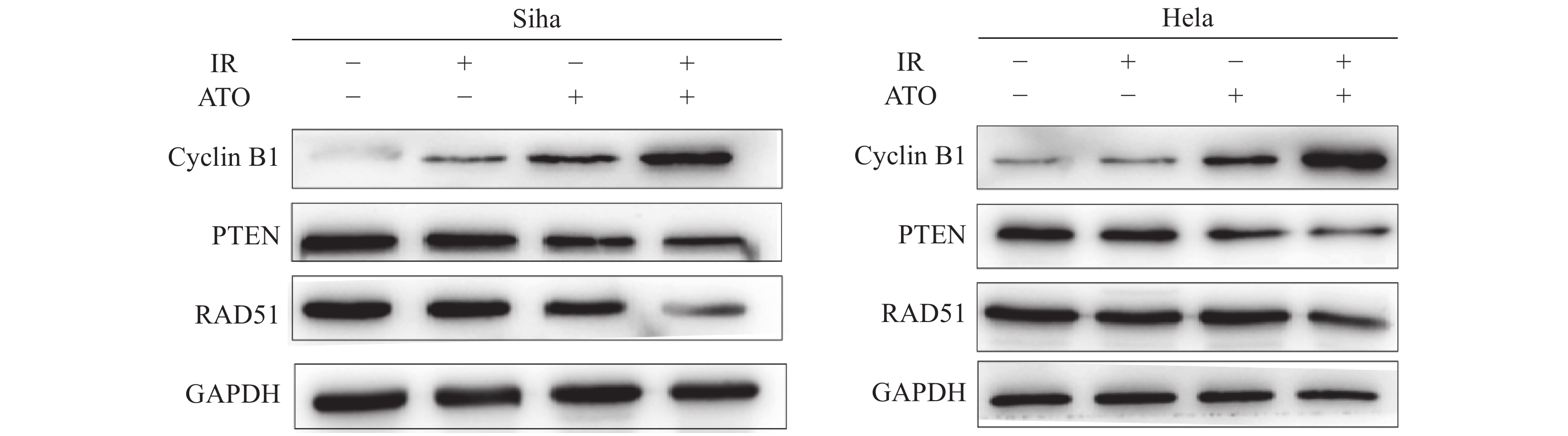
|
图 6 Siha、Hela细胞各组细胞Cyclin B1、PTEN、RAD51蛋白表达条带图 Figure 6 Band diagram of Cyclin B1, PTEN, and RAD51 proteins expressed in Siha and Hela cells |
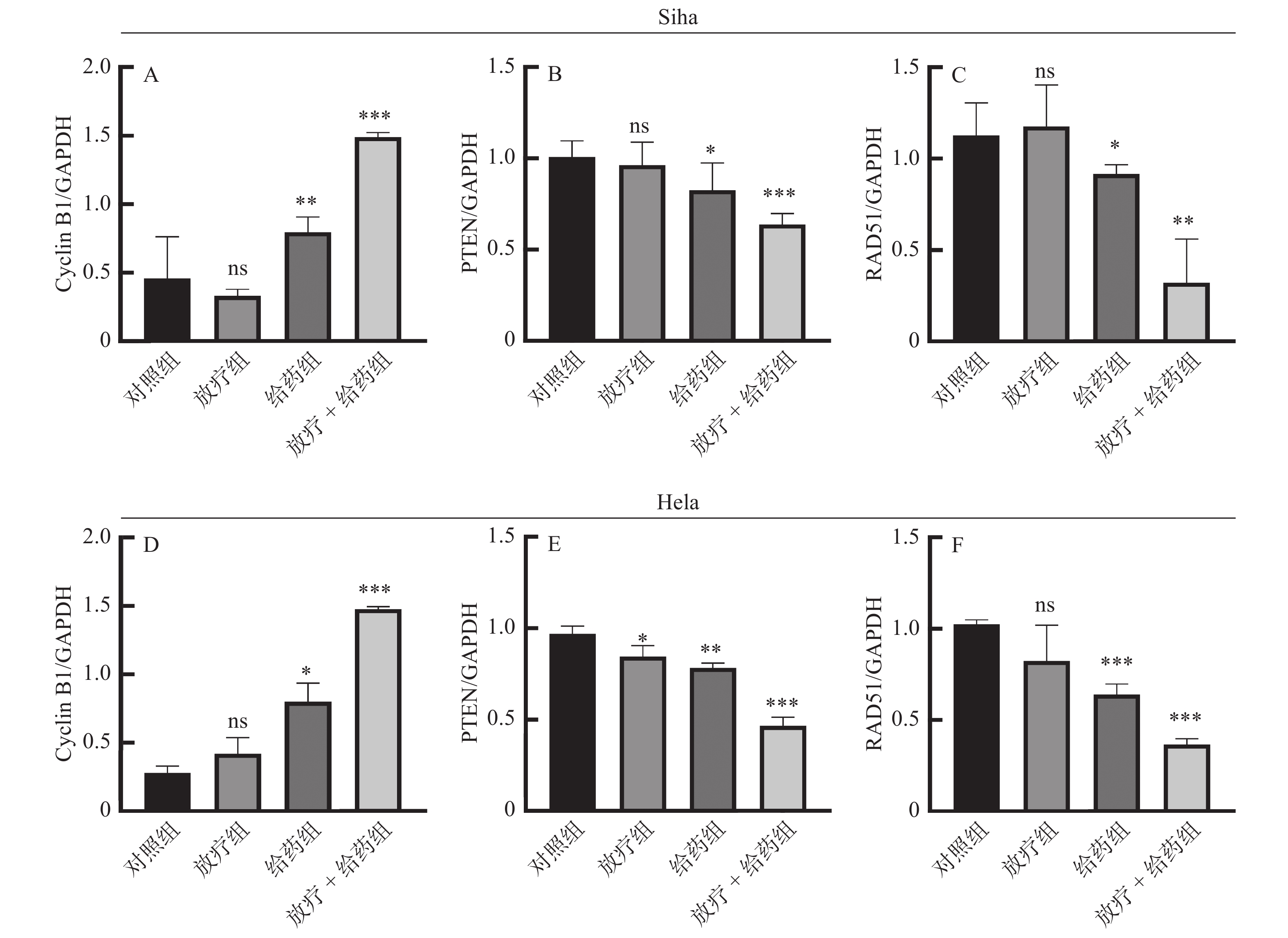
|
图 7 Siha(A-C)、Hela(D-F)各组细胞Cyclin B1、PTEN、RAD51蛋白相对表达量比较 Figure 7 Comparison of the relative expression levels of Cyclin B1, PTEN, and RAD51 in Siha (A-C) and Hela (D-F) cells 注:ns:P > 0.05,*P < 0.05,**P < 0.01,***P < 0.001。 |
通过qPCR检测RAD51的转录水平结果显示。与放疗组、给药组相比,放疗 + 给药组的RAD51的转录明显降低,降低水平具有统计学差异(P < 0.05)(图8)。这与前文结果相对应。进一步提示ATO通过抑制DNA损伤修复达到放射增敏的作用。
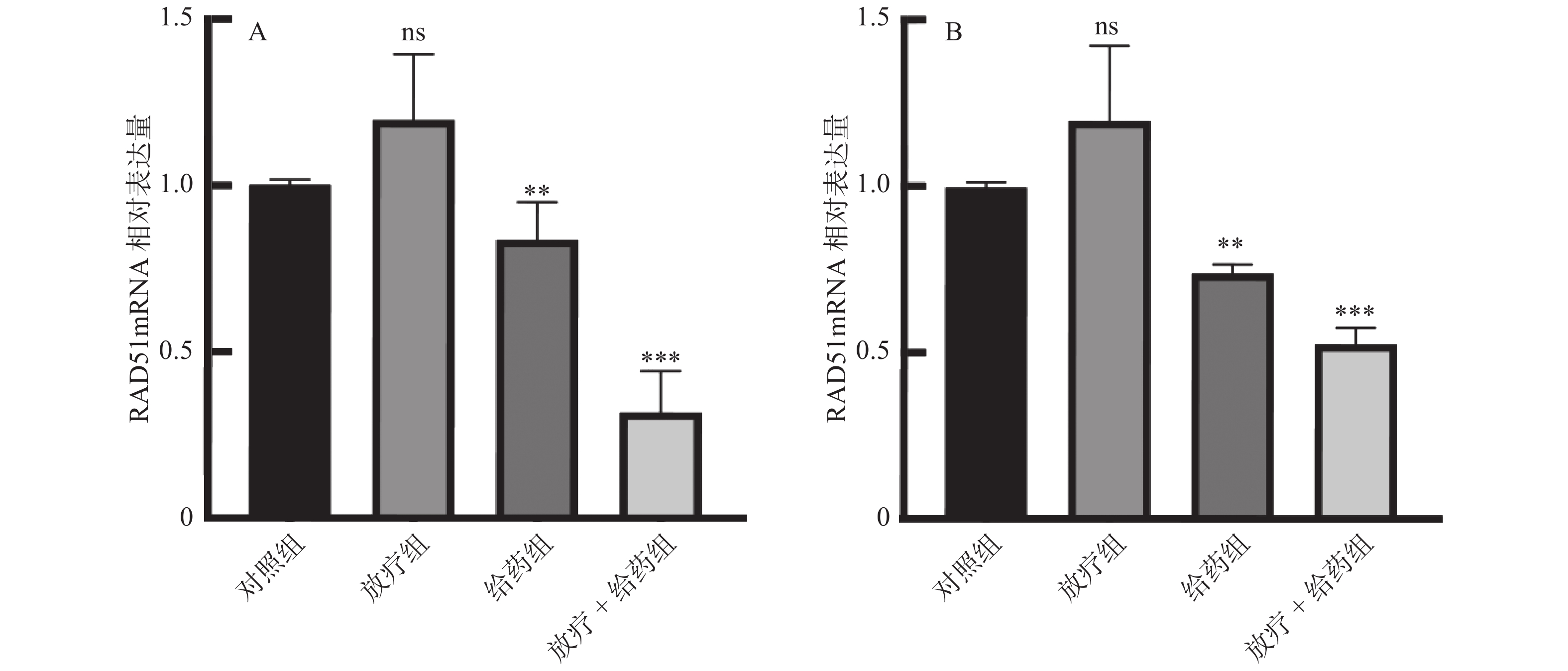
|
图 8 Siha(A)、Hela(B)各组细胞RAD51 mRNA相对表达量比较 Figure 8 Comparison of the relative expression of RAD51 mRNA in Siha (A) and Hela (B) cells 注:ns:P > 0.05,*P < 0.05,**P < 0.01,***P < 0.001。 |
宫颈癌复发的患者往往预后较差,死亡率显著增高[20],中晚期主要以放射治疗为主,化疗仅用于晚期、复发宫颈癌的姑息治疗[21]。虽然宫颈癌的治疗方式有很多,但是治疗效果仍不尽人意,而且这些患者的生活质量比较差[22]。目前临床上也有很多放疗增敏药物的研究开发,例如,铂类为基础的同步放化疗是局晚期宫颈癌的标准治疗方案,仍有部分患者在接受标准治疗方案后出现复发或转移,因此,寻找安全且有效的放疗增敏药物是很重要的,探讨药物抗肿瘤的作用及其机制,为临床优化用药方案,减少放疗的副作用,提高放疗效果提供理论基础及实验依据。
ATO是砒霜的主要成分,作为一种天然存在的物质,已作为药物制剂使用了两千多年,是最早用于治疗癌症的药物之一,虽然毒性作用较大,但具有多种药理作用[23]。最早ATO在治疗难治性和复发性急性早幼粒细胞白血病中显示出独特的优势[24]。正是由于这种高疗效导致在其他类型的癌症中的研究应用,包括复发和新诊断的[25]。目前的研究中,ATO联合卡铂新辅助治疗局部晚期宫颈癌的一项随机对照的前瞻性临床实验研究的有效率为67%[7]。因此,ATO无论是单独用药还是联合用药,ATO在宫颈癌中的抗肿瘤作用是明确的。
有研究显示,ATO是通过诱导细胞周期阻滞在G2/M期,从而达到抗肿瘤的作用[26]。因此,本课题的流式细胞术检测细胞周期的结果及蛋白免疫印记结果也证实了ATO诱导细胞周期阻滞在G2/M期。放疗主要是通过破坏DNA来达到治疗效果,与辐射相关的DNA损伤会导致DNA损伤修复[16]。本实验主要是研究通过发生在M期的同源重组途径。有研究报道了PTEN通过参与DNA双键断裂的同源重组修复[27],也有研究表明,PTEN的突变缺失与RAD51的表达和功能的降低有关,这是参与同源重组的关键因素[28]。PTEN的消耗使得细胞对电离辐射敏感,而这种放疗敏感与RAD51表达的减少有关[29]。RAD51是同源重组途径的关键蛋白。目前研究表明细胞在M及G2期放射敏感性最高,肿瘤细胞的生存依赖于G2关键阻滞点,通过让受损伤的肿瘤细胞DNA得以修复来避免死亡[30]。结合本课题的实验结果,ATO通过消耗PTEN来阻滞DNA同源重组修复途径,从而在宫颈癌中达到放射增敏的效果。
| [1] |
Johnson CA, James D, Marzan A, et al. Cervical cancer: an overview of pathophysiology and management[J]. Semin Oncol Nurs, 2019, 35(2): 166-174. DOI:10.1016/j.soncn.2019.02.003 |
| [2] |
姜松, 杜傲男, 杨婷婷, 等. 阴道模具预防宫颈癌放射性阴道狭窄的临床研究[J]. 中国辐射卫生, 2021, 30(2): 229-232. Jiang S, Du AN, Yang TT, et al. Clinical study of using constant temperature vaginal mould to prevent radiation vaginal stenosis in patients with cervical cancer treated with radiotherapy[J]. Chin J Radiol Health, 2021, 30(2): 229-232. DOI:10.13491/j.issn.1004-714X.2021.02.023 |
| [3] |
宜建英, 刘志礼, 王璐, 等. 晚期宫颈癌的免疫治疗研究进展[J]. 医学理论与实践, 2022, 35(22): 3814-3817. DOI: 10.19381/j.issn.1001-7585.2022.22.011. Yi JY, Liu ZL, Wang L, et al. Research progress in immunotherapy for advanced cervical cancer[J]. J Med Theory Pract, 2022, 35(22): 3814-3817. DOI: 10.19381/j.issn.1001-7585.2022.22.011. (in Chinese) |
| [4] |
李静, 孔为民. 复发性子宫颈癌的治疗研究进展[J]. 中国妇幼保健, 2023, 38(9): 1743-1746. DOI: 10.19829/j.zgfybj.issn.1001-4411.2023.09.049. Li J, Kong WM. Research progress in the treatment of recurrent cervical cancer[J]. Matern Child Health Care China, 2023, 38(9): 1743-1746. DOI: 10.19829/j.zgfybj.issn.1001-4411.2023.09.049. (in Chinese) |
| [5] |
Zhu HH, Hu J, Lo-Coco F, et al. The simpler, the better: oral arsenic for acute promyelocytic leukemia[J]. Blood, 2019, 134(7): 597-605. DOI:10.1182/blood.2019000760 |
| [6] |
张雅丽, 任金海, 崔丽艳, 等. 三氧化二砷对HL-60细胞增殖、分化和凋亡的影响及其作用机制探讨[J]. 中国实验血液学杂志, 2015, 23(3): 647-652. Zhang YL, Ren JH, Cui LY, et al. Effects of As2O3 on the proliferation, differentiation and apoptosis of HL-60 cells and its related mechanisms[J]. J Exp Hematol, 2015, 23(3): 647-652. DOI:10.7534/j.issn.1009-2137.2015.03.009 |
| [7] |
He ZY, Li HY, Yan J, et al. A prospective trial to evaluate the clinical efficacy and safety of neoadjuvant chemotherapy with arsenic trioxide and carboplatin in locally advanced cervical cancer: a study protocol for randomized controlled clinical[J]. Trials, 2022, 23(1): 556. DOI:10.1186/s13063-022-06489-1 |
| [8] |
陈洁盈, 陈耀庭, 林泽宇, 等. 三氧化二砷逆转低浓度索拉非尼对人肝癌细胞促迁移作用及其机制[J]. 中华肝脏外科手术学电子杂志, 2016, 5(2): 114-118. Chen JY, Chen YT, Lin ZY, et al. Inhibitory effect and mechanism of arsenic trioxide on human hepatocellular carcinoma cells migration ;induced by low dose of sorafenib[J]. Chin J Hepat Surg (Electron Ed), 2016, 5(2): 114-118. DOI:10.3877/cma.j.issn.2095-3232.2016.02.012 |
| [9] |
Yu J, Qian HL, Li YF, et al. Arsenic trioxide (As2O3) reduces the invasive and metastatic properties of cervical cancer cells in vitro and in vivo[J]. Gynecol Oncol, 2007, 106(2): 400-406. DOI:10.1016/j.ygyno.2007.04.016 |
| [10] |
Cai H, Li XP, Wang JL. Arsenic trioxide in the treatment of platinum-resistant recurrent endometrial cancer: a case report and literature review[J]. J Obstet Gynaecol, 2020, 40(1): 137-138. DOI:10.1080/01443615.2019.1588238 |
| [11] |
陈诚, 刘凯, 纪柏, 等. 丙戊酸钠对人肝癌SMMC-7221细胞的放疗增敏作用研究[J]. 中国辐射卫生, 2014, 23(1): 60-63. Chen C, Liu K, Ji B, et al. Radiosensitization effect of valproic acid on human hepatocellular cell line SMMC- 7221[J]. Chin J Radiol Health, 2014, 23(1): 60-63. DOI:10.13491/j.cnki.issn.1004-714X.2014.01.023 |
| [12] |
王东东, 刘培, 李阔, 等. 多目标优化在宫颈癌放疗中的临床应用分析[J]. 中国辐射卫生, 2022, 31(2): 219-223. Wang DD, Liu P, Li K, et al. Clinical application of multi-criteria optimization in radiotherapy for cervical cancer[J]. Chin J Radiol Health, 2022, 31(2): 219-223. DOI:10.13491/j.issn.1004-714X.2022.02.016 |
| [13] |
田茂叶, 聂红梅, 刘亚, 等. 细胞死亡在辐射防护与放疗增敏中的研究进展[J]. 中国辐射卫生, 2023, 32(2): 216-222. Tian MY, Nie HM, Liu Y, et al. Research progress of cell death in radiation protection and radiosensitization[J]. Chin J Radiol Health, 2023, 32(2): 216-222. DOI:10.13491/j.issn.1004-714X.2023.02.024 |
| [14] |
张宇睿, 徐文清. 电离辐射对线粒体损伤的研究进展[J]. 国际放射医学核医学杂志, 2016, 40(2): 154-158. Zhang YR, Xu WQ. Damages of ionizing radiation on mitochondria[J]. Int J Radiat Med Nucl Med, 2016, 40(2): 154-158. DOI:10.3760/cma.j.issn.1673-4114.2016.02.014 |
| [15] |
余小玲, 荣利, 方芳, 等. 低剂量X线辐射对A549细胞凋亡的适应性反应[J]. 中国辐射卫生, 2022, 31(2): 139-143,148. Yu XL, Rong L, Fang F, et al. Adaptive response of A549 cell apoptosis induced by low-dose X-ray irradiation[J]. Chin J Radiol Health, 2022, 31(2): 139-143,148. DOI:10.13491/j.issn.1004-714X.2022.02.001 |
| [16] |
Jiang ML, Jia KY, Wang L, et al. Alterations of DNA damage repair in cancer: from mechanisms to applications[J]. Ann Transl Med, 2020, 8(24): 1685. DOI:10.21037/atm-20-2920 |
| [17] |
冉曦, 肖春江, 冉新泽. 腹盆腔放射治疗的并发症及其防治研究[J]. 中国辐射卫生, 2017, 26(2): 249-253. DOI: 10.3969/j.issn.1004-714X.2017.02.040. Ran X, Xiao CJ, Ran XZ. Complications of abdominopelvic radiotherapy and its prevention and treatment[J]. Chin J Radiol Health, 2017, 26(2): 249-253. DOI: 10.3969/j.issn.1004-714X.2017.02.040. (in Chinese) |
| [18] |
Chun YJ, Park IC, Park MJ, et al. Enhancement of radiation response in human cervical cancer cells in vitro and in vivo by arsenic trioxide (As2O3)[J]. FEBS Lett, 2002, 519(1/3): 195-200. |
| [19] |
莫琳. 抑癌基因PTEN在同源重组修复及其敲除对Rad51基因表达的影响及机制研究[D]. 重庆: 重庆医科大学, 2009. Mo L. Study on the effect of PTEN on homologous recombination rapair, Rad51 and its mechanism[D]. Chongqing: Chongqing Medical University, 2009. (in Chinese) |
| [20] |
Adiga D, Eswaran S, Pandey D, et al. Molecular landscape of recurrent cervical cancer[J]. Crit Rev Oncol Hematol, 2021, 157: 103178. DOI:10.1016/j.critrevonc.2020.103178 |
| [21] |
张艳明, 张东峰. 放化疗联合治疗中晚期宫颈癌64例疗效观察[J]. 中国辐射卫生, 2011, 20(2): 245-246. DOI: 10.13491/j.cnki.issn.1004-714X.2011.02.068. Zhang YM, Zhang DF. Diagnosis and treatment chem - and radio - therapy obsevation of cases of mid - and late - stage cervical cancer on thuerapulic effect[J]. Chin J Radiol Health, 2011, 20(2): 245-246. DOI: 10.13491/j.cnki.issn.1004-714X.2011.02.068. (in Chinese) |
| [22] |
Jiang P, Zou LJ, Wei LC, et al. Chinese expert consensus on Iodine125 seed implantation for recurrent cervical cancer in 2021[J]. Front Oncol, 2021, 11: 700710. DOI:10.3389/fonc.2021.700710 |
| [23] |
Yu J, Qian HL, Li YF, et al. Therapeutic effect of arsenic trioxide (As2O3) on cervical cancer in vitro and in vivo through apoptosis induction[J]. Cancer Biol Ther, 2007, 6(4): 580-586. DOI:10.4161/cbt.6.4.3887 |
| [24] |
Wang GB, Liu JH, Hu J, et al. Mechanism of As2O3 induces apoptosis of glioma U87 cells[J]. Eur Rev Med Pharmacol Sci, 2017, 21(21): 4875-4881. |
| [25] |
Hoonjan M, Jadhav V, Bhatt P. Arsenic trioxide: insights into its evolution to an anticancer agent[J]. J Biol Inorg Chem, 2018, 23(3): 313-329. DOI:10.1007/s00775-018-1537-9 |
| [26] |
汪选斌, 柯静, 王家宁, 等. 三氧化二砷联合5-氟尿嘧啶对人大肠癌SW480细胞的抑制作用[J]. 郧阳医学院学报, 2007, 26(5): 278-280. Wang XB, Ke J, Wang JN, et al. The inhibitory effect of fluorouracil combined with arsenic trioxide on human colorectal cells SW480 by MTT[J]. J Yunyang Med Coll, 2007, 26(5): 278-280. DOI:10.3969/j.issn.1006-9674.2007.05.005 |
| [27] |
Mansour WY, Tennstedt P, Volquardsen J, et al. Loss of PTEN-assisted G2/M checkpoint impedes homologous recombination repair and enhances radio-curability and PARP inhibitor treatment response in prostate cancer[J]. Sci Rep, 2018, 8(1): 3947. DOI:10.1038/s41598-018-22289-7 |
| [28] |
Sinha A, Saleh A, Endersby R, et al. RAD51-mediated DNA homologous recombination is independent of PTEN mutational status[J]. Cancers, 2020, 12(11): 3178. DOI:10.3390/cancers12113178 |
| [29] |
Pei XL, Mladenov E, Soni A, et al. PTEN loss enhances error-prone DSB processing and tumor cell radiosensitivity by suppressing RAD51 expression and homologous recombination[J]. Int J Mol Sci, 2022, 23(21): 12876. DOI:10.3390/Ijms232112876 |
| [30] |
蒋超, 张鹏程, 王晓炜, 等. 二甲双胍对肺癌细胞A549放疗增敏作用及机制研究[J]. 中国辐射卫生, 2017, 26(6): 718-722. Jiang C, Zhang PC, Wang XW, et al. Sensitizing effect and Mechanism of metformin on radiotherapy of lung carcinoma A549 cells[J]. Chin J Radiol Health, 2017, 26(6): 718-722. DOI:10.13491/j.cnki.issn.1004-714X.2017.06.029 |




