2. 山东第一医科大学临床与基础医学院病理生理学系, 山东 济南 250117;
3. 山西省临汾市中心医院病理科, 山西 临汾 041000;
4. 山东第一医科大学附属中心医院肿瘤科, 山东 济南 250117;
5. 聊城市传染病医院病理科, 山东 聊城 252000
2. Department of Pathophysiology, School of Clinical and Basic Medicine, Shandong First Medical University, Jinan 250117 China;
3. Department of Pathology, Linfen Central Hospital, Shanxi Province, Linfen 041000 China;
4. Department of Oncology, Affiliated Central Hospital of Shandong First Medical University, Jinan 250117 China;
5. Department of Pathology, Liaocheng Infectious Disease Hospital, Liaocheng 252000 China
胸部肿瘤的临床治疗中,放射治疗已成为常用的治疗手段,但放疗会不可避免的导致放射性肺损伤(radiation-induced lung injury,RILI)[1]。巨噬细胞是体内炎症反应过程中的重要细胞,在受到刺激时,巨噬细胞的功能及表型等都会发生不同的分化。当机体发生放射性肺损伤时,巨噬细胞通常向M1亚型极化,会分泌促炎因子,如肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)等 [2-3]。这些促炎因子可诱导激活M2亚型巨噬细胞,M2亚型巨噬细胞可抑制炎症反应及促进组织修复的作用,其表达 CD206,产生白细胞介素10(IL-10)等抗炎因子。肺组织轻度的炎症反应可以自行消散,重度的炎症反应可能会导致肺部广泛的纤维化,因此RILI需要及时治疗[4]。
目前临床上在治疗RILI方面以激素类药物居多,这些药物副作用较多,尚无法完全满足临床用药需求,需开发更多疗效良好的新型抗炎药物[5]。很多研究证实,氢气可以显著抑制炎症反应,但具体机制尚未阐明。因此就迫切的需要研究氢气在RILI中的具体治疗机制,寻找一种有效的氢气治疗的方法[6-7]。
本研究建立小鼠RILI动物模型,给予小鼠模型不同周期的氢气吸入,拟从巨噬细胞极化的角度探讨氢气减轻放射性肺损伤的作用及具体机制。
1 材料和方法 1.1 材料 1.1.1 实验动物8周龄左右健康的C57BL/6小鼠共40只,体重18~22 g,购买于济南朋悦实验动物科技有限公司[许可证号: SCXK(鲁)20190003]。所有动物在标准条件下(22℃±2°C, 55%±10%湿度,12 h明暗循环)饲养,可自由使用标准小鼠食物和水。
1.1.2 主要试剂及设备TOP1020组织脱水机(德国Leica);EG1150C包埋机(德国Leica);RM2235切片机(德国Leica);H1220烘片机(德国Leica);高速组织研磨仪(武汉赛维尔生物科技有限公司);3D Histech数字病理切片扫描仪(匈牙利3D HISTECH有限公司);氢气发生器(SPE-300,济南浩伟实验仪器有限公司);LCA-5 空气发生器(邦西仪器科技(上海)有限公司);氢气检测器(XP-氢气3140,New Cosmos,日本);Rabbit Anti-IL-6 antibody(bs-0782R,Bioss,中国);Rabbit Anti-TNF alpha antibody(bs-10802R,Bioss,中国);Rabbit Anti-CD206 antibody(bsm-60761R,Bioss,中国);RabbitAnti-CD86 antibody(bs-1035R,Bioss,中国);Mouse Anti-ADGRE1 (F4/80) antibody(bsm-34028M,Bioss,中国);NF-κB p65 Monoclonal antibody(66535-1-Ig,Proteintech,中国);Rabbit Anti-Phospho-NFκB p65 (Ser468) antibody(bs-3485R,Bioss,中国)。
1.2 方法 1.2.1 构建放射性肺损伤动物模型通过腹腔注射戊巴比妥钠麻醉小鼠后放置于照射台,暴露小鼠胸部,照射部位为头部以下,剑突以上范围。对照组不做任何处理,按照分组要求照射剩余所有小鼠胸部。实验采用6 MV的X射线,剂量率为2 Gy/min,小鼠全肺一次性接受20 Gy射线照射。本实验经山东第一医科大学实验动物伦理委员会批准(W202311160312)。
1.2.2 实验分组及处理将40只C57BL/6小鼠,随机分组法分为4组,包括:正常对照组:未进行照射;模型组:单纯照射组,其余条件同对照组相同。治疗一组:小鼠照射后给予吸入氢气[混合氧气(4%氢气和96%空气) ]治疗,每天吸入4 h,连续干预2周后继续饲养至5周;治疗二组:小鼠照射后给予吸入氢气治疗,连续干预5周。所有小鼠在实验后的第5周麻醉后解剖,迅速取出肺组织,左肺冻存,用于蛋白免疫印迹检测;右肺采用10%甲醛溶液固定,用于常规病理及免疫荧光和免疫组化检测。
1.2.3 氢气干预方法照射后每天相同时间使用自制的供氢装置给予实验动物4 h ,4%氢气吸入治疗[7]。由氢气发生器和空气发生器分别提供氢气和空气,通过气体流量计调节流速使混合后的氢气体积分数为4%,气体总流速约为3 L/min。氢气浓度由氢气检测器确认。
1.2.4 苏木素-伊红(hematoxylin-eosine,HE)染色观察肺组织病理变化肺组织切片进行HE染色。步骤:(1)脱蜡至水;(2)染核;(3)分化与返蓝;(4)染质;(5) 脱水、透明;(6)图像分析与裁图。
1.2.5 免疫荧光技术检测 M1亚型巨噬细胞表面分子标志物CD86和M2亚型巨噬细胞表面分子标志物CD206的表达(1)脱蜡至水;(2)抗原修复;(3)封闭;(4)滴加一抗;(5)滴加二抗;(6)DAPI染核;(7)免疫荧光强度分析。
1.2.6 免疫组织化学法检测肺组织中细胞因子IL-6、TNF-α和IL-10的表达(1)二甲苯中脱蜡,随后进入梯度酒精,蒸馏水冲洗;(2)消除内源性过氧化物酶活性;(3)抗原修复;(4)封闭;(5)滴加一抗;(6)滴加二抗;(7)DAB显色;(8)苏木素复染;(9)脱水、透明;(10)免疫组化结果分析。
1.2.7 蛋白免疫印迹检测肺组织蛋白中NF-κB p65和P-NF-κB p65蛋白的表达情况(1)肺组织蛋白的提取;(2)将胶板清洗后,用单蒸水、双蒸水冲洗干净,晾干;(3)配制下层胶和上层胶,将配好的下层胶灌入胶板中,下层胶凝固后,灌入上层胶,将梳子倾斜插入上层胶,室温放置30 min;(4)电泳;(5)转膜;(6)封闭;(7)孵育一抗;(8)孵育二抗;(9)显影;(10)条带分析。
1.3 统计学方法通过GraphPad Prism 8对数据进行绘图并进行统计分析,计量数据以均数±标准差表示,通过单因素方差分析(one-way classification ANOVA)分析进行多组数据间比较,两组间的比较采用两独立样本t检验,P < 0. 05表示差异有统计学意义。
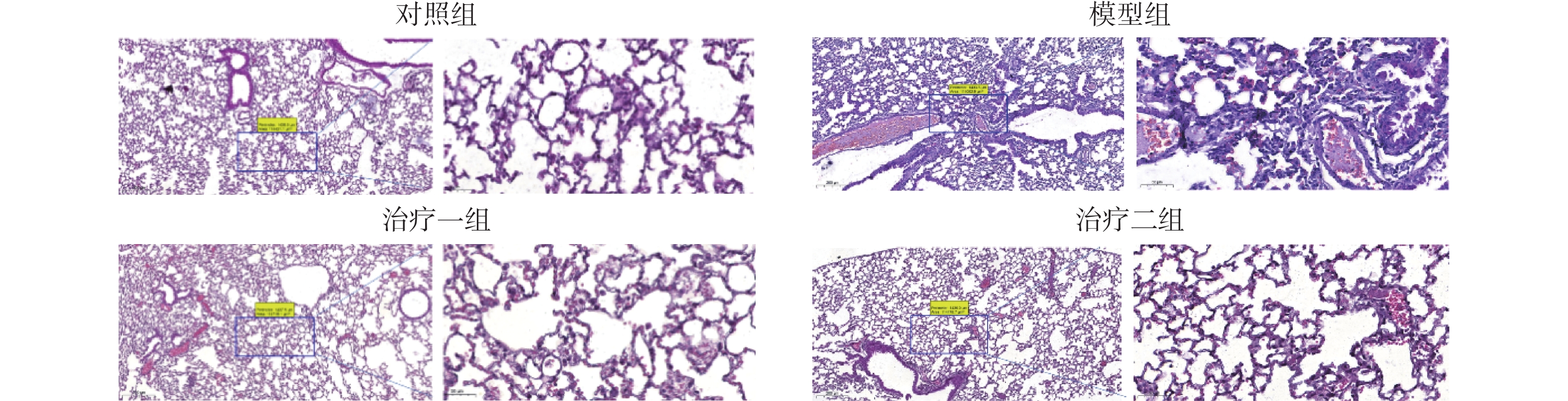
2 结 果 2.1 HE染色观察肺组织病理变化HE染色结果显示,与对照组相比,模型组肺组织肺泡间隔水肿增厚、血管扩张充血,炎细胞浸润,而氢气治疗组病变比模型组明显减轻,炎症反应减弱,且治疗二组较治疗一组明显(图1)。
|
图 1 HE染色观察各组小鼠肺组织的病理变化(比例尺为200 μm) Figure 1 Pathological changes in mouse lung tissue in each group observed with HE staining (scale bar, 200 μm) |
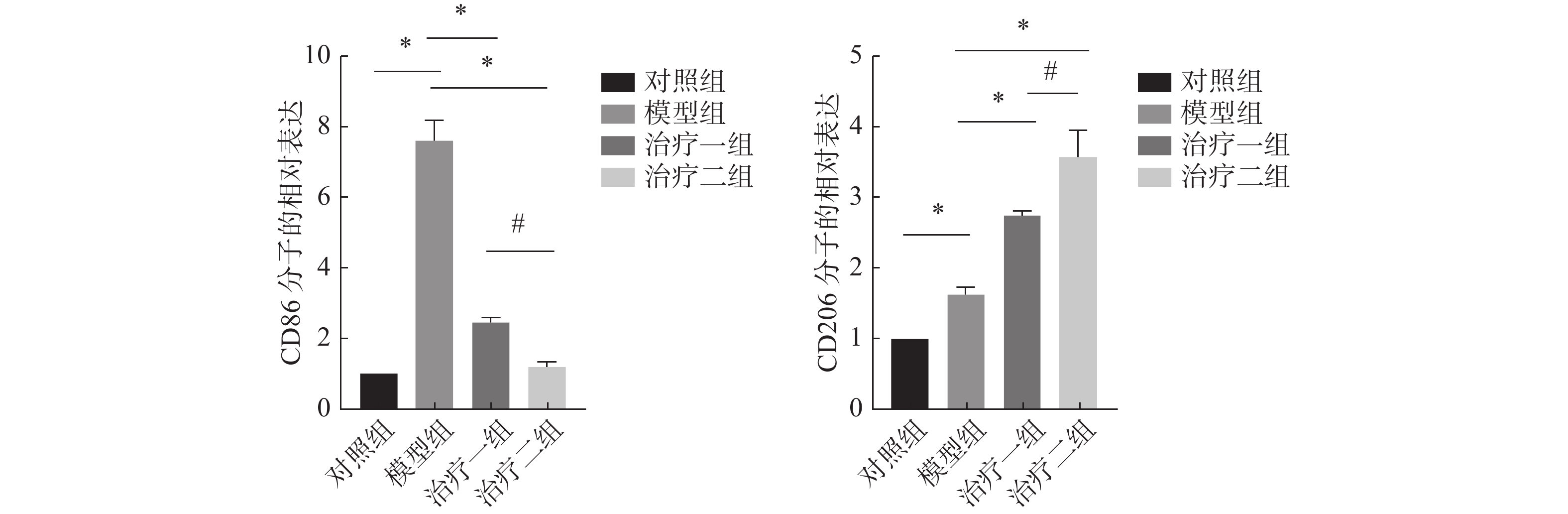
F4/80为巨噬细胞表面分子标志物,采用绿色荧光标记;CD86和CD206分别代表 M1和M2亚型巨噬细胞表面分子标志物,采用红色荧光标记。结果显示,与对照组相比较,模型组肺组织中M1亚型巨噬细胞>表面分子标志物CD86表达明显增多;M2亚型巨>噬细胞表面分子标志物CD206表达升高不明显。与模型组比较,氢气治疗组M1亚型巨噬细胞表面分子标志物CD86表达较模型组显著减少,而M2亚型巨噬细胞表面分子标志物CD206表达明显增多,治疗二组较治疗一组更加明显。以上结果说明了氢气可以明显促进巨噬细胞由M1亚型向M2亚型极化(图2~3)。

|
图 2 免疫荧光技术观察小鼠肺组织M1、M2 型巨噬细胞数量情况检测图(比例尺50 μm) Figure 2 The levels of M1 and M2 macrophages in mouse lung tissue observed with immunofluorescence staining (scale bar, 50 μm) |
|
图 3 免疫荧光技术检测小鼠肺组织M1、M2 型巨噬细胞数量统计图 Figure 3 Comparison of levels of M1 and M2 macrophages in mouse lung tissue detected with immunofluorescence staining 注:所有数据均按( |
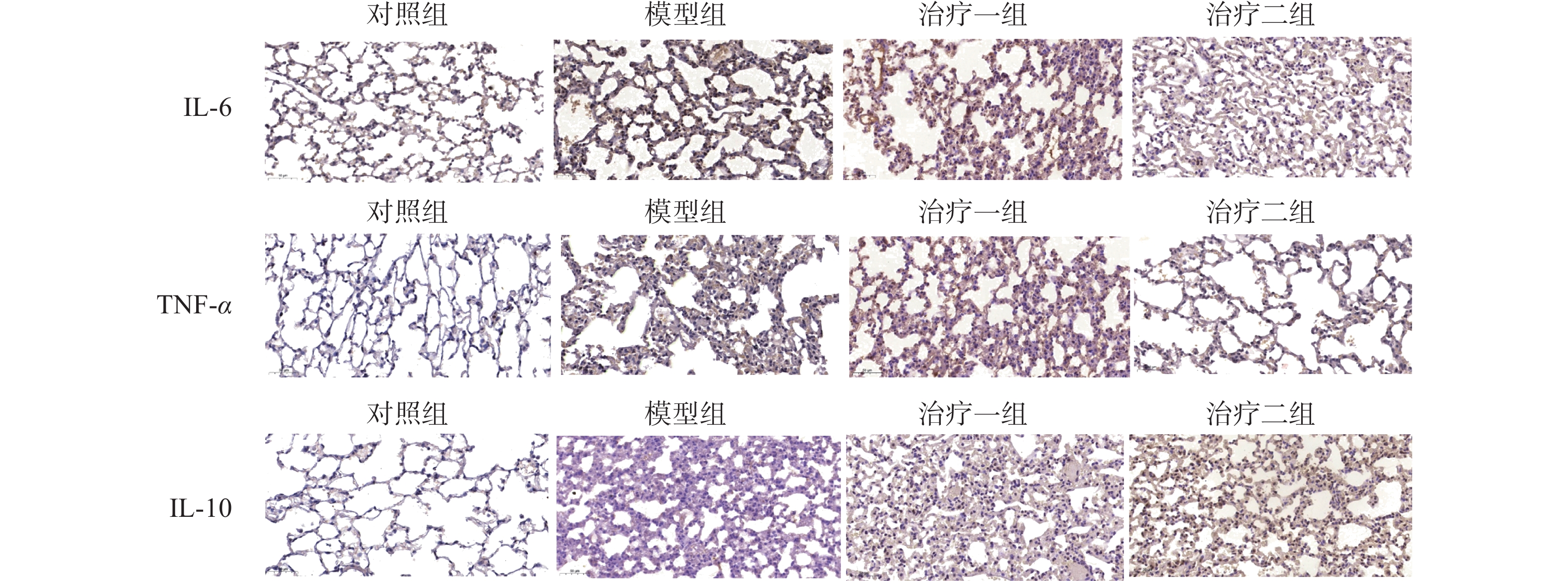
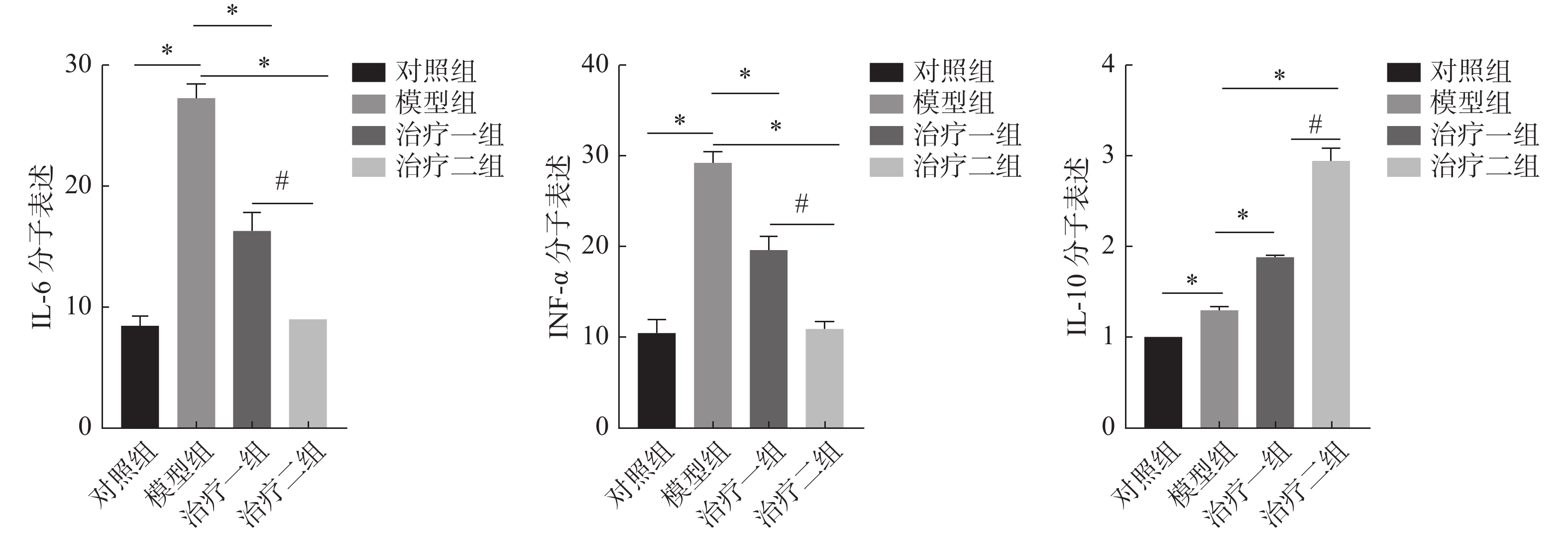
免疫组化结果显示,与对照组相比,模型组细胞因子IL-6和TNF-α的表达明显升高;与模型组相比,治疗组细胞因子IL-6和TNF-α的表达明显降低,且治疗二组比治疗一组降低更加明显。而治疗组细胞因子IL-10较模型组表达升高。且治疗二组比治疗一组升高明显。这些结果说明了在放射性肺损伤炎症反应中,M1亚型巨噬细胞可以释放细胞因子IL-6和TNF-α,而氢气治疗后可以明显降低细胞因子IL-6和TNF-α的表达,促进巨噬细胞由M1亚型向M2亚型极化,并且释放抗炎因子IL-10抑制放射性肺损伤的炎症反应(图4~5)。
|
图 4 免疫组化技术检测肺组织中细胞因子IL-6、TNF-α和IL-10的表达检测图(比例尺为200 μm) Figure 4 Expression of IL-6, TNF-α, and IL-10 in lung tissue detected by immunohistochemistry (scale bar, 200 μm) |
|
图 5 免疫组化技术检测肺组织中细胞因子IL-6、TNF-α和IL-10的表达统计图 Figure 5 Comparison of expression of IL-6, TNF-α, and IL-10 in lung tissue detected by immunohistochemistry 注:所有数据均按( |
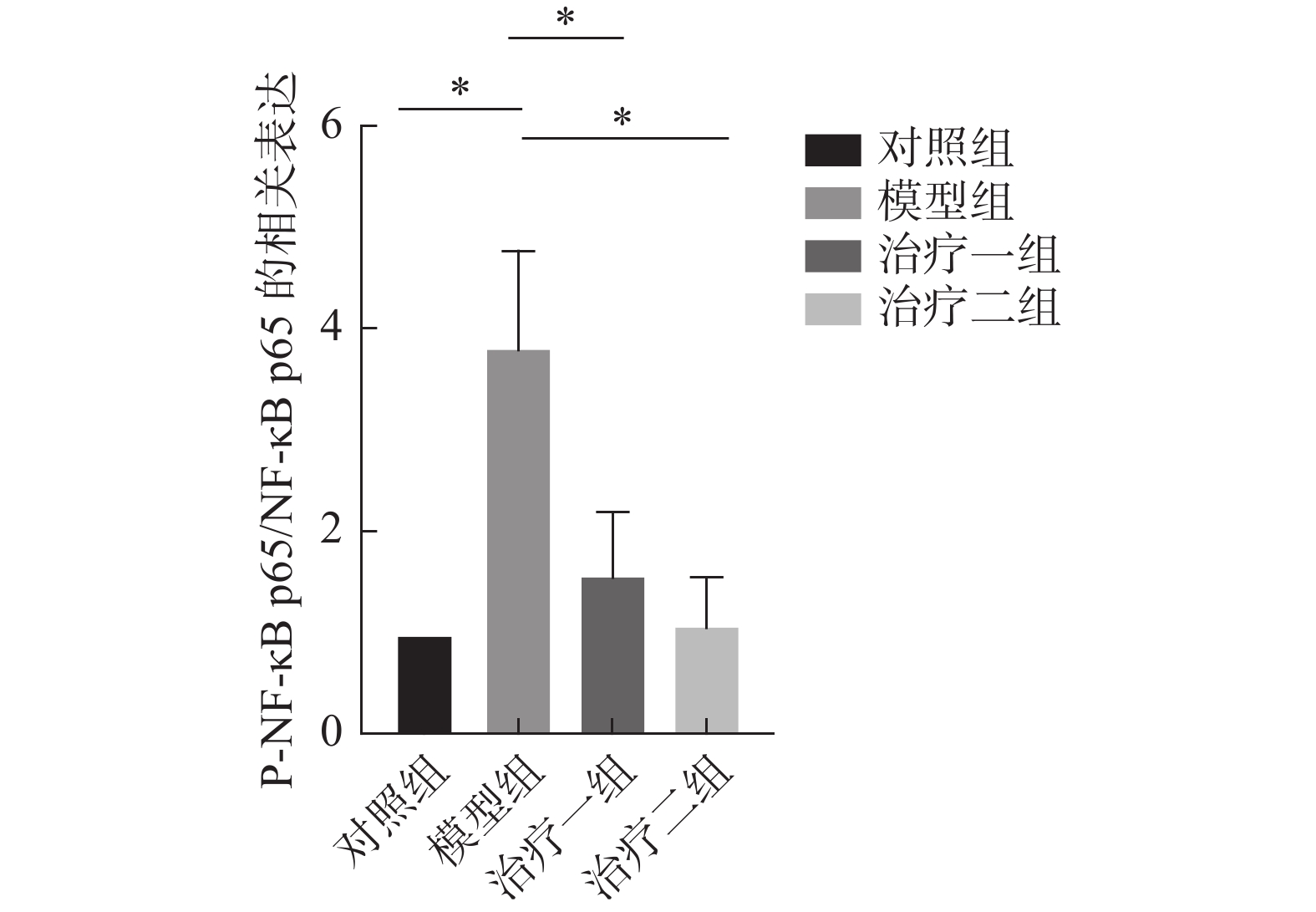
NF-κB信号通路是炎症反应的经典通路,我们检测了NF-κB信号通路相关蛋白NF-κB p65的磷酸化情况。蛋白免疫印迹检测结果显示,与对照组相比,模型组P-NF-κB p65/NF-κB p65明显增加。与模型组相比,氢气治疗组P-NF-κB p65/NF-κB p65明显降低,且治疗二组较治疗一组降低更加明显。这些结果说明了氢气治疗可以明显抑制NF-κB信号通路(图6~7)。

|
图 6 NF-κB p65和P-NF-κB p65蛋白免疫印迹检测图 Figure 6 Levels of NF-κB p65 and P-NF-κB p65 detected by Western blot |
|
图 7 P-NF-κB p65与NF-κB p65蛋白免疫印迹灰度值比值统计图。 Figure 7 Comparison of the ratio of gray values of P-NF-κB p65 to NF-κB p65 detected by Western blot 注:所有数据均按( |
在胸部肿瘤的治疗中,放疗已成为治疗常见胸部肿瘤的主要治疗手段[8]。放射治疗会不可避免的导致放射性肺损伤[1]。放射性肺损伤的病理变化主要为炎症反应,表现为损伤部位炎性细胞如单核细胞和中性粒细胞的升高,和分泌大量促炎因子IL-6以及TNF-α等[9]。放射性肺损伤在初始辐射暴露数月至数年后会导致辐射诱导的纤维化,主要与氧化应激反应密切相关[10-11]。氧化应激与炎症这两种机制在放射性肺损伤疾病的进展中相互作用,相互调节[12-13]。近几年来,虽然治疗RILI的药物方面不断增加,但其因治疗引发的并发症也不可避免[14-15]。因此寻求更好放射性肺损伤的治疗方式尤为重要。
氢气是一种新型抗氧化剂,目前的很多研究证实,通过多种途径摄入氢分子以后可以清除强效氧自由基,并且显著抑制炎症反应,通过降低促炎性细胞因子,减轻组织器官损伤[16-18]。有文献报道,氢气在RILI中具有一定的治疗作用[19],氢气治疗对体内急性和晚期辐射引起的肺损伤具有防护作用。但其具体机制尚未阐明。因此就迫切的需要研究氢气在RILI中的具体治疗机制,寻找一种有效氢气治疗RILI的方法。
巨噬细胞在机体的免疫防御中发挥重要作用。巨噬细胞可以向特定的功能表型分化,通常被认为M1亚型促炎,M2亚型抗炎[20]。当机体早期暴露于电离辐射条件下时,巨噬细胞会向M1亚型极化,产生炎症风暴促进放射性肺炎的进展[21]。在RILI中晚期时,巨噬细胞会向M2 型极化,M2亚型巨噬细胞会产生抗炎因子IL-10等促进炎症消退,吞噬凋亡细胞。NF-κB信号通路为经典的抗炎通路,其中NF-κB作为核转录因子可诱导免疫细胞的细胞因子的表达,是巨噬细胞发挥促炎功能的重要驱动因子,促使巨噬细胞向M1亚型极化[22]。已有文献证明当NF-κB信号通路受到抑制或激活时会明显影响巨噬细胞极化状态[23-24]。
本课题采用6 MV的X射线对小鼠进行单次胸部照射,照射剂量为20 Gy,通过与正常对照组比较,模型组肺组织肺泡间隔水肿增厚、血管扩张充血,炎细胞浸润,成功建立小鼠RILI模型[2]。通过吸入氢气的方式对模型组进行治疗,采用HE染色观察小鼠肺组织病理变化;免疫荧光观察巨噬细胞极化;免疫组化技术检测肺组织中细胞因子IL-6、TNF-α和IL-10的表达变化。我们验证了氢气治疗后模型组肺组织病变明显减轻。免疫荧光以及免疫组化结果证明模型组M1亚型巨噬细胞表达上调,同时产生大细胞因子IL-6和TNF-α。治疗组M1亚型巨噬细胞表达明显下调,同时M2亚型巨噬细胞表达上调,细胞因子IL-6和TNF-α均明显降低,而抗炎因子IL-10明显升高。因此氢气治疗促进了巨噬细胞向M2亚型极化,减轻了放射性肺损伤的炎症反应。为了进一步探讨氢气如何发挥保护作用,并促进巨噬细胞极化,我们通过蛋白免疫印迹检测肺组织蛋白中NF-κB p65和P-NF-κB p65蛋白的表达情况。与对照组相比,模型组P-NF-κB p65/NF-κB p65明显增加。与模型组相比,氢气治疗组P-NF-κB p65/NF-κB p65明显降低,且治疗二组较治疗一组降低更加明显。氢气治疗能明显抑制NF-κB信号通路的激活。且本次实验采用2周以及5周两种不同的治疗周期,虽然两种治疗周期均能达到减轻肺损伤的效果,但在治疗5周后肺损伤减轻效果更加明显。
综上所述,本研究数据说明氢气吸入对放射性肺损伤有一定的治疗作用,且在5周后更加明显。氢气可通过抑制NF-κB信号通路减轻放射性肺损伤的炎症反应,并促进巨噬细胞由M1亚型向M2亚型极化。
| [1] |
Giuranno L, Ient J, De Ruysscher D, et al. Radiation-induced lung injury (RILI)[J]. Front Oncol, 2019, 9: 877. DOI:10.3389/fonc.2019.00877 |
| [2] |
Niu SY, Zhang YH, Cong CS, et al. Comparative study of radiation-induced lung injury model in two strains of mice[J]. Health Phys, 2022, 122(5): 579-585. DOI:10.1097/HP.0000000000001532 |
| [3] |
Chen ZJ, Wu ZQ, Ning W. Advances in molecular mechanisms and treatment of radiation-induced pulmonary fibrosis[J]. Transl Oncol, 2019, 12(1): 162-169. DOI:10.1016/j.tranon.2018.09.009 |
| [4] |
Li JL, Wang R, Shi W, et al. Epigenetic regulation in radiation-induced pulmonary fibrosis[J]. Int J Radiat Biol, 2023, 99(3): 384-395. DOI:10.1080/09553002.2022.2089365 |
| [5] |
Arroyo-Hernández M, Maldonado F, Lozano-Ruiz F, et al. Radiation-induced lung injury: current evidence[J]. BMC Pulm Med, 2021, 21(1): 9. DOI:10.1186/s12890-020-01376-4 |
| [6] |
Zhou KX, Liu M, Wang YB, et al. Effects of molecular hydrogen supplementation on fatigue and aerobic capacity in healthy adults: a systematic review and meta-analysis[J]. Front Nutr, 2023, 10: 1094767. DOI:10.3389/fnut.2023.1094767 |
| [7] |
Liu BY, Xie YB, Chen J, et al. Protective effect of molecular hydrogen following different routes of administration on D-galactose-induced aging mice[J]. J Inflamm Res, 2021, 14: 5541-5550. DOI:10.2147/JIR.S332286 |
| [8] |
Yan YJ, Fu JM, Kowalchuk RO, et al. Exploration of radiation-induced lung injury, from mechanism to treatment: a narrative review[J]. Transl Lung Cancer Res, 2022, 11(2): 307-322. DOI:10.21037/tlcr-22-108 |
| [9] |
Yan YJ, Wu LL, Li XF, et al. Immunomodulatory role of azithromycin: potential applications to radiation-induced lung injury[J]. Front Oncol, 2023, 13: 966060. DOI:10.3389/fonc.2023.966060 |
| [10] |
Shrishrimal S, Kosmacek EA, Oberley-Deegan RE. Reactive oxygen species drive epigenetic changes in radiation-induced fibrosis[J]. Oxid Med Cell Longev, 2019, 2019: 4278658. DOI:10.1155/2019/4278658 |
| [11] |
耿爽, 李倩, 郗停停, 等. 补体在放射性肺损伤中的作用与机制[J]. 中国辐射卫生, 2022, 31(5): 535-541. Geng S, Li Q, Xi TT, et al. Role of complement in radiation-induced lung injury[J]. Chin J Radiol Health, 2022, 31(5): 535-541. DOI:10.13491/j.issn.1004-714X.2022.05.002 |
| [12] |
陈家祯, 王玉, 王存良, 等. 放射性肺损伤发病机制及分子靶向治疗研究进展[J]. 中国辐射卫生, 2021, 30(3): 377-380,390. Chen JZ, Wang Y, Wang CL, et al. Research progress on pathogenesis and molecular targeted therapy of radiation-induced lung injury[J]. Chin J Radiol Health, 2021, 30(3): 377-380,390. DOI:10.13491/j.issn.1004-714X.2021.03.023 |
| [13] |
Beach TA, Finkelstein JN, Chang PY. Epithelial responses in radiation-induced lung injury (RILI) allow chronic inflammation and fibrogenesis[J]. Radiat Res, 2023. DOI: 10.1667/RADE-22-00130.1.
|
| [14] |
Ying HJ, Fang M, Chen M. Progress in the mechanism of radiation-induced lung injury[J]. Chin Med J, 2021, 134(2): 161-163. DOI:10.1097/CM9.0000000000001032 |
| [15] |
Hanania AN, Mainwaring W, Ghebre YT, et al. Radiation-induced lung injury: assessment and management[J]. Chest, 2019, 156(1): 150-162. DOI:10.1016/j.chest.2019.03.033 |
| [16] |
Dumbuya JS, Li SQ, Liang LL, et al. Effects of hydrogen-rich saline in neuroinflammation and mitochondrial dysfunction in rat model of sepsis-associated encephalopathy[J]. J Transl Med, 2022, 20(1): 546. DOI:10.1186/s12967-022-03746-4 |
| [17] |
Yu MD, Qin C, Li P, et al. Hydrogen gas alleviates sepsis-induced neuroinflammation and cognitive impairment through regulation of DNMT1 and DNMT3a-mediated BDNF promoter IV methylation in mice[J]. Int Immunopharmacol, 2021, 95: 107583. DOI:10.1016/j.intimp.2021.107583 |
| [18] |
Ohsawa I. Biological responses to hydrogen molecule and its preventive effects on inflammatory diseases[J]. Curr Pharm Des, 2021, 27(5): 659-666. DOI:10.2174/1381612826666200925123510 |
| [19] |
Terasaki Y, Ohsawa I, Terasaki M, et al. Hydrogen therapy attenuates irradiation-induced lung damage by reducing oxidative stress[J]. Am J Physiol Lung Cell Mol Physiol, 2011, 301(4): L415-L426. DOI:10.1152/ajplung.00008.2011 |
| [20] |
Viola A, Munari F, Sánchez-Rodríguez R, et al. The metabolic signature of macrophage responses[J]. Front Immunol, 2019, 10: 1462. DOI:10.3389/fimmu.2019.01462 |
| [21] |
Yahyapour R, Shabeeb D, Cheki M, et al. Radiation protection and mitigation by natural antioxidants and flavonoids: implications to radiotherapy and radiation disasters[J]. Curr Mol Pharmacol, 2018, 11(4): 285-304. DOI:10.2174/1874467211666180619125653 |
| [22] |
Alharbi KS, Fuloria NK, Fuloria S, et al. Nuclear factor-kappa B and its role in inflammatory lung disease[J]. Chem Biol Interact, 2021, 345: 109568. DOI:10.1016/j.cbi.2021.109568 |
| [23] |
Zhang Q, Mao ZJ, Sun J. NF-κB inhibitor, BAY11-7082, suppresses M2 tumor-associated macrophage induced EMT potential via miR-30a/NF-κB/Snail signaling in bladder cancer cells[J]. Gene, 2019, 710: 91-97. DOI:10.1016/j.gene.2019.04.039 |
| [24] |
Li T, Li L, Peng RL, et al. Abrocitinib attenuates microglia-mediated neuroinflammation after traumatic brain injury via inhibiting the JAK1/STAT1/NF-κB pathway[J]. Cells, 2022, 11(22): 3588. DOI:10.3390/cells11223588 |




