2. 山东第一医科大学(山东省医学科学院)预防医学科学学院(放射医学研究所),山东 济南 250117
2. School of Preventive Medicine (Institute of Radiation Medicine), Shandong First Medical University (Shandong Academy of Medical Sciences), Jinan 250117 China
油田测井工人是长期稳定使用241Am/Be中子源的人群。241Am/Be中子源对人体的照射途径为快中子和γ射线外照射,快中子与人体氢、碳作用,还可以继发产生质子、α粒子、γ光子。ICRP 92号出版物显示,241Am/Be产生平均核能为4 MeV的中子,其相对生物效应较高,这得到很多实验的证实[1-5],出于对测井工人健康的保护,有必要对测井工人临床检验指标进行深入分析。
本研究主要是对受到长期测井源照射的测井工人外周血淋巴细胞的数量及其细胞周期变化进行分析,探讨淋巴细胞数量和周期是否随受照剂量发生改变以及改变的特征,同时通过流式细胞术分析不同剂量暴露组的细胞周期相关分子表达变化情况,有望发现低剂量辐射的潜在靶点。
1 材料和方法 1.1 调查对象调查人群为山东某公司操作测井源的在岗工人和上岗前工人。为了比较测井源辐射对工人淋巴细胞计数和细胞周期的影响,从该公司各个部门中选择165名个人剂量明确的在岗放射工作人员和73名即将转入测井岗位(岗前)的工人,形成照射组和对照组,在岗工人每次测井均操作241Am/Be和137Cs放射源,岗前工人从未接触放射源。入组标准为:两组工人均为男性,生活在同一园区,文化程度、年龄、BMI(身体质量指数)无明显差异,均无重大疾病,近期无抗生素使用史和医学影像检查史。
1.2 现场问卷调查问卷分为在岗期间工人调查表和上岗前工人调查表,内容包括姓名、年龄、身高、体重、是否常年持续上岗、吸烟和饮酒、劳动关系、既往病史、家族病史等。在岗期间工人调查表中设置了和剂量相关的内容,如放射工龄、接触放射源种类、操作放射源频次等。照射组和对照组人员现场填写调查表,共发放165份在岗期间工人调查表和73份上岗前工人调查表,并由工作人员逐项审核,确认工人常年持续上岗、填写信息完整、真实、逻辑合理后收回。
1.3 剂量调查 1.3.1 现场照射调查为了更加了解测井工人受照过程,项目组成员实地检测了测井过程各个环节中操作人员所在位置的环境剂量率和操作时长。测井人员操作放射源时,一个测量人员检测操作人员胸部位置的即时剂量率,另一位人员协助记录,测量5次求平均值。
1.3.2 个人剂量计的管理照射组和对照组人员工作时佩戴个人剂量计,每个剂量计内分别安装3个LiF圆片和一个CR-39(烯丙基二甘醇碳酸脂),LiF圆片用来检测γ照射剂量,由RBG-3B热释光测读仪检测,CR-39用来检测中子剂量,由TASLimage扫描仪测读。3个月更换1次个人剂量计,共测2个周期(2022.01.04−2022.06.03)。
1.4 设备和试剂便携式中子检测仪(美国thermo,FHT762)、环境级χ、γ辐射巡检仪(NT6101-S75)、RBG-3B热释光测度仪、TASLimage扫描仪、血细胞计数仪(ABX-pentra XL 80)、流式细胞仪(BD Fusion)、离心机、Percoll细胞分离液(Merck,USA)、PI/RNAse (Invitrogen,USA)、p21-anti-AF647(CST,USA)、CDK2-anti-PE(CST,USA)。
1.5 血细胞计数照射组和对照组的每个工人静脉抽取2 mL血液,颠倒混匀,观察血液性状,如血样未溶血、未凝固,则用血细胞分析仪检测淋巴细胞计数,检测3次求平均值。
1.6 细胞周期检测血常规检查结束后,将剩余血样常温放置1 h后离心,应用Percoll细胞分离液提取淋巴细胞,将淋巴细胞分为2份,1份用PI/RNAse孵育后流式检测细胞周期,1份用p21-anti-AF647和CDK2-anti-PE标记后流式检测P21和CDK2表达量。
1.7 统计学分析应用SPSS Statistics 21软件进行Student’s t 检验、单因素方差变异分析、Mann-Whitney U检验。
2 结 果 2.1 问卷调查结果所有工人均为男性,常年在公司上班,上岗前工人年龄为(44.23 ± 5.16)岁,在岗期间工人年龄为(47.22 ± 6.77)岁,组间均值比较P = 0.128,无统计学意义。吸烟、饮酒、劳动关系、健康状况指标在上岗前和在岗工人之间均无统计学意义。在岗职工中,放射工龄在3~36年内,均值为(19.00 ± 8.15)年。
2.2 测井工人的个人剂量测井工人从源出库、源运输、装卸源、入库全过程处于辐射环境,他们在各个工作环节所处的辐射剂量率不同,装卸源时,裸源完全暴露在环境中,操作工人接受的剂量最高。各个环节工人位置的环境剂量率见表1。
|
|
表 1 测井过程各个环节中工人受照剂量 Table 1 Exposure dose of workers in various positions during logging |
由2个周期的个人剂量(中子剂量、γ剂量的和)推算2022年度年受照剂量见表2,中子:γ累积剂量比 = 0.5~5(未列出)。
|
|
表 2 2022年在岗工人个人年剂量 Table 2 Individual annual dose for logging workers in 2022 |
上岗前工人淋巴细胞计数均值为2.25 × 109/L,在岗工人淋巴细胞均值为2.31 × 109/L,二者差值较小,Student’s t 检验得出P = 0.493,组间比较未见显著差别。将在岗工人淋巴细胞计数按照年剂量分组,发现“ ≤ 1 mSv”组工人相比上岗前工人,淋巴细胞计数均值显著增高,随着剂量增加,细胞计数均值不断下降。各组均值与上岗前工人淋巴细胞计数均值分别进行t检验,可见上岗前工人和“ ≤ 1 mSv”组在职工人的淋巴细胞计数具有显著差异,与其他两组比较未见差异,结果见图1。
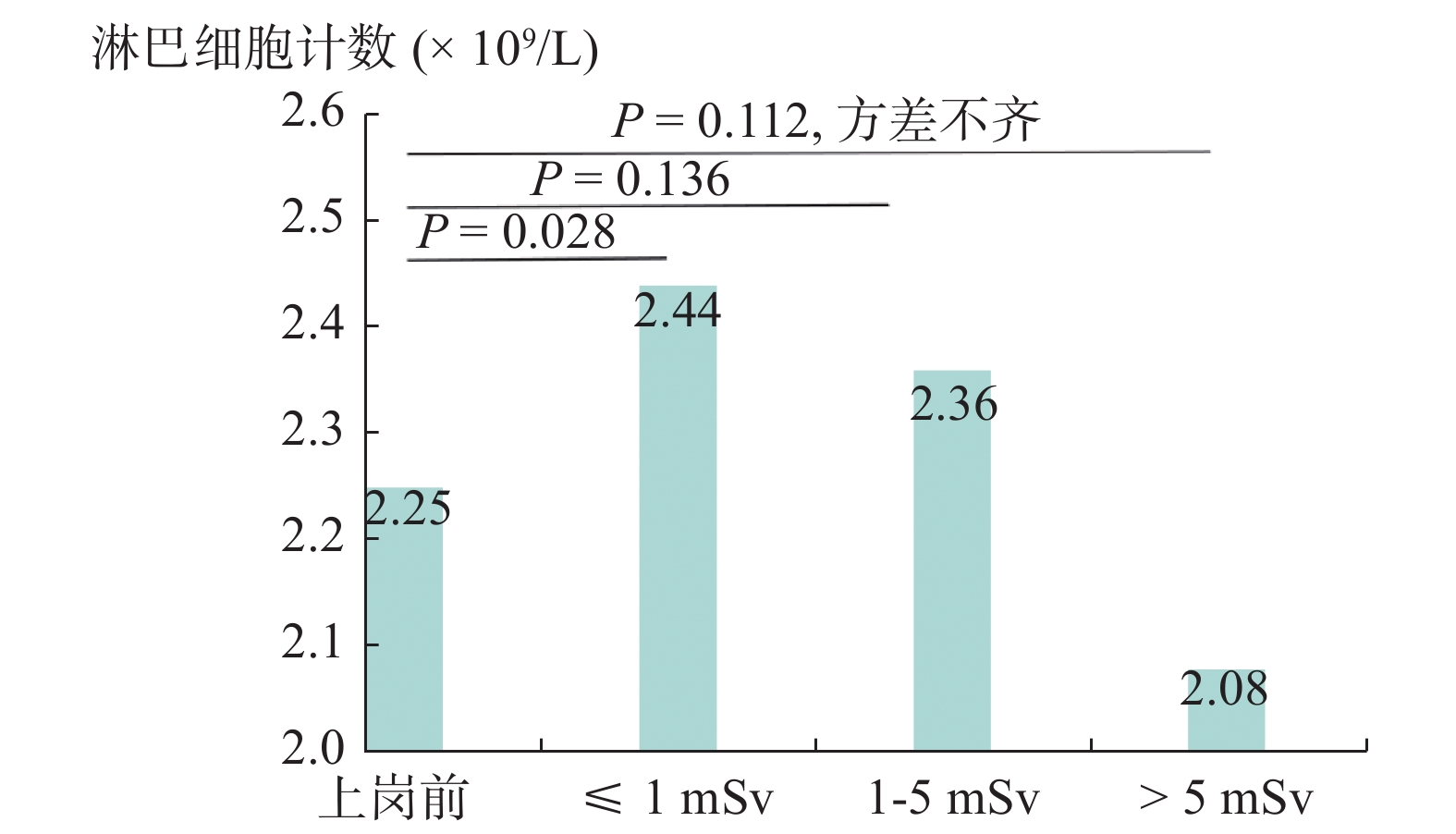
|
图 1 淋巴细胞计数均值在年剂量组间分布 Figure 1 Distribution of mean lymphocyte counts among annual dose groups |
将年剂量分为0~1、1~5、5~25 mSv组,计算照射组人员淋巴细胞计数在各分组内的均值。淋巴细胞计数在最小年剂量组间均值为2.45 × 109/L,在最大年剂量组均值2.08 × 109/L,差值比达到15%,结果见表3,检验结果显示年剂量组间并无差异,但发现随年剂量增高,淋巴细胞计数下降趋势明显。
|
|
表 3 淋巴细胞计数在年剂量分组间比较的总体差异 Table 3 Overall difference in lymphocyte counts between annual dose groups |
放射工龄和累积剂量,即长期照射密切相关(相关系数r = 0.529,P = 0.001,回归系数B = 0.505,P = 0.001),为了探索淋巴细胞计数对长期照射的反应,我们把放射工龄作为自变量进行分组分析。结果发现不同放射工龄组间均值差别较小(表4),无统计学意义。
|
|
表 4 淋巴细胞计数在不同放射工龄之间比较的总体差异 Table 4 Overall difference in lymphocyte counts between workers with different radiological service periods |
把照射组和对照组的每个样本的淋巴细胞数在G1、S、G2/M期内分布的比例进行整理,发现对照组各期细胞占比符合正态分布,照射组各期细胞均偏离正态分布。将两组数据进行Mann-Whitney U非参数检验,可见照射组G1期细胞占比增加,结果见图2。为了进一步验证和解释周期检测结果,我们将细胞周期蛋白P21和CDK2进行组间Mann-Whitney U检验,结果见图3。可见照射组细胞周期蛋白P21、CDK2表达增加。
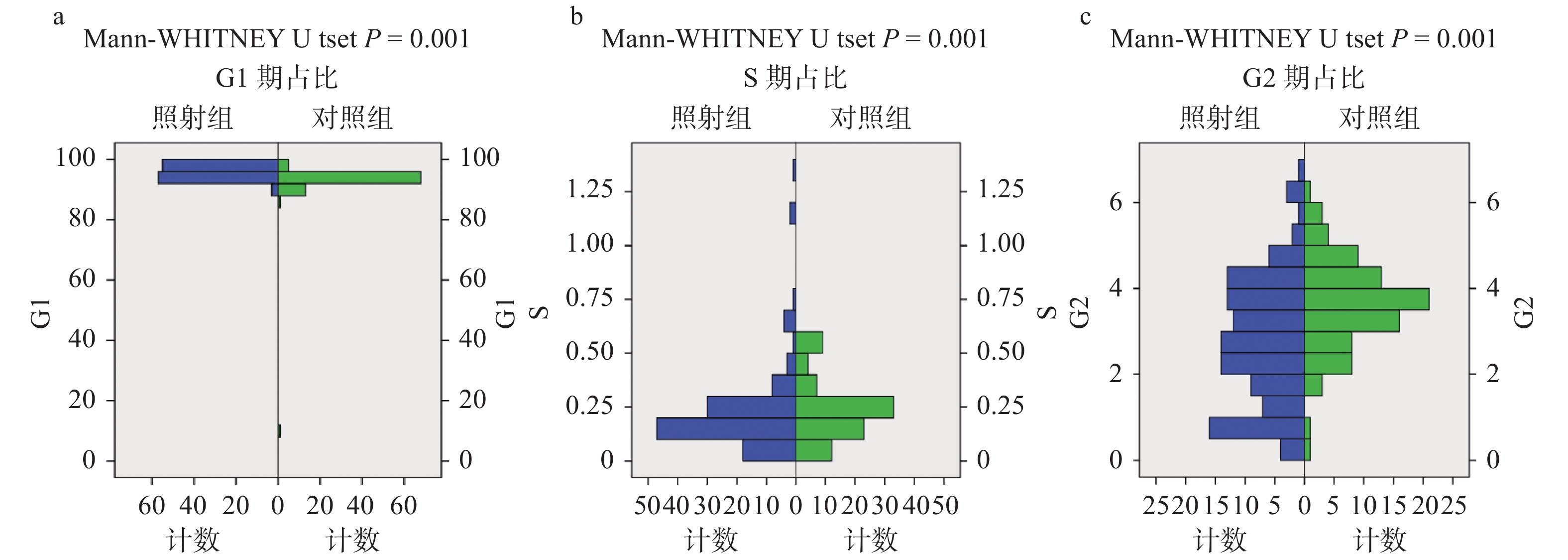
|
图 2 淋巴细胞在细胞周期各期内的分布 Figure 2 Distribution of lymphocytes in different cell cycle phases 注:照射组细胞周期分布趋于分散,偏离正态,和对照组明显不同。 |

|
图 3 淋巴细胞周期蛋白表达在照射组和对照组之间的差异 Figure 3 Difference in lymphocyte cyclin expression between irradiated and control groups |
低剂量辐射影响健康的证据多来自流行病学调查,主要通过比较受照人群和对照人群的临床指标发现某些差异[6-8]。不同于急性照射可以引起白细胞计数快速下降等变化,低剂量慢性照射作用于某个个体,很少引起肉眼可见体征或临床检验指标改变。对长期接受低剂量照射的工人的检查结果进行更加深入的分析可能有助于提供改善工人健康的生物学依据。
3.1 测井工人个人剂量及对淋巴细胞计数的动态影响从我们记录的工人受照剂量数据(表2)看出,约8%的测井工人年受照剂量达到5 mSv的调查剂量水平。很多文献证实,达到5 mSv的照射即可增加辐射致病风险[8-10],因此测井工人存在一定的职业健康风险,需要更加详细地分析工人的健康指标变化特征。正如本次调查所见(图1、表3),仅比较上岗前和在岗职工的淋巴细胞计数均值,二者并无差别,然而把在岗工人个人剂量进行分组后发现,受照剂量较少者细胞计数明显高于上岗前工人,并具有显著差异,随着个人受照剂量增加,细胞计数均值逐渐下降,接近甚至低于上岗前人员的细胞计数。这提示我们,较低剂量中子-γ照射可引起淋巴细胞计数升高,可能和淋巴母细胞的转化率提高有关[11],而继续接受长期照射则可促进淋巴细胞计数下降,这可能是细胞周期阻滞引起的,后者改变过程和大多数实验中辐射致细胞损伤的结果是一致的[12-13]。
3.2 年剂量和放射工龄对淋巴细胞计数的影响从本次调查结果看,年剂量组间淋巴细胞计数比较结果没有差异(表3),但发现年剂量组间细胞均值差距较大。此时不应该止于假设检验的P值得出的结论[14-17],而应该考虑辐射对细胞计数的实际效应,并通过某种比较将效应暴露出来,如将各剂量组细胞计数分别和上岗前细胞计数逐一比较,发现受照剂量较少人员淋巴细胞计数显著增高,只是随后缓慢的下降掩盖了不同剂量组间的差异。因此从实际效应来看,年剂量对淋巴细胞计数具有动态影响过程。同时观察发现放射工龄对淋巴细胞计数似乎没有影响(表4),这和其他文献报道有所不同。有的文献报道指出,接受X或γ照射的放射工作人员的淋巴细胞计数比非放射工作人员低[18-21],这可能是没有区别观察不同剂量组间的结果差别,也可能单纯的X或γ射线和中子-γ混合射线的作用机制不同。进一步分析个人受照剂量的成因(表1),可以发现装、卸源持续时长虽短,但受照剂量约占测井全过程剂量的80%,这种短期相对较大剂量率的受照特征可能也会引起不同的细胞反应。
3.3 细胞周期对职业照射的反应及对淋巴细胞计数的影响为了给流行病调查结果提供实验室佐证,项目组同时提取了照射组和对照组的淋巴细胞进行流式分析(图2,图3)。检验结果显示两组之间,GI期、G2期细胞分布显著不同。从图上直观地看出,受照后的细胞周期分布离散度增大,不再是准正态分布。可见低剂量照射影响细胞周期,导致G1、S期细胞比例增多,发生细胞周期阻滞。已经确定的是,辐射(无论类型)可破坏正常细胞周期的进程,导致受影响的细胞停止在细胞周期检查点,从而减缓细胞分裂[22],引起细胞计数下降。从细胞周期蛋白检测结果看出照射组周期蛋白表达增多,P21、CDK2会参与细胞周期的调节[23],引起细胞周期的再分布。实验结果和统计学结果的一致性,提示低剂量照射可以引起细胞数量和周期行为的变化。
| [1] |
Wang Q, Lee Y, Pujol-Canadell M, et al. Cytogenetic damage of human lymphocytes in humanized mice exposed to neutrons and X rays 24 h after exposure[J]. Cytogenet Genome Res, 2021, 161(6/7): 352-361. DOI:10.1159/000516529 |
| [2] |
Holden S, Perez R, Hall R, et al. Effects of acute and chronic exposure to a mixed field of neutrons and photons and single or fractionated simulated galactic cosmic ray exposure on behavioral and cognitive performance in mice[J]. Radiat Res, 2021, 196(1): 31-39. DOI:10.1667/RADE-20-00228.1 |
| [3] |
Little MP. Evidence for dose and dose rate effects in human and animal radiation studies[J]. Ann ICRP, 2018, 47(3/4): 97-112. DOI:10.1177/0146645318756235 |
| [4] |
Wang Y, Bannister LA, Sebastian S, et al. Low-dose radiobiology program at Canadian nuclear laboratories: past, present, and future[J]. Int J Radiat Biol, 2019, 95(10): 1361-1371. DOI:10.1080/09553002.2018.1562252 |
| [5] |
Moriyama H, Daino K, Imaoka T, et al. Neutron-induced rat mammary carcinomas are mainly of luminal subtype and have multiple copy number aberrations[J]. Anticancer Res, 2019, 39(3): 1135-1142. DOI:10.21873/anticanres.13222 |
| [6] |
Bosch De Basea Gomez M, Thierry-Chef I, Harbron R, et al. Risk of hematological malignancies from CT radiation exposure in children, adolescents and young adults[J]. Nat Med, 2023, 29(12): 3111-3119. DOI:10.1038/s41591-023-02620-0 |
| [7] |
Liu W, Haley BM, Kwasny MJ, et al. The effects of radiation and dose-fractionation on cancer and non-tumor disease development[J]. Int J Environ Res Public Health, 2012, 9(12): 4688-4703. DOI:10.3390/ijerph9124688 |
| [8] |
Metz-Flamant C, Samson E, Caër-Lorho S, et al. Solid cancer mortality associated with chronic external radiation exposure at the French atomic energy commission and nuclear fuel company[J]. Radiat Res, 2011, 176(1): 115-127. DOI:10.1667/RR2528.1 |
| [9] |
Foucault A, Ancelet S, Dreuil S, et al. Childhood cancer risks estimates following CT scans: an update of the French CT cohort study[J]. Eur Radiol, 2022, 32(8): 5491-5498. DOI:10.1007/s00330-022-08602-z |
| [10] |
Pearce MS, Salotti JA, Little MP, et al. Radiation exposure from CT scans in childhood and subsequent risk of leukaemia and brain tumours: a retrospective cohort study[J]. Lancet, 2012, 380(9840): 499-505. DOI:10.1016/S0140-6736(12)60815-0 |
| [11] |
刘树铮, 苏旭, 李修义, 等. 医学放射生物学[M]. 3版. 北京: 原子能出版社, 2006: 305. Liu SZ, Su X, Li XY, et al. Medical radiobiology[M]. 3rd Ed. Beijing: China Atomic Energy Press, 2006: 305. |
| [12] |
Fujikawa K, Hasegawa Y, Matsuzawa S, et al. Dose and dose-rate effects of X rays and fission neutrons on lymphocyte apoptosis in p53( + / + ) and p53( − / − ) mice[J]. J Radiat Res, 2000, 41(2): 113-127. DOI:10.1269/jrr.41.113 |
| [13] |
Bozhenko VK, Ivanov AV, Kulinich TM, et al. Comparison of biological effects of γ-radiation of low and ultra-high dose rate on lymphocytes and cultured human malignant lymphoma cells[J]. Bull Exp Biol Med, 2019, 166(6): 785-787. DOI:10.1007/s10517-019-04440-0 |
| [14] |
Nuzzo R. Scientific method: statistical errors[J]. Nature, 2014, 506(7487): 150-152. DOI:10.1038/506150a |
| [15] |
Wasserstein RL, Lazar NA. The ASA statement on p-values: context, process, and purpose[J]. Am Stat, 2016, 70(2): 129-133. DOI:10.1080/00031305.2016.1154108 |
| [16] |
Amrhein V, Greenland S, McShane B. Scientists rise up against statistical significance[J]. Nature, 2019, 567(7748): 305-307. DOI:10.1038/d41586-019-00857-9 |
| [17] |
Hurlbert SH, Levine RA, Utts J. Coup de Grâce for a tough old bull: “statistically significant” expires[J]. Am Stat, 2019, 73(S1): 352-357. DOI:10.1080/00031305.2018.1543616 |
| [18] |
王丽东, 那向杰, 赵杰, 等. 介入放射工作人员血液指标影响因素调查[J]. 中华劳动卫生职业病杂志, 2021, 39(12): 924-928. Wang LD, Na XJ, Zhao J, et al. Investigation on influencing factors of blood indexes of interventional radiology workers[J]. Chin J Ind Hyg Occup Dis, 2021, 39(12): 924-928. DOI:10.3760/cma.j.cn121094-20210511-00248 |
| [19] |
单铁梅, 付丽丽, 王丽东, 等. 电离辐射对放射工作者职业健康的影响[J]. 中国辐射卫生, 2021, 30(4): 402-406. Shan TM, Fu LL, Wang LD, et al. Effect of ionizing radiation on the occupational health of radiologists[J]. Chin J Radiol Health, 2021, 30(4): 402-406. DOI:10.13491/j.issn.1004-714X.2021.04.003 |
| [20] |
李全开, 张素英, 胡江. 低剂量电离辐射对放射工作人员血像及细胞遗传学影响[J]. 工业卫生与职业病, 2011, 37(3): 155-158. Li QK, Zhang SY, Hu J. Effect of low-dose ionized radiation on hemogram and cytogenetics of exposed workers[J]. Ind Health Occup Dis, 2011, 37(3): 155-158. DOI:10.13692/j.cnki.gywsyzyb.2011.03.003 |
| [21] |
刘凤君, 许国琼. 低剂量电离辐射对人体外周血象影响流行病学分析[J]. 饮食保健, 2018, 5(48): 5-6. Liu FJ, Xu GQ. Epidemiological analysis of the effects of low-dose ionizing radiation on human peripheral blood cell analysis[J]. Diet Health, 2018, 5(48): 5-6. DOI:10.3969/j.issn.2095-8439.2018.48.006 |
| [22] |
Sia J, Szmyd R, Hau E, et al. Molecular mechanisms of radiation-induced cancer cell death: a primer[J]. Front Cell Dev Biol, 2020, 8: 41. DOI:10.3389/fcell.2020.00041 |
| [23] |
Khan MGM, Wang Y. Advances in the current understanding of how low-dose radiation affects the cell cycle[J]. Cells, 2022, 11(3): 356. DOI:10.3390/cells11030356 |




