2. 山东第一医科大学临床与基础医学院病理生理学系, 山东 济南 250117;
3. 山西省临汾市中心医院病理科, 山西 临汾 041099;
4. 聊城市传染病医院病理科, 山东 聊城 252002
2. Department of Pathophysiology, School of Clinical and Basic Medicine, Shandong First Medical University & Shandong Academy of Medical Sciences, Jinan 250117 China;
3. Department of Pathology, Linfen Central Hospital, Linfen 041099 China;
4. Department of Pathology, Liaocheng Infectious Disease Hospital, Liaocheng 252002 China
放射性肺损伤(radiation-nduced lung injury,RILI) 是放射治疗胸部肿瘤所引起的常见并发症,早期主要以肺炎(adiation pneumonia,RP)为主,后期发展为辐射纤维化(radiation fibrosis,RF) [1]。在RILI的临床治疗中主要以抗生素、抗组胺药物和激素治疗药物为主,氨磷汀是目前FDA批准的唯一的放射保护剂,但是由于其明显的副作用如低耐受性、严重恶心和低血压,限制了其在临床的应用[2-3]。间充质干细胞(esenchymal stem cell, MSC)是一类多功能干细胞,由于其自身的低免疫原性、多向分化潜能、来源丰富而备受关注,在RILI治疗中具有调节炎症反应和受损组织修复的功能[4]。其中骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)是骨髓中存在的一类非造血干细胞,除自身的多向分化潜能之外,还具有免疫和造血功能。在肺部免疫细胞中,巨噬细胞是固有免疫中重要的效应细胞,按照其发挥的功能不同,巨噬细胞可以分为具有促炎作用的M1型巨噬细胞和具有抗炎作用的M2型巨噬细胞 [5]。最近研究表明,骨髓间充质干细胞具有减轻放射性肺损伤急性炎症作用,但其具体作用机制尚不清楚。本研究拟从巨噬细胞极化角度,研究骨髓间充质干细胞减轻放射性肺损伤的作用机制,进一步明确间充质干细胞在治疗RILI中的抗炎能力,为其治疗和预防提供新的思路。
1 材料与方法 1.1 材料C57BL/6 SPF级小鼠45只,雄性,6~8周龄,体重18~20 g,购自山东省济南朋悦实验动物有限公司。实验动物饲养于山东省医学科学院动物房,室内温度26℃。将动物平均分为Control组、Model组和BMSCs治疗组,每组15只。骨髓间充质干细胞(来源于本实验室)、山羊抗兔(1∶50,中杉金桥)、IL-6(bs-0782R,Bioss)、TNF-α(bs-10802R,Bioss)、山羊抗兔(ZB-2301,中杉金桥)、DAB(ZLI-9018,中杉金桥)、山羊抗鼠(1∶50,中杉金桥)、F4/80(1∶100,bsm-34028M,Bioss)、CD86(1∶100,bs-1035R,Bioss)、CD206(1∶100,18704-1-AP,Proteintech)、羊抗鼠488(1∶200,ZF-0512,中杉金桥)、山羊抗兔594(1∶200,ZF-0516,中杉金桥)、E-cadherin(1∶1000,bs-1519R,Bioss)、N-cadherin(1∶1000,22018-1-AP,Proteintech)、Vimentin(1∶2000,10366-1-AP,Proteintech)、β-actin(1∶1000,66009-I-Ig,Proteintech)、生物辐照仪(RS2000X-Ray,美国Rad source)、TS100型倒置荧光显微镜(武汉赛维尔)、3D扫描仪(3D Histech数字病理切片扫描仪,匈牙利)、组织匀浆机(高速组织研磨仪,武汉赛维尔)、BIO-RAD ChemiDoc凝胶成像系统(美国伯乐)。
1.2 模型构建及BMSCs干预Model组和BMSCs治疗组小鼠用1%戊巴比妥钠(50 mg/kg)进行腹腔注射,等待小鼠麻醉后,将其放在照射台,采用6 MV的X射线进行单次胸部照射,照射部位为头部以下、剑突以上,剂量为20 Gy,剂量率为2 Gy/min;对照组不做任何处理。BMSCs治疗组于照射后6 h之内通过尾静脉注射Brdu标记的BMSCs(1 × 106 cells/只),其余条件同Control组相同。
1.3 HE染色 (hematoxylin-eosin staining,HE)石蜡切片脱蜡梯度制水后,PBS洗涤3次,每次5 min,纯水洗涤1次,5 min;放日Harris苏木精中染色1 min,自然水洗1 min;1%盐酸酒精分化液分化30 s后,自来水洗5 min;将切片放入伊红染色2 min,分别经过85%酒精5 s、90%酒精5 s、95%酒精I 1 min、95%酒精II 1 min、无水乙醇I 3 min、无水乙醇II 3 min、二甲苯I 2 min、二甲苯II 2 min,中性树胶封片。
1.4 免疫组化 (immunohistochemistry,IHC)石蜡切片经过烤片、脱蜡梯度制水后,用0.3%的过氧化氢溶液室温灭活内源性过氧化物酶20 min,PBS缓冲液洗涤3次后,用EDTA抗原修复液进行抗原修复,恢复室温并用PBS洗涤3次,每次5 min;用5%的山羊血清37℃孵育30 min,不洗,滴加一抗IL-6(1∶300,bs-0782R,Bioss)和TNF-α(1∶300,bs-10802R,Bioss)进行过夜孵育,第2天,PBS洗涤3次,每次5 min;滴加山羊抗兔(1∶10000)在37℃湿盒孵育,PBS缓冲液洗涤3次,每次5 min;用配好的DAB溶液镜下显色,纯水终止显色。苏木素染核1 min,用1%的盐酸酒精分化液分化30 s,冲水反蓝10 min,梯度脱水脱乙醇,用中性树胶进行封片。
1.5 免疫荧光 (Immunofluorescence,IF)石蜡切片烤片1 h,透明剂中3 h进行脱蜡,依次经过由高到低浓度酒精进行制水,PBS缓冲液洗3次,每次5 min;利用EDTA抗原修复液在高压锅中修复20 min,PBS缓冲液洗3次,每次5 min;滴加5%的山羊血清,在37℃恒温箱中孵育30 min,甩干后分别滴加F4/80和CD86、F4/80和CD206孵育,4℃过夜。第2天拿出复温1 h,PBS缓冲液洗3次,每次5 min;甩干后滴加羊抗鼠488和山羊抗兔594,恒温箱37℃孵育1 h,PBS缓冲液洗3次,每次5 min;用含DAPI的封片机剂进行封片。在3D病理切片扫描仪下观察巨噬细胞数量变化。
1.6 免疫蛋白印迹称取小鼠新鲜肺组织50~100 mg于EP管中,加入预冷的生理盐水以去除组织表面的血液,将组织放入配置好的500 uL的蛋白裂解液中(RIPA裂解液:蛋白没抑制剂PMSF = 100∶1),在组织匀浆机(高速组织研磨仪,武汉赛维尔)上进行高速振碎,冰上静止10 min,使其充分裂解,4℃,12000 r低温离心15 min,吸取上清至新的EP管中。通过BCA发测定蛋白浓度后加入上清体积1/4的5x蛋白质凝胶电泳上样缓冲液,混匀后,在100℃的水中煮沸20 min,冷却后−20℃短期保存备用。制备8%聚丙烯酰胺凝胶后,按照每孔10 uL上样,压缩胶恒压80 V 25 min,分离胶120 V进行电泳,恒流300 mA 1 h将蛋白转移至PVDF膜(甲醇浸泡2 min激活),随后使用5%的脱脂奶粉室温封闭1.5 h,1×TBST洗膜3次,分别按如下稀释比例加入一抗:E-cadherin、N-cadherin、Vimentin、β-actin,4℃冰箱孵育过夜。次日室温复温1 h,1×TBST溶液,10 min/次,成像并拍照(BIO-RAD ChemiDoc凝胶成像系统,美国伯乐),Image Lab分析条带灰度值。
1.7 统计学分析通过GraphPad Prism9.0软件进行统计分析并进行数据绘图,n = 3,分析不同组间比较采用独立样本t检验;P < 0.05表示差异有统计学意义。
2 结果 2.1 肺部病理形态结构变化为验证RILI小鼠模型是否建造成功以及BMSCs干预的疗效,我们通过HE染色来观察小鼠肺部结构变化(如图1所示),Control组结构正常且清晰,少有炎性渗出;Model组小鼠肺组织血管扩张充血,肺间隔明显增厚,炎细胞浸润,II型肺泡细胞明显减少且巨噬细胞明显增加,说明RILI小鼠模型的建模成功;BMSCs治疗组整体炎症较Model组减轻,II型肺泡细胞明显增多且巨噬细胞明显减少,说明BMSCs具有减轻放射性肺损伤炎症的能力。

|
图 1 肺部组织病理学形态变化 Figure 1 Histopathological morphological changes in the lung |
为进一步验证BMSCs的抗炎能力,我们通过免疫组织化学技术检测肺组织炎症因子IL-6和TNF-α表达水平。结果显示,与Control组相比,炎症因子 IL-6和TNF-α的表达在Model组中的表达显著增高(P < 0.01),在经过BMSCs尾静脉注射治疗后,炎症因子表达显著下降(P < 0.05, P < 0.01),如图2所示。

|
图 2 小鼠肺组织炎症因子IL-6和TNF-α在Control组、Model组、BMSCs组表达变化(比例尺50 μm) Figure 2 The expression of inflammatory factors IL-6 and TNF in mouse lung tissue in the control, model, and BMSCs groups (scale, 50 μm) |
我们通过免疫荧光技术检测肺组织中巨噬细胞的极化情况,巨噬细胞的极化主要有两种,即M1促炎型和M2抗炎型。我们用巨噬细胞特异性标志物F4/80来观察整体巨噬细胞的表达情况,通过M1型特异性物CD86和M2型特异性标志物CD206来观察巨噬细胞极化的表达水平。各组小鼠F4/80和CD86的阳性细胞结果显示,与Model组相比,CD86在BMSCs治疗组的阳性细胞数量显著降低(P < 0.05)。与Control组相比,Model组F4/80和CD86的阳性细胞数量显著增加(P < 0.05)。如图3A所示。各组小鼠F4/80和C206的阳性细胞结果显示,与Model组相比,CD206在BMSCs治疗组的阳性细胞数量显著增高(P < 0.01)。与Control组相比,Model组F4/80和CD206的阳性细胞数量显著降低(P < 0.05)。如图3B所示。

|
图 3 免疫荧光检测巨噬细胞M1型和M2型标记物的表达变化(比例尺50 μm) Figure 3 Changes in the expression of macrophage M1-type and M2-type markers with immunofluorescence staining (scale, 50 μm) 注:A图为免疫荧光检测肺组织中F4/80、CD86的表达变化;B图为免疫荧光检测肺组织中F4/80、CD206的表达变化。 |
在放射性肺损伤的急性期利用BMSCs进行干预,通过影响巨噬细胞的M1型和M2型的相互转化,进而影响EMT发展的进程。为了进一步验证我们的假设,采用免疫蛋白印迹检测各组小鼠肺组织中EMT特征性标志物E-cadherin、N-cadherin、Vimentin的表达水平。结果显示,与Control组相比,N-cadherin和Vimentin在Model组表达显著升高(P < 0.05),BMSCs组中N-cadherin和Vimentin表达显著降低(P < 0.05, P < 0.01)。如图4所示。
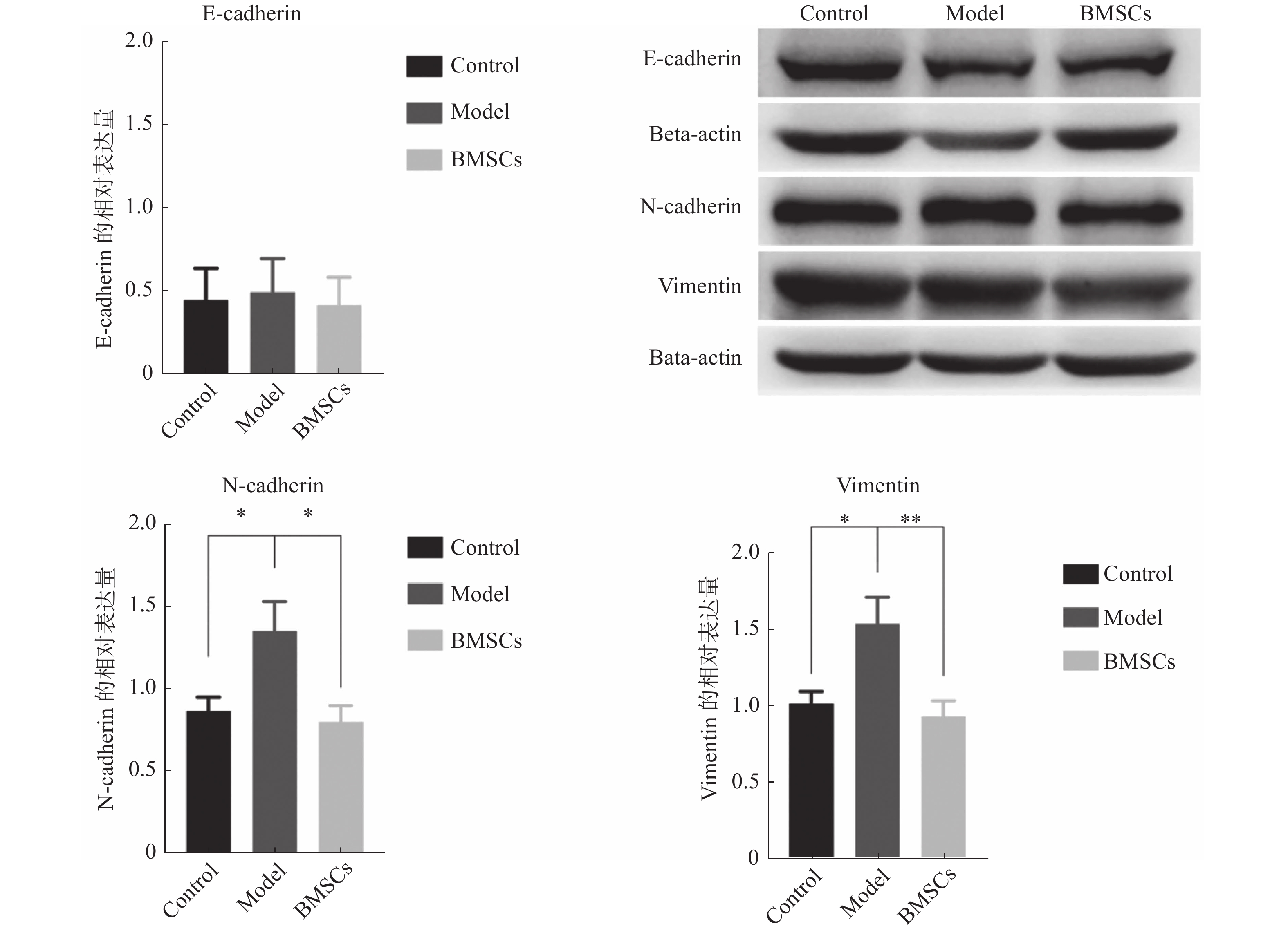
|
图 4 免疫蛋白印迹技术检测肺组织中E-cadherin、N-cadherin、Vimentin蛋白的表达水平(比例尺为50 μm) Figure 4 The expression levels of E-cadherin, N-cadherin, and vimentin in lung tissue by Western blot (scale, 50 μm) 注:*为P <0.05;**为P <0.01。 |
放射性肺损伤是放疗后多种细胞和细胞因子所共同作用的结果,目前发生概率为20%,分为炎症前期和肺纤维化时期 [6]。研究发现,肺部对于辐射更加敏感,在治疗期间,单次、全胸、高剂量率暴露于X射线的致死剂量(LD50)约为10 Gy,因此肿瘤的控制受限 [7]。放射性肺损伤严重患者由于肺部纤维化导致呼吸困难、生活质量下降且危及生命。根据细胞因子假说,组织细胞在辐射后产生活性氧(reactive oxygen species, ROS)刺激上皮细胞、血管内皮细胞等生成炎症因子,主要包括TNF-α、IL-6、转化生长因子-β1(TGF-β1)等,大量的细胞因子会刺激成纤维细胞的分裂和增值,进一步发展为RF [8-10]。目前临床治疗因药物的副作用,限制了其临床应用。因此,探寻针对RILI的特定治疗方法亟待解决。
肺部巨噬细胞位于肺泡腔中,是呼吸道的第一道防线,按照其功能分为促炎的M1型巨噬细胞和抗炎的M2型巨噬细胞,二者在维持肺部炎症环境和RILI进程中发挥重要作用 [5,11]。辐射损伤后,巨噬细胞发展成激活的M1型或M2型转变为M1型,分泌的大量炎症因子加快炎症的发生 [11-12]。在低氧和辐射的联合作用下,巨噬细胞会产生更多的ROS并引起活性氧级联,进而引起巨噬细胞向M1型极化,促进RP的进程 [13]。RILI中晚期,低浓度的ROS会促进巨噬细胞向M2型极化,促进上皮-间质转化,造成过多的胶原和细胞外基质的沉积,最终形成RF [14]。干细胞由于其自身的优点被广泛的应用于各种疾病治疗的研究 [15]。研究发现,脂肪来源的间充质干细胞(adipose-derived mesenchymal stem cells, ADSCs)的应用导致促炎细胞因子表达降低,相反抗炎细胞因子的表达增高 [8, 11, 15]。因此,推测干细胞可能在M1和M2型巨噬细胞相互转变的过程中发挥重要作用,进而影响急性期EMT的发展。
研究表明,放射性肺损伤在ADSCs治疗后炎因子的表达显著下降[8, 11, 16, 17, 20],同时M1型巨噬细胞抑制细胞增殖并导致组织损伤,而M2型巨噬细胞促进细胞增殖和组织修复[18, 19, 21]。之前的研究也发现BMSCs和胎盘间充质干细胞(placental mesenchymal stem cells, pMSCs)在免疫抑制特性使得M1型向M2型极化,抑制疾病炎症进程促进组织修复[22-24],而巨噬细胞M1型和M2型在纤维化进展中发挥重要作用[5, 11-14]。在本研究中,Model组小鼠肺部损伤明显,出现典型的病理变化,如肺组织血管扩张充血,肺间隔明显增厚,炎细胞浸润,且炎症因子IL-6和TNF-α的表达明显增加,同时M1型巨噬细胞标志物CD86表达明显增加,与前期研究相符[16-20],而BMSCs组上述病变明显减轻并且炎症因子表达明显减少,且M2性巨噬细标志物CD206明显增加。综上,放射性肺损伤模型的建立成功,并验证了BMSCs针对RILI炎症的疗效。初步的机制研究也表明BMSCs组中N-cadherin和Vimentin表达显著降低(P < 0.05, P < 0.01),提示在放射性肺损伤急性期应用BMSCs进行干预,上皮间质转化早期分子机制有逆转。
综上所述,本研究显示,骨髓间充质干细胞治疗放射性肺损伤效果显著。干细胞可能通过影响M1型和M2型巨噬细胞之间相互极化来抑制RILI早期进程,但具体机制需要进一步研究。因此干细胞调节巨噬细胞极化也为临床治疗提供了一种新的方式。
| [1] |
Bledsoe TJ, Nath SK, Decker RH. Radiation pneumonitis[J]. Clin Chest Med, 2017, 38(2): 201-208. DOI:10.1016/j.ccm.2016.12.004 |
| [2] |
Hanania AN, Mainwaring W, Ghebre YT, et al. Radiation-induced lung injury: assessment and management[J]. Chest, 2019, 156(1): 150-162. DOI:10.1016/j.chest.2019.03.033 |
| [3] |
Devine A, Marignol L. Potential of amifostine for chemoradiotherapy and radiotherapy-associated toxicity reduction in advanced NSCLC: a meta-analysis[J]. Anticancer Res, 2016, 36(1): 5-12. |
| [4] |
Niu SY, Zhang YY. Applications and therapeutic mechanisms of action of mesenchymal stem cells in radiation-induced lung injury[J]. Stem Cell Res Ther, 2021, 12(1): 212. DOI:10.1186/s13287-021-02279-9 |
| [5] |
Novak ML, Koh TJ. Macrophage phenotypes during tissue repair[J]. J Leukoc Biol, 2013, 93(6): 875-881. DOI:10.1189/jlb.1012512 |
| [6] |
牛世英, 丛昌盛, 孙美丽, 等. 冷诱导RNA结合蛋白在放射性肺损伤模型中的表达变化[J]. 中国辐射卫生, 2022, 31(1): 33-38,46. Niu SY, Cong CS, Sun ML, et al. Expression of cold-inducible RNA-binding protein in radiation-induced lung injury model[J]. Chin J Radiol Health, 2022, 31(1): 33-38,46. DOI:10.13491/j.issn.1004-714X.2022.01.007 |
| [7] |
Van Dyk J, Keane TJ, Kan S, et al. Radiation pneumonitis following large single dose irradiation: a re-evaluation based on absolute dose to lung[J]. Int J Radiat Oncol Biol Phys, 1981, 7(4): 461-467. DOI:10.1016/0360-3016(81)90131-0 |
| [8] |
Jiang XP, Jiang X, Qu C, et al. Intravenous delivery of adipose-derived mesenchymal stromal cells attenuates acute radiation-induced lung injury in rats[J]. Cytotherapy, 2015, 17(5): 560-570. DOI:10.1016/j.jcyt.2015.02.011 |
| [9] |
Tsoutsou PG, Koukourakis MI. Radiation pneumonitis and fibrosis: mechanisms underlying its pathogenesis and implications for future research[J]. Int J Radiat Oncol Biol Phys, 2006, 66(5): 1281-1293. DOI:10.1016/j.ijrobp.2006.08.058 |
| [10] |
陈家祯, 王玉, 王存良, 等. 放射性肺损伤发病机制及分子靶向治疗研究进展[J]. 中国辐射卫生, 2021, 30(3): 377-380,390. Chen JZ, Wang Y, Wang CL, et al. Research progress on pathogenesis and molecular targeted therapy of radiation-induced lung injury[J]. Chin J Radiol Health, 2021, 30(3): 377-380,390. DOI:10.13491/j.issn.1004-714X.2021.03.023 |
| [11] |
Zhang Y, Jiang XP, Ren LQ. Optimization of the adipose-derived mesenchymal stem cell delivery time for radiation-induced lung fibrosis treatment in rats[J]. Sci Rep, 2019, 9(1): 5589. DOI:10.1038/s41598-019-41576-5 |
| [12] |
Chen HX, Xiang H, Xu WH, et al. Manganese superoxide dismutase gene-modified mesenchymal stem cells attenuate acute radiation-induced lung injury[J]. Hum Gene Ther, 2017, 28(6): 523-532. DOI:10.1089/hum.2016.106 |
| [13] |
Yahyapour R, Shabeeb D, Cheki M, et al. Radiation protection and mitigation by natural antioxidants and flavonoids: implications to radiotherapy and radiation disasters[J]. Curr Mol Pharmacol, 2018, 11(4): 285-304. DOI:10.2174/1874467211666180619125653 |
| [14] |
Giuranno L, Ient J, De Ruysscher D, et al. Radiation-induced lung injury (RILI)[J]. Front Oncol, 2019, 9: 877. DOI:10.3389/fonc.2019.00877 |
| [15] |
Parekh KR, Nawroth J, Pai A, et al. Stem cells and lung regeneration[J]. Am J Physiol Cell Physiol, 2020, 319(4): C675-C693. DOI:10.1152/ajpcell.00036.2020 |
| [16] |
Ying HJ, Fang M, Hang QQ, et al. Pirfenidone modulates macrophage polarization and ameliorates radiation-induced lung fibrosis by inhibiting the TGF-β1/Smad3 pathway[J]. J Cell Mol Med, 2021, 25(18): 8662-8675. DOI:10.1111/jcmm.16821 |
| [17] |
Gao J, Peng S, Shan XN, et al. Inhibition of AIM2 inflammasome-mediated pyroptosis by Andrographolide contributes to amelioration of radiation-induced lung inflammation and fibrosis[J]. Cell Death Dis, 2019, 10(12): 957. DOI:10.1038/s41419-019-2195-8 |
| [18] |
Zheng JC, Wang Y, Wang ZW, et al. Near-infrared Nrf2 activator IR-61 dye alleviates radiation-induced lung injury[J]. Free Radic Res, 2022, 56(5/6): 411-426. DOI:10.1080/10715762.2022.2132942 |
| [19] |
Zheng L, Zhu Q, Xu C, et al. Glycyrrhizin mitigates radiation-induced acute lung injury by inhibiting the HMGB1/TLR4 signalling pathway[J]. J Cell Mol Med, 2020, 24(1): 214-226. DOI:10.1111/jcmm.14703 |
| [20] |
Wu X, Ji H, Wang Y, et al. Melatonin alleviates radiation-induced lung injury via regulation of miR-30e/NLRP3 axis[J]. Oxid Med Cell Longev, 2019, 2019: 4087298. DOI:10.1155/2019/4087298 |
| [21] |
Mills CD. M1 and M2 macrophages: oracles of health and disease[J]. Crit Rev Immunol, 2012, 32(6): 463-488. DOI:10.1615/critrevimmunol.v32.i6.10 |
| [22] |
Cho DI, Kim MR, Jeong HY, et al. Mesenchymal stem cells reciprocally regulate the M1/M2 balance in mouse bone marrow-derived macrophages[J]. Exp Mol Med, 2014, 46(1): e70. DOI:10.1038/emm.2013.135 |
| [23] |
Abumaree MH, Al Jumah MA, Kalionis B, et al. Human placental mesenchymal stem cells (pMSCs) play a role as immune suppressive cells by shifting macrophage differentiation from inflammatory M1 to anti-inflammatory M2 macrophages[J]. Stem Cell Rev Rep, 2013, 9(5): 620-641. DOI:10.1007/s12015-013-9455-2 |
| [24] |
Li MY, Xu JY, Mei XL, et al. Regulatory effects of dermal papillary pluripotent stem cells on polarization of macrophages from M1 to M2 phenotype in vitro[J]. Transpl Immunol, 2019, 52: 57-67. DOI:10.1016/j.trim.2018.11.003 |




