2. 广东省职业病防治院, 广东 广州 510300;
3. 广州医科大学公共卫生学院, 广东 广州 511436
2. Guangdong Province Hospital for Occupational Disease Pevention and Treatment, Guangzhou 510300 China;
3. School of Public Health, Guangzhou Medical University, Guangzhou 511436 China
联合国原子辐射效应科学委员会(UNSCEAR)将低剂量电离辐射(low-dose ionizing radiation, LDIR)定义为外照射剂量低于200 mGy或剂量率低于0.1 mGy/min (1 h以内或1 h以上的平均剂量率)的X或γ射线[1]。多项证据表明,LDIR可引起非致癌效应,如眼晶状体、甲状腺和肝脏等特异性靶器官疾病和非特异靶器官疾病(如心血管疾病等)[2-3]。心血管疾病是全球头号死因疾病,据估计,2019年有1790万人死于心血管疾病,占全球死亡人数的32%[4],我国心血管疾病负担是全球最高的国家之一[5]。辐射流行病学研究发现日本原子弹爆炸幸存者(累积剂量0.5~2 Gy)的中风和心脏病的发病率增加[6]。国际辐射防护委员会(ICRP)也指出,0.5 Gy电离辐射照射10年后,约1%的受照个体会发生心血管疾病[7]。
细胞衰老是指细胞长期稳定地丧失增殖能力,但仍保持正常代谢活性的一种细胞状态[8],其显著特征是特异性标记“衰老相关β半乳糖苷酶(senescence-associated β-Galactosidase, SA-β-gal)” 溶酶体酶的积累[9]。内皮细胞(endothelial cells, ECs)作为形成所有血管内壁的单层细胞,在控制血管张力和血管生成等多种生理过程中起关键作用[10]。研究表明,电离辐射诱导ECs衰老引起内皮功能障碍是导致心血管疾病发生的关键[11-12]。
电离辐射可直接引起DNA双链断裂或通过诱导产生大量活性氧(reactive oxygen species, ROS)引起氧化应激而间接导致DNA氧化损伤[13]。当机体DNA损伤修复系统功能受损以及氧化-抗氧化动态失衡时,导致DNA损伤反应持续激活而引起细胞衰老[14-16]。电离辐射还可影响DNA损伤反应信号传导如激活肿瘤抑制因子p53,并刺激细胞周期蛋白依赖性激酶抑制剂p21和p16的表达以维持衰老相关的生长阻滞[17]。目前关于LDIR诱导ECs衰老的相关研究较少且主要集中于高累积剂量辐射实验,如4.1 mGy/h(累积剂量为4.13 Gy)和2.4 mGy/h(累积剂量为4.03 Gy)可诱导人脐静脉内皮细胞衰老[18-19],但分次LDIR诱导ECs衰老研究尚未见报道。
本研究以人脐静脉内皮细胞融合细胞(EA.hy926)为研究对象,探讨氧化-抗氧化及氧化损伤水平在分次LDIR诱导ECs细胞衰老中的作用,为长期接触LDIR诱导心血管损伤的早期效应研究提供科学依据。
1 材料与方法 1.1 试剂和仪器杜氏改良伊格尔(氏)高糖培养基(DMEM)(美国Corning公司);噻唑兰(MTT)细胞增殖及细胞毒性检测试剂盒、细胞衰老β-半乳糖苷酶染色试剂盒(碧云天生物技术有限公司);qPCR荧光定量试剂盒(日本Takara公司);抗磷酸化H2A组蛋白变体X(Phosphorylated H2A histone family member X, γ-H2AX)抗体(美国CST公司);异硫酸荧光素(FITC)二抗(爱必信生物科技有限公司);ChiRad 160 X射线辐照仪(台湾达尔生技有限公司);LightCycler96型实时荧光定量PCR仪(瑞士Roche公司);全波长酶标仪(美国Thermo Fisher公司)。
1.2 细胞培养与辐照分组人脐静脉内皮细胞融合细胞(EA.hy926)(购自浙江美森细胞科技有限公司)用含有10%胎牛血清,1%青霉素-链霉素的DMEM培养基于37℃、5% CO2培养箱培养。单次辐照:采用辐照仪辐照细胞1次,辐照剂量分别为0、50、100、200、400、800、1600和3200 mGy,剂量率为100 mGy/min。多次辐照:采用辐照仪辐照细胞4次,每次辐照间隔48 h,辐照剂量分别为0、50、100和200 mGy,剂量率为100 mGy/min。
1.3 MTT法检测细胞增殖率接种细胞于96孔板,单次辐照结束后置于37℃的CO2培养箱中继续培养。于辐照后24、48和72 h,每孔加入20 μL MTT溶液(5 mg/mL)后置于培养箱孵育4 h,孵育结束后每孔加入150 μL DMSO,避光,低速振摇10 min。调节酶标仪在490 nm处测得其吸光度值。计算细胞增殖率(%)=(A实验孔-A空白孔)/(A对照孔-A空白孔) × 100%。
1.4 SA-β-gal染色接种细胞于35 mm培养皿,LDIR辐照4次结束后置于37℃的CO2培养箱中继续培养24、48和72 h。用细胞SA-β-gal染色试剂盒固定细胞并染色,在光学显微镜下观察并拍摄图片,计算SA-β-gal染色阳性面积。
1.5 实时荧光定量聚合酶链式反应(real time quantitative polymerase chain reaction, RT-qPCR)检测接种细胞于60 mm培养皿,LDIR辐照4次结束后置于37℃的CO2培养箱中继续培养24、48和72 h。Trizol法提取细胞总RNA并逆转录为 cDNA,按照试剂盒步骤进行定量检测分析。PCR引物序列如下:ACTB (β-actin),正向引物5’-GGCACCCAGCACAATGAAG-3’,反向引物5’-CCGATCCACACGGAGACTTTG-3’;CDKN1A (p21),正向引物5’-GATTAGCAGCGGAACAAGGAG-3’,反向引物5’-CAACGTTAGTGCCAGGAAAGAC-3’;CDKN2A (p16),正向引物5’-GGAGGCCGATCCAGGTCAT-3’,反向引物5’-ACGGGTCGGGTGAGAGTG-3’。
1.6 ROS水平检测接种细胞于24孔板,LDIR辐照4次结束后置于37℃的CO2培养箱中分别继续培养24、48和72 h。利用荧光探针DCFH-DA进行活性氧检测,用倒置荧光显微镜观察并拍摄图片,计算ROS荧光强度。
1.7 总抗氧化能力(total antioxidant capacity, T-AOC)检测接种细胞于60 mm培养皿,分别于LDIR辐照4次结束后24、48和72 h收集细胞,置于150 μL冰冷的PBS溶液中,超声以充分破碎细胞,4℃,12000 g离心10 min。取上清,用BCA蛋白浓度检测试剂盒测定蛋白样品浓度。根据试剂盒步骤检测细胞T-AOC水平。
1.8 免疫荧光检测接种细胞于24孔板,LDIR辐照4次结束后置于37℃的CO2培养箱中继续分别培养24、48和72 h。用4%多聚甲醛室温固定细胞,0.5%Triton X-100溶液室温下通透,使用2% BSA溶液室温封闭。γ-H2AX一抗于4℃孵育过夜,FITC二抗室温避光孵育。加入DAPI染色,于倒置荧光显微镜观察并拍摄图片,计算γ-H2AX荧光强度。
1.9 统计分析采用SPSS 25.0软件进行统计学分析,计量资料以均数±标准差(
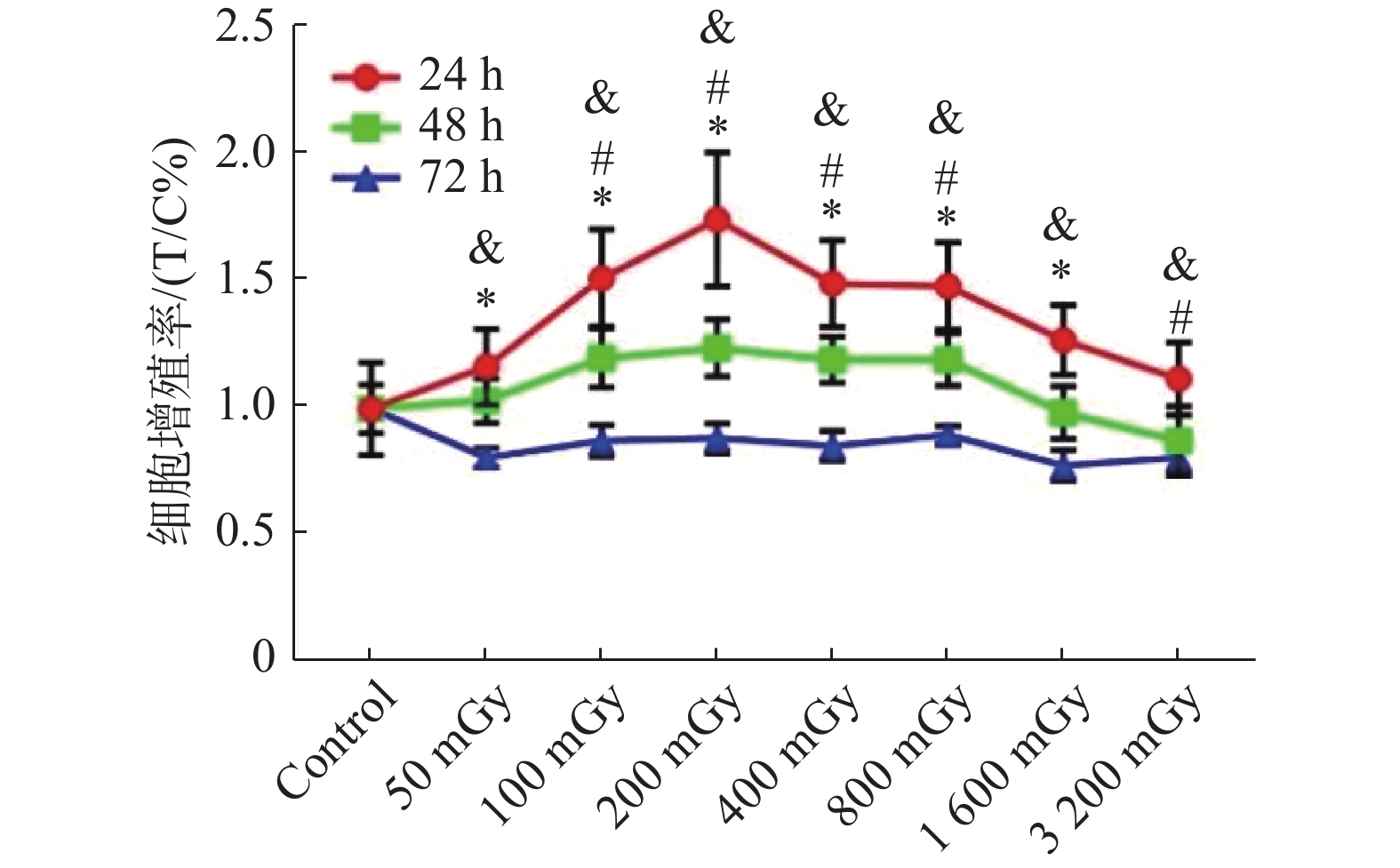
给予单次不同剂量X射线辐照细胞后24 h,与对照组相比,除3200 mGy组外,其它剂量组细胞增殖率均显著升高(P < 0.05)。其中200 mGy组细胞增殖率达到峰值,呈先升后降的趋势。辐照后48 h,与对照组相比,100~800 mGy剂量组的细胞增殖率均显著升高(P < 0.05)。辐照后72 h,与对照组相比,各剂量组的细胞增殖率均显著降低(P < 0.05)。根据单次辐照细胞MTT结果,选择 ≤ 200 mGy的LDIR作为分次辐照剂量。见图1。
|
图 1 MTT法检测单次辐照EA.hy926细胞后24、48和72 h细胞增殖率 Figure 1 Cell proliferation rate at 24, 48, and 72 h after single irradiation of EA.hy926 cells by MTT assay 注:* 辐照后24 h,与对照组相比,P < 0.05;# 辐照后48 h,与对照组相比,P < 0.05;& 辐照后72 h,与对照组相比,P < 0.05。 |
结果显示,4次LDIR辐照结束后24、48和72 h,与对照组相比,各剂量组EA.hy926细胞均出现细胞核面积增大,细胞边缘模糊。4次LDIR辐照结束后24、48和72 h,各剂量组细胞SA-β-gal染色阳性面积均显著增加(P < 0.05)。见图2。

|
图 2 分次LDIR辐照EA.hy926细胞后24、48和72 h的SA-β-gal染色 Figure 2 SA-β-gal staining at 24, 48, and 72 h after fractionated LDIR of EA.hy926 cells 注:与对照组相比,**P < 0.01,***P < 0.001,****P < 0.0001。 |
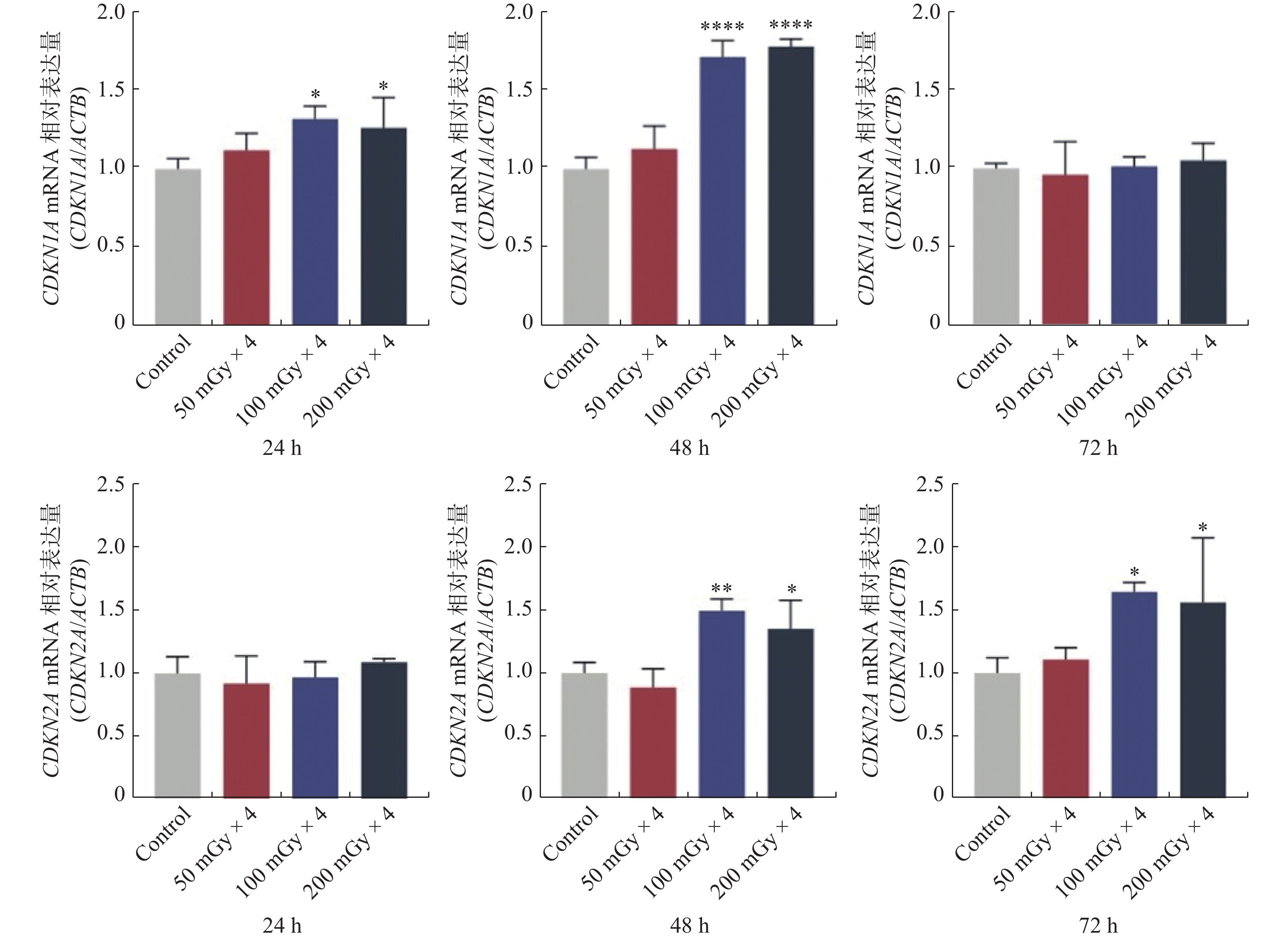
4次LDIR辐照结束后24 h,与对照组相比,100 mGy组和200 mGy组细胞CDKN1A基因mRNA水平均显著升高(P < 0.05)。4次LDIR辐照结束后48 h,与对照组相比,100 mGy组和200 mGy组细胞CDKN1A基因和CDKN2A基因mRNA表达水平均显著升高(P < 0.05)。4次LDIR辐照结束后72 h,与对照组相比,100 mGy组和200 mGy组细胞CDKN2A基因mRNA表达水平均显著升高(P < 0.05)。见图3。
|
图 3 分次LDIR辐照EA.hy926细胞后24、48、72h的CDKN1A和CDKN2A基因mRNA水平 Figure 3 CDKN1A and CDKN2A mRNA levels at 24, 48, and 72 h after fractionated LDIR of EA.hy926 cells 注:与对照组相比,*P < 0.05,**P < 0.01,****P < 0.0001。 |
4次LDIR辐照结束后24 h,与对照组相比,各剂量组细胞ROS荧光强度均显著升高(P < 0.05),100 mGy和200 mGy组细胞T-AOC水平均显著升高(P < 0.05)。4次LDIR辐照结束后48和72 h,与对照组相比,各剂量组细胞ROS荧光强度和T-AOC水平均显著升高(P < 0.05)。见图4。

|
图 4 分次LDIR辐照EA.hy926细胞后24、48和72h的氧化-抗氧化水平 Figure 4 Oxidation-antioxidation levels at 24, 48, and 72 h after fractionated LDIR of EA.hy926 cells 注:分次LDIR辐照EA.hy926细胞后24、48和72 h ,A. 细胞ROS免疫荧光染色;B. 细胞ROS荧光强度水平;C. 细胞T-AOC水平。与对照组相比,*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001。 |
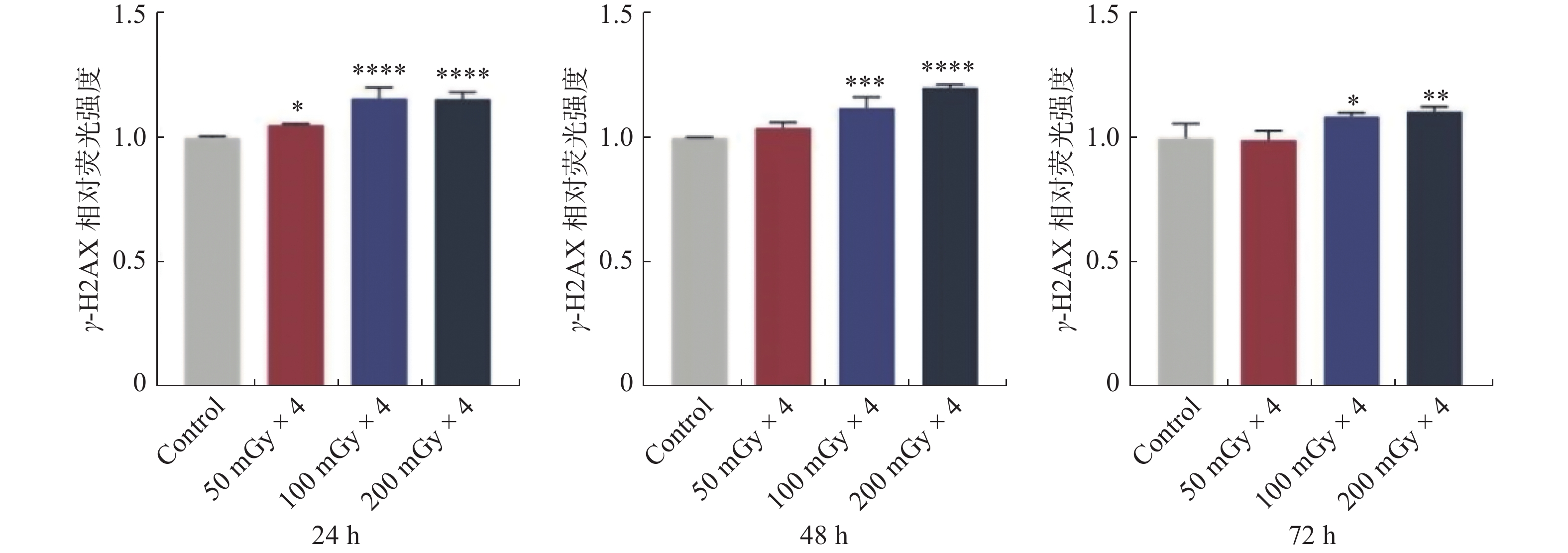
4次LDIR辐照结束后24 h,与对照组相比,各剂量组细胞γ-H2AX荧光强度均显著增加(P < 0.05)。4次LDIR辐照结束后48和72 h,与对照组相比,50 mGy组细胞γ-H2AX荧光强度恢复至对照水平(P > 0.05),100 mGy组和200 mGy组细胞γ-H2AX荧光强度仍显著增加(P < 0.05)。见图5。
|
图 5 分次LDIR辐照EA.hy926细胞后24、48和72 h的γ-H2AX荧光强度 Figure 5 γ-H2AX fluorescence intensity at 24, 48, and 72 h after fractionated LDIR of EA.hy926 cells 注:与对照组相比,*P < 0.05,***P < 0.001,****P < 0.0001。 |
电离辐射可通过直接损伤细胞生物分子(如DNA、蛋白质和脂质)或间接通过氧化应激引起ECs发生细胞凋亡和衰老等 [20-21]。本研究结果表明,X射线单次辐照后24、48和72 h,EA.hy926细胞增殖率呈先升后降的趋势。提示随着辐照剂量和辐射后观察时间的增加,ECs增殖受到一定程度的抑制。Cervelli等[22]研究发现,与对照组相比,单次辐照(0.25 Gy和0.5 Gy)和分次辐照(2 × 0.125 Gy和2 × 0.25 Gy)原代人脐静脉内皮细胞后,细胞增殖率均无显著改变。Schröder等[23]研究也表明,0.1~6 Gy辐射对EA.hy926细胞增殖率无显著影响。上述研究与本研究结果不同的原因可能在于辐照剂量和细胞株种类等不同。
SA-β-gal活性与细胞衰老过程中溶酶体数量和溶酶体活性升高相关,是细胞衰老标志物[24]。本研究发现50、100和200 mGy辐照4次结束后24、48和72 h,EA.hy926细胞SA-β-gal阳性面积均明显增加。这与Wu等[25]给予人脐静脉内皮细胞连续7 d暴露于γ辐射后(累积剂量为0.2 Gy)SA-β-gal阳性细胞数显著增加的研究结果相似。提示分次LDIR可诱导EA.hy926细胞的SA-β-gal活性增加,其中100 mGy和200 mGy效应更明显。
衰老细胞的一个显著特征是细胞周期阻滞,其信号传导主要依靠细胞周期蛋白依赖性激酶抑制剂表达水平的增加[26]。其中衰老相关细胞周期蛋白依赖性激酶抑制剂p21和p16是p53和RB调控肿瘤抑制途径的重要组份[17]。本研究结果表明,4次LDIR后24、48和72 h,各剂量组CDKN1A (p21) 和CDKN2A (p16) 基因mRNA水平呈不同程度升高。Azimzadeh等[27]用8 Gy X射线局部照射小鼠心脏后,在微血管内皮细胞中发现p21和p16蛋白表达水平均增加。提示分次LDIR可诱导EA.hy926细胞出现与单次高剂量辐射相似的细胞衰老,可能与p53/p21和p16信号通路激活引起衰老相关细胞周期阻滞有关。
研究表明,电离辐射诱导细胞衰老可能与氧化应激相关[20]。电离辐射通过诱导过量ROS产生和累积导致ECs氧化损伤,同时,过量的ROS可激活抗氧化系统从而维持细胞内氧化-抗氧化系统平衡[28]。本研究发现,4次LDIR后24、48和72 h,各剂量组ROS水平和T-AOC水平呈不同程度升高。提示100 mGy和200 mGy辐照4次后24 h即可诱导大量ROS产生,随着辐射剂量和辐射后观察时间增加,细胞内ROS逐渐累积,氧化-还原稳态失衡引起氧化应激[29]。刘萌萌等[30]分别采用187.5、375和750 mGy X射线对EA.hy926细胞进行辐照(剂量率为1.79 mGy/s),辐照后24 h细胞内ROS水平均显著升高。这与本研究结果相似。本研究还发现,4次LDIR后24、48和72 h,细胞内T-AOC与ROS水平均同步升高,可能由于细胞为维持氧化-还原稳态激活了抗氧化体系包括抗氧化酶(如超氧化物歧化酶、过氧化氢酶等)和非酶抗氧化剂(如维生素C、维生素E等)等[31]。
电离辐射可导致DNA双链断裂,使组蛋白H2AX迅速在双链断裂处磷酸化为γ-H2AX,同时募集多种DNA损伤修复分子形成修复灶,共同参与修复早期DNA损伤[32]。本研究发现,与对照组相比,4次LDIR后24 h,50 mGy × 4组细胞γ-H2AX荧光强度显著增强,4次LDIR后48和72 h,细胞γ-H2AX荧光强度即恢复至对照水平。本研究与Cervelli等[22]研究结果类似,LDIR原代人脐静脉内皮细胞后24 h,无论单次辐照(0.250 Gy)或分次辐照(2 × 0.125 Gy),γ-H2AX阳性细胞数均显著升高,且随观察时间增加逐渐恢复至对照水平。4次LDIR后24、48和72 h,100 mGy × 4组和200 mGy × 4组细胞γ-H2AX荧光强度均显著增加。提示50 mGy辐照4次后,细胞DNA损伤水平较低且可早期修复,100 mGy和200 mGy辐照4次后,细胞DNA损伤水平较高且持续存在。
综上所述,分次LDIR可诱导EA.hy926细胞衰老,可能与DNA损伤和氧化应激水平有关。不同剂量的LDIR分次辐照以及辐照后观察时间对EA.hy926细胞衰老、氧化-抗氧化及氧化损伤水平的影响不同。后续将深入探讨LDIR诱导ECs衰老的相关信号通路机制,为LDIR对心血管疾病作用机制研究提供新的方向及重要线索。
| [1] |
United Nations Scientific Committee on the Effects of Atomic Radiation. Report of the United Nations Scientific Committee on the Effects of Atomic Radiation (UNSCEAR) 2010[M]. United Nations, 2010.
|
| [2] |
Tapio S, Little MP, Kaiser JC, et al. Ionizing radiation-induced circulatory and metabolic diseases[J]. Environ Int, 2021, 146: 106235. DOI:10.1016/j.envint.2020.106235 |
| [3] |
陈湃韩, 陈慧峰, 邹剑明. 低剂量电离辐射长期接触健康效应研究进展[J]. 中国辐射卫生, 2022, 31(1): 99-104. Chen PH, Chen HF, Zou JM. Research progress in health effects of long-term exposure to low-dose ionizing radiation[J]. Chin J Radiol Health, 2022, 31(1): 99-104. DOI:10.13491/j.issn.1004-714X.2022.01.018 |
| [4] |
Saba L, Antignani PL, Gupta A, et al. International Union of Angiology (IUA) consensus paper on imaging strategies in atherosclerotic carotid artery imaging: From basic strategies to advanced approaches[J]. Atherosclerosis, 2022, 354: 23-40. DOI:10.1016/j.atherosclerosis.2022.06.1014 |
| [5] |
Roth GA, Mensah GA, Johnson CO, et al. Global burden of cardiovascular diseases and risk factors, 1990-2019: Update from the GBD 2019 study[J]. J Am Coll Cardiol, 2020, 76(25): 2982-3021. DOI:10.1016/j.jacc.2020.11.010 |
| [6] |
Shimizu Y, Kodama K, Nishi N, et al. Radiation exposure and circulatory disease risk: Hiroshima and Nagasaki atomic bomb survivor data, 1950-2003[J]. BMJ, 2010, 340: b5349. DOI:10.1136/bmj.b5349 |
| [7] |
Stewart FA, Akleyev AV, Hauer-Jensen M, et al. ICRP publication 118: ICRP statement on tissue reactions and early and late effects of radiation in normal tissues and organs-threshold doses for tissue reactions in a radiation protection context[J]. Ann ICRP, 2012, 41(1/2): 1-322. DOI:10.1016/j.icrp.2012.02.001 |
| [8] |
Mohamad Kamal NS, Safuan S, Shamsuddin S, et al. Aging of the cells: Insight into cellular senescence and detection Methods[J]. Eur J Cell Biol, 2020, 99(6): 151108. DOI:10.1016/j.ejcb.2020.151108 |
| [9] |
Dimri GP, Lee X, Basile G, et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo[J]. Proc Natl Acad Sci U S A, 1995, 92(20): 9363-9367. DOI:10.1073/pnas.92.20.9363 |
| [10] |
Aird WC. Endothelial cell heterogeneity[J]. Cold Spring Harb Perspect Med, 2012, 2(1): a006429. DOI:10.1101/cshperspect.a006429 |
| [11] |
Wang YY, Boerma M, Zhou DH. Ionizing radiation-induced endothelial cell senescence and cardiovascular diseases[J]. Radiat Res, 2016, 186(2): 153-161. DOI:10.1667/RR14445.1 |
| [12] |
赵红玲, 宋曼, 关华, 等. 电离辐射诱导血管内皮细胞衰老的研究进展[J]. 国际放射医学核医学杂志, 2021, 45(6): 396-402. Zhao HL, Song M, Guan H, et al. Research progress on vascular endothelial cell senescence induced by ionizing radiation[J]. Int J Radiat Med Nucl Med, 2021, 45(6): 396-402. DOI:10.3760/cma.j.cn121381-202006045-00067 |
| [13] |
张伟娜, 陈御, 毛志勇. 靶向DNA损伤修复延缓衰老的研究进展[J]. 生物医学转化, 2023, 4(2): 2-12. Zhang WN, Chen Y, Mao ZY. Research progresses in delaying aging by targeting DNA damage repair[J]. Biomed Transform, 2023, 4(2): 2-12. DOI:10.12287/j.issn.2096-8965.20230201 |
| [14] |
Lafargue A, Degorre C, Corre I, et al. Ionizing radiation induces long-term senescence in endothelial cells through mitochondrial respiratory complex II dysfunction and superoxide generation[J]. Free Radic Biol Med, 2017, 108: 750-759. DOI:10.1016/j.freeradbiomed.2017.04.019 |
| [15] |
Jin J, Richardson L, Sheller-Miller S, et al. Oxidative stress induces p38MAPK-dependent senescence in the feto-maternal interface cells[J]. Placenta, 2018, 67: 15-23. DOI:10.1016/j.placenta.2018.05.008 |
| [16] |
Fumagalli M, Rossiello F, Mondello C, et al. Stable cellular senescence is associated with persistent DDR activation[J]. PLoS One, 2014, 9(10): e110969. DOI:10.1371/journal.pone.0110969 |
| [17] |
Di Micco R, Krizhanovsky V, Baker D, et al. Cellular senescence in ageing: from mechanisms to therapeutic opportunities[J]. Nat Rev Mol Cell Biol, 2021, 22(2): 75-95. DOI:10.1038/s41580-020-00314-w |
| [18] |
Yentrapalli R, Azimzadeh O, Barjaktarovic Z, et al. Quantitative proteomic analysis reveals induction of premature senescence in human umbilical vein endothelial cells exposed to chronic low-dose rate gamma radiation[J]. Proteomics, 2013, 13(7): 1096-1107. DOI:10.1002/pmic.201200463 |
| [19] |
Yentrapalli R, Azimzadeh O, Sriharshan A, et al. The PI3K/Akt/mTOR pathway is implicated in the premature senescence of primary human endothelial cells exposed to chronic radiation[J]. PLoS One, 2013, 8(8): e70024. DOI:10.1371/journal.pone.0070024 |
| [20] |
Baselet B, Sonveaux P, Baatout S, et al. Pathological effects of ionizing radiation: endothelial activation and dysfunction[J]. Cell Mol Life Sci, 2019, 76(4): 699-728. DOI:10.1007/s00018-018-2956-z |
| [21] |
田茂叶, 聂红梅, 刘亚, 等. 细胞死亡在辐射防护与放疗增敏中的研究进展[J]. 中国辐射卫生, 2023, 32(2): 216-222. Tian MY, Nie HM, Liu Y, et al. Research progress of cell death in radiation protection and radiosensitization[J]. Chin J Radiol Health, 2023, 32(2): 216-222. DOI:10.13491/j.issn.1004-714X.2023.02.024 |
| [22] |
Cervelli T, Panetta D, Navarra T, et al. Effects of single and fractionated low-dose irradiation on vascular endothelial cells[J]. Atherosclerosis, 2014, 235(2): 510-518. DOI:10.1016/j.atherosclerosis.2014.05.932 |
| [23] |
Schröder S, Broese S, Baake J, et al. Effect of ionizing radiation on human EA. hy926 endothelial cells under inflammatory conditions and their interactions with A549 Tumour cells[J]. J Immunol Res, 2019, 2019: 9645481. DOI:10.1155/2019/9645481 |
| [24] |
Debacq-Chainiaux F, Erusalimsky JD, Campisi J, et al. Protocols to detect senescence-associated beta-galactosidase (SA-βgal) activity, a biomarker of senescent cells in culture and in vivo[J]. Nat Protoc, 2009, 4(12): 1798-1806. DOI:10.1038/nprot.2009.191 |
| [25] |
Wu K, Chen ZJ, Peng Q, et al. Ku86 alleviates human umbilical vein endothelial cellular apoptosis and senescence induced by a low dose of ionizing radiation[J]. J Int Med Res, 2019, 47(2): 893-904. DOI:10.1177/0300060518805302 |
| [26] |
Roger L, Tomas F, Gire V. Mechanisms and regulation of cellular senescence[J]. Int J Mol Sci, 2021, 22(23): 13173. DOI:10.3390/ijms222313173 |
| [27] |
Azimzadeh O, Sievert W, Sarioglu H, et al. Integrative proteomics and targeted transcriptomics analyses in cardiac endothelial cells unravel mechanisms of long-term radiation-induced vascular dysfunction[J]. J Proteome Res, 2015, 14(2): 1203-1219. DOI:10.1021/pr501141b |
| [28] |
王梦迪, 李敏, 曹璐, 等. 心血管内皮细胞放射性损伤机制的研究进展[J]. 心血管病学进展, 2021, 42(2): 101-105. Wang MD, Li M, Cao L, et al. Mechanism of radiation-induced cardiovascular endothelial cell injury[J]. Adv Cardiovasc Dis, 2021, 42(2): 101-105. DOI:10.16806/j.cnki.issn.1004-3934.2021.02.002 |
| [29] |
张宇睿, 徐文清. 电离辐射对线粒体损伤的研究进展[J]. 国际放射医学核医学杂志, 2016, 40(2): 154-158. Zhang YR, Xu WQ. Damages of ionizing radiation on mitochondria[J]. Int J Radiat Med Nucl Med, 2016, 40(2): 154-158. DOI:10.3760/cma.j.issn.1673-4114.2016.02.014 |
| [30] |
刘萌萌, 宋曼, 田梅, 等. 氧化应激和DNA损伤在小剂量电离辐射诱导血管内皮细胞损伤中的作用研究[J]. 中国医学装备, 2023, 20(2): 171-175. Liu MM, Song M, Tian M, et al. Study on the role of oxidative stress and DNA damage in vascular endothelial cell injury induced by low dose ionizing radiation[J]. China Med Equip, 2023, 20(2): 171-175. DOI:10.3969/J.ISSN.1672-8270.2023.02.035 |
| [31] |
Anuranjani, Bala M. Concerted action of Nrf2-ARE pathway, MRN complex, HMGB1 and inflammatory cytokines - implication in modification of radiation damage[J]. Redox Biol, 2014, 2: 832-846. DOI:10.1016/j.redox.2014.02.008 |
| [32] |
刘樱, 熊忠华, 夏斌元, 等. 电离辐射生物标志物γ-H2AX的检测技术研究进展[J]. 生物化学与生物物理进展, 2022, 49(10): 1927-1934. Liu Y, Xiong ZH, Xia BY, et al. Progress in detection of ionizing radiation biomarker γ-H2AX[J]. Prog Biochem Biophys, 2022, 49(10): 1927-1934. DOI:10.16476/j.pibb.2021.0379 |




