2. 解放军总医院第五医学中心, 北京 100071;
3. 中国医学科学院放射医学研究所, 天津 300192
2. Department of Radiation Oncology, Fifth Medical Center of PLA General Hospital, Beijing 100071 China;
3. Institute of Radiation Medicine, Chinese Academy of Medical Sciences, Tianjin 300192 China
随着放射治疗技术的快速发展, 以及放射治疗设备的不断更新迭代,如今放射治疗已进入精准放疗新时代[1]。
立体定向放射治疗作为新型精准放疗技术之一,在临床中得到广泛应用。它是将高辐射剂量一次性精确地共聚到肿瘤靶区,杀死肿瘤细胞,同时减少周围正常组织受照剂量的一种治疗方式,现已广泛应用于脑、肺、肝、脊柱、肾等部位肿瘤的治疗中[2-4]。射波刀是为立体定向放射治疗研发设计的机器人无框架图像引导放射治疗系统。它将一个6 MV的直线加速器安装在6轴机械臂上,通过机械臂驱动加速器进行多向多角度的无死角照射,使它能在追踪目标运动的同时,提供亚毫米精度的非共面聚焦治疗[5-7]。治疗过程中采用实时影像引导及同步呼吸追踪技术来保证治疗的准确性与重复性,并通过上述多套系统相互协调工作,来保证患者靶区的剂量精确性,因此需要更为严格的质量保证(quality assurance,QA)来确保照射的精确性[8-9]。根据AAPM TG-135报告和WS 667—2019标准要求的QA测试,端到端(End-to-End,E2E)测试是通过使用模体,模拟临床上患者所接受的整个治疗过程,来检查整个系统的照射精度。从获取CT影像开始到治疗结束,是一种对机械臂放射治疗装置定位追踪精度的总体测试,旨在使计划剂量与实际照射剂量相匹配[10-11]。肺追踪作为射波刀5种追踪方法之一,适用于无法植入金标的肺部肿瘤患者,通过与脊柱追踪系统和同步呼吸追踪系统的配合使用,来实时追踪肺部肿瘤的运动[12],以确保照射的精确性。目前国内肺追踪 E2E所用检测模体大多产自美国CIRS公司,其价格昂贵,配套插杆功能有限。且基于WS 667—2019《机械臂放射治疗装置质量控制检测规范》的发布实施,将组织等效肺部模体国产化,可以为我国模体自主化提供思路,也为射波刀的质控检测提供设备基础。因此独立研发制作了自制肺部动态模体,在外形与配套功能上进行优化,与国外动态模体进行对比分析,从而验证自制肺部模体用于射波刀检测的可行性。
1 材料与方法 1.1 实验材料 1.1.1 实验设备及软件M6射波刀(美国Accuray公司),S7射波刀(美国Accuray公司),射波刀脊柱XLT胶片(美国Ashland公司),precision治疗计划系统(美国Accuray公司),Multiplan 5.3治疗计划系统(美国Accuray公司),Philips Brilliance CT(荷兰Philips公司),SOMATOM型 CT(德国Siemens公司),V800扫描仪(日本Epson公司)。
1.1.2 动态模体(美国CIRS公司)胸部动态模体由胸部模体和运动电机组成。模体由组织等效材料构成。模体宽30 cm、高20 cm、厚15 cm。左肺部可放入一个长 30 cm、直径6.4 cm的圆柱形插杆,插杆内置模拟肿瘤的球方,用于E2E测试。CIRS动态模体外观见图1。

|
图 1 CIRS动态模体外观图 Figure 1 External view of CIRS dynamic phantom |
自制肺部模体由肺部模体和运动仿真控制系统组成。肺部模体是具有骨骼、软组织、肺部器官的仿真人体模型,外形如图2A所示。其外形尺寸为长41 cm,宽15 cm,高23 cm,是基于大量我国成年人的体型数据确定的,具有代表性[13]。模体由组织等效材料建模灌注成型,软组织主要选取环氧树脂材料,肺部等效材料使用的是醋酸-醋酸乙烯酯共聚物 (EVA28)与酚醛树脂混合制作,骨骼选用EVA40,上述材料的组织等效性已经得到验证[14-15],由上述材料制作而成的仿真人体模型可以有效模拟人体对射线的散射和吸收,因此该仿真人体模型可替代人体作为射线稳定受体,用于放射治疗设备的质控工作。

|
图 2 自制肺部模体及其配套E2E插杆 Figure 2 Homemade lung phantom and its accompanying E2E rod 注:A.自制肺部模体主视图 ;B.自制等效肺部插杆俯视图 ;C.运动仿真控制系统控制器。 |
在自制肺部模体中,左肺部预留直径6.4 cm的圆形插孔,适配于自制圆柱形插杆。插杆的材料与模体肺部材料相同,同为肺组织等效材料。为了便于开展后续工作,为自主研发的肺部模体配备了E2E验证插杆、胶片验证插杆和电离室插杆3种不同功能用途的插杆。本文主要基于E2E验证插杆展开工作。E2E验证插杆长31 cm,直径6.4 cm,内嵌总长4.4 cm × 4.4 cm的球方,球方由4块拼接而成,材质与插杆相同,完整的球方内包含一个直径2.5 mm的有机玻璃小球作为肿瘤标志物,球方内可放置肺追踪E2E测量所需的专用EBT3胶片。E2E验证插杆外形如图2B所示。
动态仿真系统控制器外观见图2C,采用双轴电机,在支持水平往复运动的同时,通过连轴模拟腹式呼吸的上下运动,可以采用手动控制和软件控制两种方式来运行, 模拟呼吸周期最高可达30 次/min,呼吸幅度0~30 mm,头脚(I/S)方向运动进程0~50 mm可调。软件支持设置循环次数、设定手控模式下的参数、实时显示模体位移随时间变化的运动曲线、操控插杆回原点等功能,运行界面如图3所示。
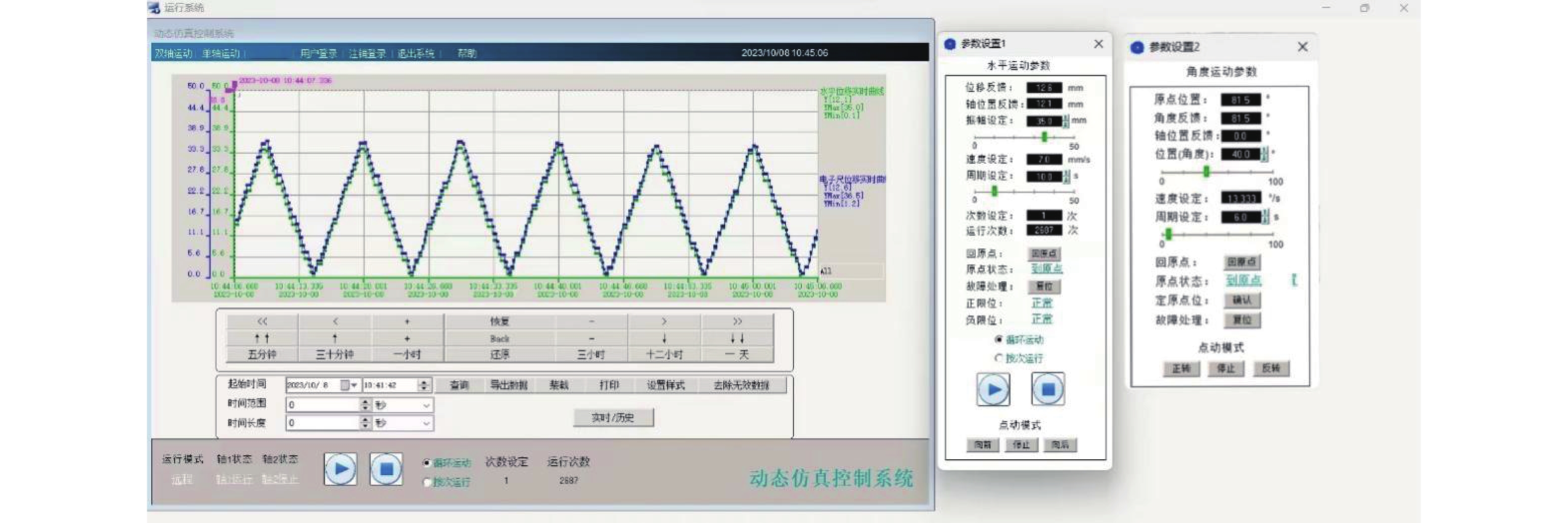
|
图 3 动态控制系统运行界面 Figure 3 Operation interface of dynamic control system |
将XLT胶片按所标记的方向放入球方中,将装好球方的插杆置于自制肺部模体的空腔中,确保球方的上下表面始终与治疗床表面平行,进而连接好动态测控系统。将组装好的动态模体置于CT床板上,如图4所示,设置扫描条件为管电压120 kV,管电流300 mAs,1 mm层厚,FOV600 mm,无间隔、螺旋扫描,进行CT平扫,将获得图像分别导入precision和Multiplan 5.3治疗计划系统。CIRS动态模体获取CT图像的方法和步骤,与自制肺部模体相同。
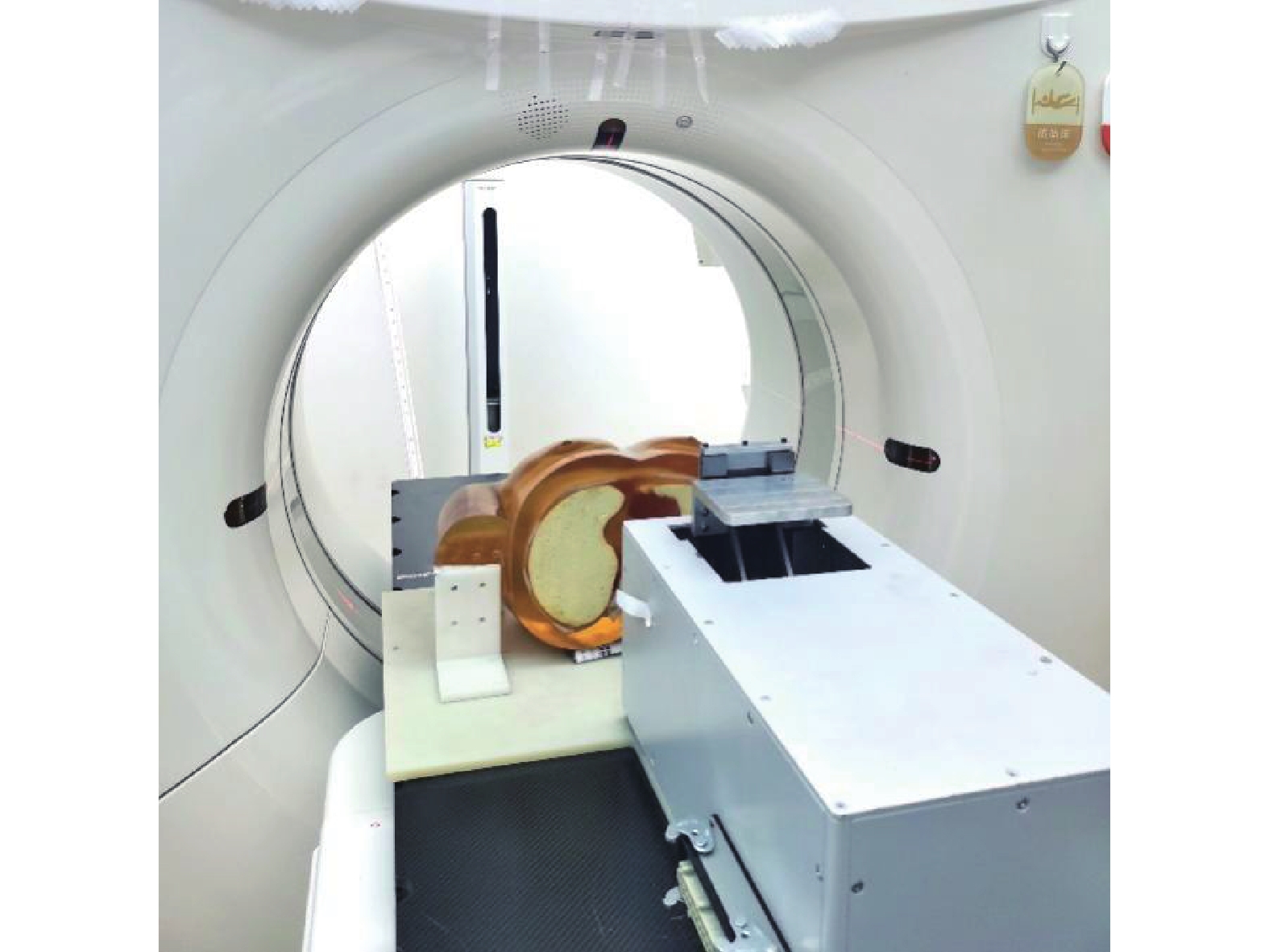
|
图 4 自制肺部模体CT定位图 Figure 4 CT positioning of the homemade lung phantom |
基于获得的模体CT图像新建一个E2E计划,对模拟肿瘤标志物进行勾画,并作为靶区。选用等中心、肺追踪的方式,选用15 mm准直器,给予靶区600 cGy剂量,所使用的XLT胶片为EBT免洗胶片,规定70%等中心线为420 cGy,精算完成后将其保存为可执行计划。
1.2.3 执行肺追踪E2E验证计划将模体连接好后按CT定位时的状态放置于治疗床上,借助激光灯辅助摆位,在运动平台上贴好红外光学标志(Mark)点,以便同步呼吸系统追踪识别。连接网络,在配套软件上设置呼吸频率为10 s/次,模拟正常成年人的呼吸起伏,运动进程35 mm,设备准备工作完成,如图5所示。在治疗系统上调取肺追踪E2E计划,首先使用脊柱追踪方法调整模体进行定位,继而用肺追踪调整靶区,最后联合同步追踪方法在治疗过程中追踪靶区,实施照射。
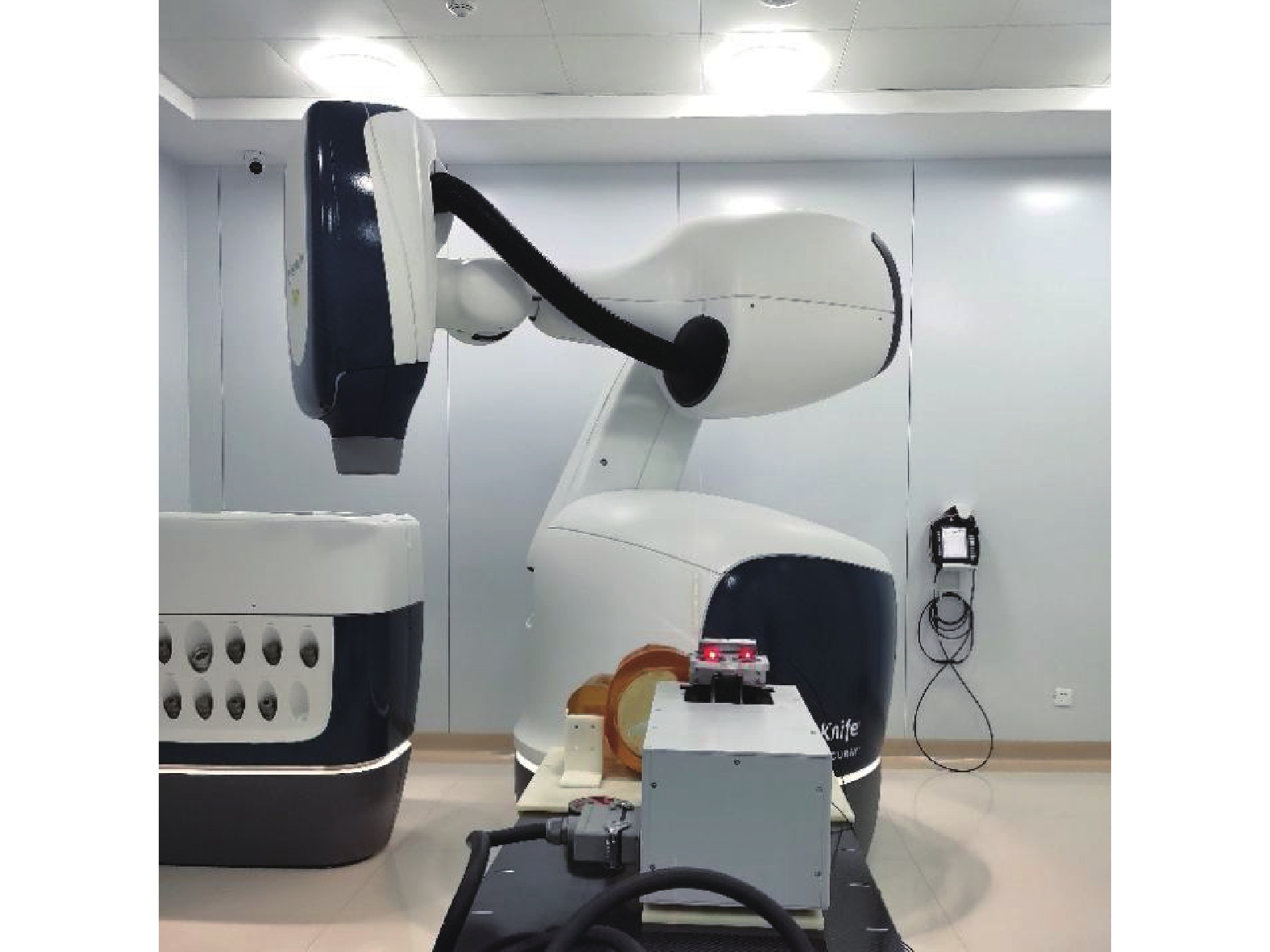
|
图 5 自制肺部模体摆位示意图 Figure 5 Positioning of the homemade lung phantom |
从模拟肿瘤的球方中取出胶片,连同本底胶片放入已校准的Epson V800胶片扫描仪中,设置扫描参数:分辨率300 dpi,图像类型48位全彩,高扫描质量,将所得图像另存为TIFF格式。使用E2E分析软件分析胶片,选择胶片类型为EBT Film,Standard E2E模式,X、Y轴方向的影像分辨率均设置为300 dpi pixels/inch、根据实际需要调整两张胶片的方向、执行软件分析,获得E2E检测结果。
1.2.5 E2E结果分析E2E属于面剂量分析,实际为曝光胶片受照剂量的质心分布与计划的剂量分布作比较,即测量70%等剂量线所包绕受照区域的中心位置,与模拟肿瘤的球体中心位置的差值[11, 16],因此E2E检测总偏差为三维每个方向上误差的算术平方根,见公式(1)。
| $ \begin{gathered} Total\;Error = \\ \sqrt{{(left\;error)}^{2} + ({superior\;error)}^{2} + {(anterior\;error)}^{2}} \end{gathered} $ | (1) |
使用SPSS27.0统计学分析软件对结果进行统计处理,对两种模体在不同型号射波刀上所得的肺追踪 E2E检测结果进行两独立样本t检验。检验水准α = 0.05
2 结 果在相同检测条件下,两种模体在使用MLC的S7代射波刀的肺追踪E2E检测各轴向偏差结果以及总偏差见表1,在使用Iris准直器的M6代射波刀下检测结果见表2。
|
|
表 1 两种模体在S7射波刀下肺追踪E2E检测结果 Table 1 E2E testing results of lung tracking under S7 Cyberknife using two types of phantoms |
|
|
表 2 两种模体在M6射波刀下肺追踪E2E检测结果 Table 2 E2E testing results of lung tracking under M6 Cyberknife using two types of phantoms |
从表中可见,两种模体检测的总偏差绝对值均小于1.5 mm,符合AAPMTG-135和WS 667—2019标准要求的偏差值。
经对4种结果分析得表3,在两代射波刀的检测下,两种模体的检测结果符合方差齐性(sig = 0.209、0.934、0.388、0.056、0.294、0.056、0.262、0.377,均 > 0.05)的条件,因此使用两独立样本t检验分析,得到结果:在M6代射波刀下,使用自制肺部模体与CIRS模体进行肺追踪E2E检测的结果在X轴、Y轴、Z轴、总偏差上均无统计学差异(P = 0.880、0.891、0.573、0.433,均 > 0.05),在S7代射波刀下,使用自制肺部模体与CIRS模体的检测结果也无统计学差异(P = 0.236、0.175、0.289、0.668,均 > 0.05)。
|
|
表 3 两种模体在M6与S7射波刀下肺追踪 E2E检测结果的独立样本t检验结果 Table 3 Independent sample t-test of E2E testing results of lung tracking using two types of phantoms under M6 and S7 Cyberknife |
在计划设计过程中,按照射波刀物理学操作手册给出的建议,结合实际的模体扫描情况,选取肺追踪E2E测试所需的准直器、靶区剂量及追踪算法,将脊柱配准框定位在椎体中心,避免因脊柱配准框选取不当而导致的在实施治疗时图像引导系统无法准确识别追踪脊柱锥体造成的干扰;CT扫描及摆位照射时分别将两套模体置于床板同一位置,执行相同条件下的检测;研究发现射波刀靶区追踪的总精度会随着治疗床六轴修正值的增大而增大[18],因此在摆位时,两种模体的测试都将3个平移方向的修正值控制在0.3 mm以内,3个旋转方向的修正值把握在0.3°、0.3°、1°以内,减少修正值带来的误差;建立运动模型需要在模体运动平台粘贴至少两个Mark点,测试中的Mark点粘贴牢固,避免了光纤在运动过程中与平台碰撞导致标识点脱落的情况;在胶片扫描时统一人为规定了3张胶片间距离为1.5 cm、胶片标识字母朝上、均平行于扫描轴线,同时在处理过程中保持胶片表面的整洁,尽可能的减少了因胶片扫描而带来的误差。
自制肺部模体与国外CIRS模体在肺追踪的E2E实验中,所得结果具有一致性,AAPM TG135和WS 667—2019没有对三维方向上的偏差绝对值做出要求,但一般动态追踪模式下,各轴向的偏差绝对值要求均小于0.866 mm[11],在本研究中, 在M6射波刀检测下的自制模体第3组X轴向偏差、第4组和第5组Z轴偏差以及CIRS模体的第5组X轴偏差均超过0.866,考虑是在胶片放置过程中没有完全贴合放置于球方正中心,从而引起的误差。
自制肺部模体在外形上更贴近于国人身形,选用等效材料更真实的模拟人体与射线的作用过程,制作成本低;配套软件页面简洁、好操作,支持数据的查询与导出;模体配套多个功能插杆,在后续工作中可以使用其他插杆进一步对肺追踪模式下病人的剂量分布或点剂量进行验证,更全面地验证分析自制肺部模体用于射波刀质控工作中的可行性。但自制模体配套电机箱体积稍显庞大,因此考虑在后续的优化中缩小电机箱体积,使其更有利于搬运。
综上所述,自制肺部模体在肺追踪的E2E实验中,所得结果与国外CIRS模体相比,差异无统计学意义,可以达到与CIRS模体相同的照射精度,满足AAPM TG-135报告和WS 667—2019标准中的要求,具有用于射波刀临床质控的可行性,自制肺部模体的独立研发制作,也为射波刀检测工作提供了国产质控设备的选择,为放射治疗设备的质控工作提供新视角。
| [1] |
潘锋. 精准放疗是肿瘤核心治疗的重要手段之一[J]. 中国当代医药, 2022, 29(8): 1-6. DOI: 10.3969/j.issn.1674-4721.2022.08.002. Pan F. Precision radiotherapy is one of the important means of core tumor treatment[J] China Mod Med, 2022, 29(8): 1-6. DOI: 10.3969/j.issn.1674-4721.2022.08.002 |
| [2] |
Koksal C, Akbas U, Kesen ND, et al. Patient-specific quality assurance for intracranial cases in robotic radiosurgery system[J]. J Buon, 2018, 23(1): 179-184. |
| [3] |
Alhujaili SF, Biasi G, Alzorkany F, et al. Quality assurance of Cyberknife robotic stereotactic radiosurgery using an angularly independent silicon detector[J]. J Appl Clin Med Phys, 2019, 20(1): 76-88. DOI:10.1002/acm2.12496 |
| [4] |
Chandra RA, Keane FK, Voncken FEM, et al. Contemporary radiotherapy: present and future[J]. Lancet, 2021, 398(10295): 171-184. DOI:10.1016/S0140-6736(21)00233-6 |
| [5] |
Bellec J, Delaby N, Jouyaux F, et al. Plan delivery quality assurance for CyberKnife: statistical process control analysis of 350 film-based patient-specific QAs[J]. Phys Med, 2017, 39: 50-58. DOI:10.1016/j.ejmp.2017.06.016 |
| [6] |
段学章, 何卫平, 李文刚. 射波刀肿瘤治疗新技术[M]. 北京: 科学出版社, 2019: 6-8. Duan XJ, He WP, Li WG. New technique for Cybernife cancer treatment[M]. Beijing: Science Press, 2019: 6-8. |
| [7] |
杨雨泽, 李明生, 刘辉, 等. 自制AQA模体应用于射波刀质控的可行性分析[J]. 中国辐射卫生, 2022, 31(6): 645-650. DOI: 10.13491/j.issn.1004-714X.2022.06.001. Yang YZ, Li MS, Liu H, et al. Feasibility analysis of home-made AQA phantom applied for Cyberknife quality control[J] Chin J Radiol Health, 2022, 31(6): 645-650. DOI: 10.13491/j.issn.1004-714X.2022.06.001. |
| [8] |
徐慧军, 李玉, 张素静, 等. G4射波刀两年质量保证检测结果的回顾与评价[J]. 中国医学物理学杂志, 2013, 30(3): 4097-4099. Xu HJ, Li Y, Zhang SJ, et al. Review and evaluation on the results of quality assurance test for the 4th generation CyberKnife in two years[J]. Chin J Med Phys, 2013, 30(3): 4097-4099. DOI:10.3969/j.issn.1005-202X.2013.03.002 |
| [9] |
景生华, 李兵, 周正东, 等. 射波刀Synchrony同步追踪系统三维方向质量保证分析[J]. 医疗卫生装备, 2018, 39(1): 58-61. Jing SH, Li B, Zhou ZD, et al. Analysis on quality assurance of Cyberknife Synchrony in 3D direction[J]. Chin Med Equip J, 2018, 39(1): 58-61. DOI:10.7687/j.issn1003-8868.2018.01.058 |
| [10] |
中华人民共和国国家卫生健康委员会. WS 667—2019 机械臂放射治疗装置质量控制检测规范[S]. 北京: 中国标准出版社, 2019. National Health Commission of the People's Republic of China. WS 667—2019 Specification for testing of quality control in robotic arm radiotherapy device[S]. Beijing: Standards Press of China, 2019. |
| [11] |
王琳, 张建平, 徐本华, 等. VSI型射波刀质量保证及剂量学数据特征的单中心研究[J]. 中国医学物理学杂志, 2018, 35(12): 1392-1398. Wang L, Zhang JP, Xu BH, et al. Single center study of clinical dosimetry data characteristics and quality assurance of VSI Cyberknife[J]. Chin J Med Phys, 2018, 35(12): 1392-1398. DOI:10.3969/j.issn.1005-202X.2018.12.005 |
| [12] |
张火俊, 居小萍. 射波刀精准放疗[M]. 上海: 第二军医大学出版社, 2016: 24-25. Zhang HJ, Ju XP. Precision radiotherapy of Cyberknife[M]. Shanghai: Second Military Medical University Press, 2016: 24-25. |
| [13] |
蔡敏芹, 林大全, 郭祚达, 等. 中国人辐照仿真人体模型及人体器官数学模型[J]. 中国医学影像技术, 2005, 21(9): 1464-1467. Cai MQ, Lin DQ, Guo ZD, et al. China radiation anthropomorphic phantom and mathematical models of human body organs[J]. Chin J Med Imaging Technol, 2005, 21(9): 1464-1467. DOI:10.3321/j.issn:1003-3289.2005.09.046 |
| [14] |
刘刚, 樊庆文, 林大全, 等. 基于CT值的组织辐射等效材料设计方法[J]. 中外医学研究, 2013, 11(3): 5-7. Liu G, Fan WQ, Lin DQ, et al. Design method based on the CT number for the radiation tissue-equivalent materials[J]. Chin For Med Res, 2013, 11(3): 5-7. DOI:10.14033/j.cnki.cfmr.2013.03.003 |
| [15] |
蒋伟, 林大全, 樊庆文, 等. 成都剂量体模(CDP)组织等效材料辐射等效性评价[J]. 中国测试技术, 2006, 32(6): 69-71,140. Jiang W, Lin DQ, Fan QW, et al. Evaluation of irradiation equivalence of tissue-equivalent materials in Chengdu Dosimetric Phantom (CDP)[J]. China Measure Technol, 2006, 32(6): 69-71,140. DOI:10.3969/j.issn.1674-5124.2006.06.022 |
| [16] |
孙磊. G3系列射波刀治疗特点的初步研究[D]. 北京: 清华大学, 2010. Sun L. The first stage study of G3 cyberknife treatment feature[D]. Beijing: Tsinghua University, 2010. |
| [17] |
Dieterich S, Cavedon C, Chuang CF, et al. Report of AAPM TG 135: quality assurance for robotic radiosurgery[J]. Med Phys, 2011, 38(6Part1): 2914-2936. DOI:10.1118/1.3579139 |
| [18] |
王涛, 沈君姝, 周含, 等. 射波刀治疗床修正值对六维颅骨追踪总体精度的影响[J]. 医疗卫生装备, 2015, 36(6): 92-94. Wang T, Shen JS, Zhou H, et al. Relationship between CyberKnife couch correction and tracking accuracy of 6D Skull[J]. Chin Med Equip J, 2015, 36(6): 92-94. DOI:10.7687/J.ISSN1003-8868.2015.06.092 |




