2. 中国科学院合肥肿瘤医院, 安徽 合肥 230000;
3. 安徽医科大学第一附属医院, 安徽 合肥 230000;
4. 安徽省公共卫生临床中心, 安徽 合肥 230000
2. Hefei Cancer Hospital, Chinese Academy of Sciences, Hefei 230000 China;
3. The First Affiliated Hospital of Anhui Medical University, Hefei 230000 China;
4. Anhui Public Health Clinical Center, Hefei 230000 China
基于近些年来容积旋转调强放射治疗(VMAT)技术和立体定向放射治疗(SBRT)技术的迅猛发展,大多数不适合手术或局部晚期肝细胞癌(HCC)患者在精准放疗方面取得良好的治疗效果[1]。SBRT具有精准性和高剂量性,边缘剂量跌落快,可减少周围正常肝组织的照射剂量,保护正常肝组织[2]。肝脏放射敏感性相对较高,受累正常肝组织经射线辐射后易产生放射性肝损伤(RILD),一经产生即随时间延续性发展,诱发大部分患者产生晚期放射性肝纤维化损伤和肝功能衰竭,产生不可逆转的致命性危害[3-4]。RILD不仅阻碍了HCC放疗中SBRT的剂量递增,而且降低了患者的放疗效果,因此避免RILD发生是临床上HCC放射治疗亟需解决的问题[5-6]。RILD患者病理特征在临床上已经得到了详细描述,但是目前放射性肝损伤的生理致病机制尚不清楚,临床上缺乏针对RILD有效治疗方法。RILD分子致病机制和防护策略研究成为了肝脏放射治疗的热点问题,合适的RILD动物模型的构建对于探索RILD生理病理机制具有重大意义。
放射性肝损伤的动物模型的研究对象主要是家兔、家猪、SD大鼠、wistar大鼠和小鼠,科研人员通过构建这些动物模型去观察肝内细胞因子及相关信号通路的变化。目前基于直线加速器辐射的RILD大鼠模型的构建已趋于成熟,但是相对于大鼠而言,C57BL/6J鼠已完成全基因组测序,它的99%的基因能在人类基因组中找到同源基因,这一清晰基因学特征使其在RILD单细胞测序和机理研究中炙手可热。由于小鼠个体较小,肝脏距离小肠较近,肠组织比肝组织辐射敏感性较高,传统的三维适形及普放技术不易控制小肠所受辐射量,小鼠易产生放射性肠炎短期内死亡,导致RILD模型构建失败。为保证小鼠产生RILD,并且在后续实验过程中持续存活,构建一个基于直线加速器SBRT技术的小鼠精准放疗RILD模型是及其必要的,且在直线加速器下辐射诱发小鼠RILD的确切剂量也需定义。胡宗涛等[7]使用热释光检测器(TLD)对直线加速器精确放疗下的小鼠肝脏照射部位进行了剂量检测,发现小鼠肝脏内TLD实测剂量与处方剂量偏差为-1.5%~6%,认为在直线加速器下构建小动物精准放疗模型是可行的。直线加速器下容积旋转调强放射治疗(VMAT)技术能够在照射野内形成多个照射靶区,可以在一个照射范围内完成多个病灶的照射和治疗,即可以一次性精准照射多只小鼠来构建小鼠精准放疗疾病模型[8]。本次研究的目的是在直线加速器中单次大剂量下同时精准照射5只小鼠肝脏,构建存活且稳定可靠的C57BL/6J鼠的RILD模型,为进一步探寻RILD的分子致病机制提供理论依据。
1 材料与方法 1.1 实验材料和设备Masson三色染色试剂盒(北京索莱宝科技有限公司)、苏木素伊红(HE)染色试剂盒(北京索莱宝科技有限公司)、组织包埋盒和粘附载玻片(江苏世泰实验器材有限公司)、医科达直线加速器(医科达公司)、CT模拟定位机(飞利浦公司)、放射治疗计划系统(MONACO5.11.03)、自动组织脱水机,组织包埋机、病理组织漂烘仪以及石蜡切片机(德国莱卡公司)。
1.2 动物及饲养方法C57BL/6J雄鼠90只(6~8周 龄),购自南京集萃药康公司,所有小鼠在无特定病原体环境(SPF级)中饲养,自由进水,标准喂养,12 h昼夜环境。所有实验流程均按照中国科学院合肥肿瘤医院医学伦理委员会批准处理(批准号:DW-LL2022-001)。
1.3 RILD模型构建将90只小鼠分为对照组、20、25、30和35 Gy辐射组,剂量率为600 cGy/min。30 Gy和35 Gy辐射组各为5只,20 Gy和25 Gy辐射组各为25只,其余对照组为30只,对照组除不给予辐射外,其余均与辐射处理组进行同样处理。将每5只小鼠为一组,对小鼠分别进行麻醉、固定、并在最小1 mm层厚下CT扫描定位,在小鼠肝脏右上叶部位,勾画直径为0.4 cm,高度为0.5 cm的靶区和小肠危及器官,给予相应肝脏靶区进行360°弧的VMAT计划设计(单次处方剂量为20、25、30及35 Gy)。其中计算网格为1 mm,子野宽度为0.5 mm, 计算不确定度0.7%,其放疗剂量示意图及剂量体积直方图(DVH图)如图1、图2所示。计划完成后,医生按照要求100%的等剂量曲线包绕95%的PTV体积的要求进行评估,并执行照射。

|
图 1 小鼠放疗剂量示意图 Figure 1 Schematic diagram of radiotherapy doses in mice 注:PTV:肝脏右上叶靶区(红色线);小肠(绿色线)。 |

|
图 2 剂量体积直方图(DVH图) Figure 2 Dose-volume histogram |
辐射完成后,每日记录小鼠体重变化,观测小鼠的饮食及活动情况。辐射4周后,通过眼眶采血收集20 Gy和25 Gy辐射组小鼠血清,检测丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)的血清肝功能指标变化。处死20 Gy和25 Gy辐射组小鼠各20只,称量小鼠全部肝脏重量,计算小鼠肝脏体重比。取肝脏组织进行病理检测,评定小鼠肝脏病理变化,并进行病理评分。于辐射36周后,各取5只20 Gy和25 Gy辐射组小鼠肝脏组织进行HE染色及Masson染色病理学检测,观察其病理组织学变化。
通过小鼠体重、血清变化、小鼠肝脏的器官比及病理变化综合评定小鼠放射性肝损伤模型的建立是否成功。
2 结 果 2.1 30 Gy处方剂量和35 Gy处方剂量不适宜构建RILD模型30 Gy和35 Gy辐射组小鼠存活曲线如图3所示,从图中可见,35 Gy辐射组小鼠12 d内全部死亡,30 Gy辐射组小鼠短期内存在极高死亡现象。综上所述,单次处方剂量为30 Gy和35 Gy时,不适宜构建存活稳定的小鼠RILD模型。
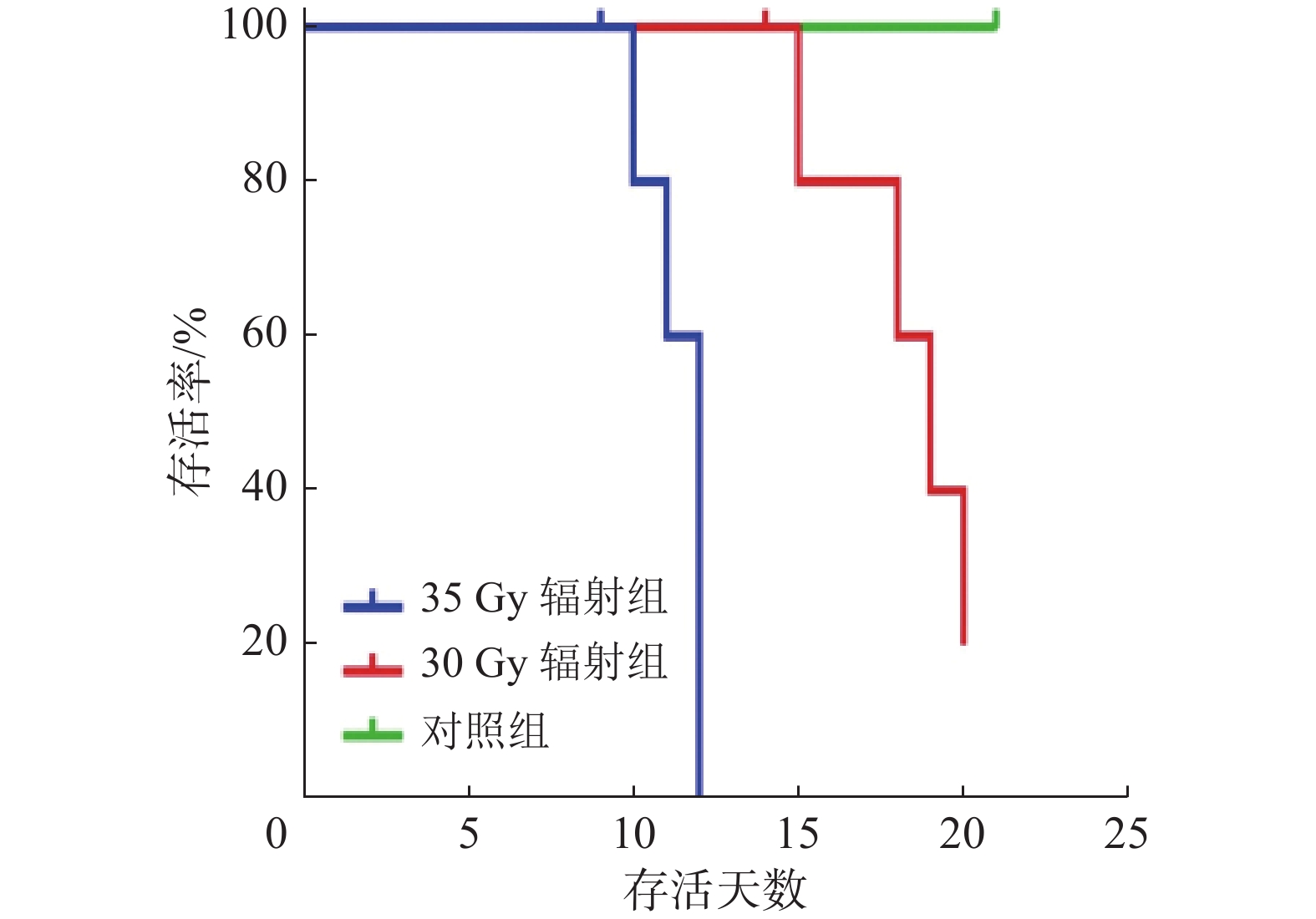
|
图 3 30 Gy和35 Gy处方剂量辐射不适宜构建RILD模型30 Gy和35 Gy辐射组小鼠存活曲线 Figure 3 The 30 and 35 Gy prescribed doses of radiation are not suitable for the construction of RILD model Survival curves of mice in the 30 and 35 Gy radiation groups |
如图4A所示,20 Gy处方剂量和25 Gy处方剂量辐射小鼠4周后,辐射组小鼠体重逐渐降低,短时间内25 Gy辐射组小鼠比20 Gy辐射组小鼠的体重下降更迅速,与对照组小鼠体重相比均具有显著性差异。20 Gy处方剂量和25 Gy处方剂量辐射小鼠血清肝功能指标变化结果如图4B所示,20 Gy辐射组小鼠ALT含量相较于对照组小鼠显著升高(t = 2.375,P < 0.05),但是两组小鼠的AST含量差异性不大。25 Gy辐射组的ALT(t = 4.584,P < 0.05)和AST(t = 1.927,P < 0.05)含量相较于对照组小鼠均出现升高。20 Gy辐射组和25 Gy辐射组与对照组小鼠相比肝脏器官体重比无显著差异(图4C)。此外,病理切片检测结果(图4D)显示,对照组小鼠可见正常肝细胞以中央静脉为中心呈放射性条索样排列,肝小叶轮廓清晰。20 Gy辐射组小鼠病理检测呈现肝细胞浊肿变性,汇管区及中央静脉周围见淋巴细胞浸润。25 Gy辐射组小鼠中肝小叶结构紊乱,汇管区有少量的炎性细胞浸润,肝细胞呈片状变性、坏死。

|
图 4 20 Gy和25 Gy处方剂量辐射诱导小鼠肝脏RILD Figure 4 The 20 and 25 Gy prescribed doses of radiation induced liver RILD in mice 注:A: 辐射4周后小鼠体重变化;B:辐射4周后小鼠血清肝酶ALT、AST、ALT/ALP指标变化(*代表显著性,即P < 0.05,*越多,表示两组间差异越显著);C:小鼠肝脏器官体重比变化;D: 小鼠肝脏病理组织学检测结果(代表图片) bar:200 μm。 |
综上结果表明,在直线加速器SBRT辐射诱导的RILD模型中,20 Gy处方剂量和25 Gy处方剂量辐射均诱导C57BL/6J小鼠肝脏组织出现RILD,其中包括体重降低,血清中AST含量升高等RILD病理变化等表征。
2.3 20 Gy和25 Gy处方剂量辐射诱导小鼠肝脏产生放射性肝纤维化20 Gy处方剂量和25 Gy处方剂量辐射处理36周后,病理切片检测结果(图5A)显示,20 Gy辐射组小鼠肝小叶内淋巴细胞浸润,肝细胞浊肿变性、坏死。25 Gy辐射组小鼠肝细胞浊肿变性,肝小叶内炎性细胞浸润,肝小叶结构破坏,纤维结缔组织增多,表现出纤维化症状。Masson染色检测结果如图5B所示,对照组仅在血管附近可见少量的细短的蓝色纤维,20 Gy及25 Gy辐射组小鼠肝脏组织中的蓝色胶原纤维组织明显增多,分布范围较大,可相互连接形成较粗大的纤维间隔。

|
图 5 20 Gy处方剂量和25 Gy处方剂量辐射诱导小鼠肝脏产生肝纤维化 Figure 5 The 20 and 25 prescribed doses of radiation induced liver fibrosis in mice 注:A: 辐射36周后小鼠肝脏病理组织学检测结果(代表图片) bar:200 μm;B: 辐射36周后小鼠肝组织 Masson染色病理学检测结果(代表图片) bar:200 μm。 |
综上结果表明,在直线加速器SBRT辐射诱导的RILD模型中,20 Gy处方剂量和25 Gy处方剂量辐射均诱导C57BL/6J小鼠肝脏组织出现放射性纤维化,进一步表明20 Gy处方剂量和25 Gy处方剂量诱导小鼠肝脏产生RILD。
3 讨 论SBRT技术允许以非常陡峭的剂量梯度给予肝脏肿瘤靶区部分提供相对较高的剂量,在不影响肝癌患者生活质量的情况下延长其生存期[9] 。Lock等[10]报道了SBRT患者在2年时间节点的总生存率比传统的放射分割患者更高 。然而,高剂量SBRT单次或几次分数治疗肝癌会导致RILD产生,RILD的生理致病机制尚不清楚,构建动物模型去探索RILD分子致病机制是必要的。Ying X等[11]使用小动物图像引导放射治疗系统将小鼠的肝脏精确照射单剂量30 Gy X射线来构建RILD小鼠模型,并使用单细胞RNA测序技术分析其细胞得到了部分放射性肝损伤的肝脏细胞图谱。Melin等[12]利用小动物图像引导的放射治疗平台单次照射肝脏某一点50 Gy后检测到肝细胞线粒体损伤和线粒体DNA异质性增加的基因,基于该模型提出辐照诱导的线粒体DNA不稳定通过生成过多的活性氧、p53通路激活和衰老样表型促进肝脏纤维化的发展。Du等[13]将WT、CGAS 缺陷和 STING 缺陷小鼠进行 30 Gy 全肝照射后,发现DNA传感及相关的1型干扰素信号通路有助于RILD的进展。综上所述, 为保证小鼠肝脏及小肠的剂量控制,科研人员开始选择精准放疗系统构建RILD小鼠模型,并基于该模型在RILD疾病探索中取得了创新性结果。医用直线加速器是临床普遍的医疗设备,传统的三维适形技术使得与肝脏相邻正常组织被照射,导致在直线加速器上的小鼠RILD模型的构建处于普放治疗时代,为了解决该问题并探索RILD的发生发展过程,构建一个基于直线加速器SBRT技术的小鼠精准放疗RILD模型是有意义的。
有研究认为,急性放射性肝损伤主要表现为血清肝酶指标ALT显著上升,肝细胞紊乱伴炎性细胞浸润现象[14]。病理变化是诊断放射性肝损伤或放射性肝纤维化的金标准[15]。Kim等[16]报道了C57BL/6J雄鼠全肝照射6 Gy 6周后发现ALT和AST水平升高。Yi等[17]使用Cs 137伽马照射C57BL/6J小鼠后观察到肝组织的一些病理变化,如肝组织炎症和坏死、中心静脉扩张、间质纤维化和脂肪变性等。Zeng Zhao Chong教授对小鼠全肝照射30 Gy 3周取血液后发现小鼠血清AST和ALT水平升高,并在6周后于光镜下发现了脂肪变性和炎细胞浸润现象。同时曾昭冲的研究结果表明,用低于(26.36±1.71) Gy的平均剂量辐射小鼠肝脏,未发现严重的小鼠RILD,而当平均剂量≥(31.76±1.94) Gy照射肝脏时,可构建小鼠RILD模型,并给予了TOMO下SBRT中ICR小鼠肝脏放疗相关体征的评价标准[18]。SBRT的单次剂量较高,具有独特的放射生物学效应。虽然在临床SBRT中,单次剂量的放射生物学效高于该剂量,但需要较高剂量的照射才能对小剂量照射的小鼠肝脏造成显著的正常组织毒性。而在低剂量辐射中,虽存在潜在辐射损伤,但会产生无症状变化[19]。我们在探讨芍药苷(PAE)对大鼠放射性肝纤维化的保护作用时,使用30 Gy辐射剂量诱导大鼠肝脏产生了放射性肝纤维化,并发现PAE可以抑制放射性肝纤维化的进展[20]。由于后续将对小鼠放射性肝损伤进行单细胞测序并探究其分子机制的研究,我们要求小鼠RILD模型要表现出严重的放射性肝损伤症状。基于以往研究,在预实验中,给予30 Gy和35 Gy处方剂量辐射小鼠,观察到35 Gy辐射组小鼠短期内全部死亡,30 Gy辐射组小鼠存在短期内大量死亡现象。为保证单细胞测序及后续科学实验中小鼠能够稳定存活,本实验决定给予20 Gy和25 Gy处方剂量辐射C57BL/6J小鼠。在本实验中观察到,25 Gy辐射处理组小鼠辐射4周后出现血清中ALT含量升高、炎细胞浸润、肝细胞坏死等RILD症状,辐射36周后出现明显放射性肝纤维化病理表征。20 Gy辐射组小鼠辐射4周后也出现放射性肝损伤病理症状,其血清肝酶指标变化没有25 Gy辐射处理组小鼠血清肝酶指标变化(与对照组相比)明显,但是辐射36周后,Masson染色病理学检测表明20 Gy辐射组小鼠存在放射性肝纤维化病理表征,以上结果进一步表明20 Gy处方剂量及25 Gy处方剂量均诱导小鼠肝脏产生放射性肝损伤,为后续的RILD单细胞测序实验提供了很好的基础。但不可否认的是,由于缺乏RILD单细胞测序数据的支撑,使得本篇文章存在极大的欠缺之处。而且我们认为在RILD模型构建过程中,小鼠固定体位材料使用碳纤维板是合适的,碳纤维板能提高X射线的穿透能力,很大程度减少散射剂量[21]。小鼠肝脏较小,CT定位时,使用小的定位铅点是合适的,较大的定位铅点增加了摆位误差,在CT图像上存在较大的金属伪影,对剂量计算影响较大。Salari等[22]认为计划优化时,1 mm计划剂量网格能够提高剂量计算准确性。此外,有人指出,对于单只小鼠来说,其放疗流程长达一个小时(包括小鼠麻醉与固定、CT模拟定位、靶区勾画、计划设计及直线加速器照射),涉及众多专业医技人员参与,时间漫长,过程繁琐。我们此次一次性精准照射5只小鼠来构建小鼠精准放疗疾病模型,极大的节约了时间和人力,这不仅体现了直线加速器中VMAT技术的优势性,也给了直线加速器下照射5只小鼠构建RILD精准模型的辐射剂量参考值,因此可在直线加速器下构建RILD多只小鼠精准放疗模型,照射小鼠局部肝脏单次处方剂量为20和25 Gy时,小鼠RILD模型均构建成功,在直线加速器下用SBRT技术辐射诱导的存活稳定的RILD小鼠模型对探索RILD疾病具有重大研究意义。
| [1] |
Chen GW, Zhao QQ, Yuan BY, et al. ALKBH5-Modified HMGB1-STING activation contributes to radiation induced liver disease via innate immune response[J]. Int J Radiat Oncol Biol Phys, 2021, 111(2): 491-501. DOI:10.1016/J.IJROBP.2021.05.115 |
| [2] |
Lee J, Shin IS, Yoon WS, et al. Comparisons between radiofrequency ablation and stereotactic body radiotherapy for liver malignancies: meta-analyses and a systematic review[J]. Radiother Oncol, 2020, 145: 63-70. DOI:10.1016/J.RADONC.2019.12.004 |
| [3] |
牛世英, 丛昌盛, 孙美丽, 等. 冷诱导RNA结合蛋白在放射性肺损伤模型中的表达变化[J]. 中国辐射卫生, 2022, 31(1): 33-38,46. Niu SY, Cong CS, Sun ML, et al. Expression of cold-inducible RNA-binding protein in radiation-induced lung injury model[J]. Chin J Radiol Health, 2022, 31(1): 33-38,46. DOI:10.13491/j.issn.1004-714X.2022.01.007 |
| [4] |
耿爽, 李倩, 郗停停, 等. 补体在放射性肺损伤中的作用与机制[J]. 中国辐射卫生, 2022, 31(5): 535-541. Geng S, Li Q, Xi TT, et al. Role of complement in radiation-induced lung injury[J]. Chin J Radiol Health, 2022, 31(5): 535-541. DOI:10.13491/j.issn.1004-714X.2022.05.002 |
| [5] |
Wang YF, Dai YH, Lin CS, et al. Clinical outcome and pathologic correlation of stereotactic body radiation therapy as a bridge to transplantation for advanced hepatocellular carcinoma: a case series[J]. Radiat Oncol, 2021, 16(1): 15. DOI:10.1186/S13014-020-01739-5 |
| [6] |
Schaub SK, Hartvigson PE, Lock MI, et al. Stereotactic body radiation therapy for hepatocellular carcinoma: current trends and controversies[J]. Technol Cancer Res Treat, 2018, 17: 1533033818790217. DOI: 10.1177/1533033818790217.
|
| [7] |
Xiao HH, Liu LL, Li WY, et al. TLD calibration and absorbed dose measurement in a radiation-induced liver injury model under a linear accelerator[J]. Nucl Sci Tech, 2023, 34(4): 53. DOI:10.1007/S41365-023-01211-5 |
| [8] |
Lyu QH, O'Connor D, Ruan D, et al. VMAT optimization with dynamic collimator rotation[J]. Med Phys, 2018, 45(6): 2399-2410. DOI:10.1002/MP.12915 |
| [9] |
Li W, Jiang LJ, Lu XZ, et al. Curcumin protects radiation-induced liver damage in rats through the NF-κB signaling pathway[J]. BMC Complement Med Ther, 2021, 21(1): 10. DOI:10.1186/S12906-020-03182-1 |
| [10] |
Lock M, Chow R, Jayatilaka A, et al. Does stereotactic body radiation improve outcomes compared to conventional radiation for liver cancer patients?[J]. Clin Transl Radiat Oncol, 2022, 35: 17-20. DOI:10.1016/J.CTRO.2022.04.002 |
| [11] |
Xu Y, Feng S, Peng QL, et al. Single-cell RNA sequencing reveals the cell landscape of a radiation-induced liver injury mouse model[J]. Radiat Med Prot, 2021, 2(4): 181-183. DOI:10.1016/J.RADMP.2021.11.001 |
| [12] |
Melin N, Yarahmadov T, Sanchez-Taltavull D, et al. A new mouse model of radiation-induced liver disease reveals mitochondrial dysfunction as an underlying fibrotic stimulus[J]. JHEP Rep, 2022, 4(7): 100508. DOI:10.1016/J.JHEPR.2022.100508 |
| [13] |
Du SS, Chen GW, Yuan BY, et al. DNA sensing and associated type 1 interferon signaling contributes to progression of radiation-induced liver injury[J]. Cell Mol Immunol, 2021, 18(7): 1718-1728. DOI:10.1038/S41423-020-0395-X |
| [14] |
高世乐, 胡宗涛, 董六一, 等. 白芍总苷防治放射性肝损伤形成的临床研究及其作用机制[J]. 中国中药杂志, 2017, 42(7): 1390-1394. Gao SL, Hu ZT, Dong LY, et al. Clinical efficacy and mechanism of total glucosides from white paeony for radioactive liver damage[J]. China J Chin Mater Med, 2017, 42(7): 1390-1394. DOI:10.19540/j.cnki.cjcmm.20170121.038 |
| [15] |
Im WH, Song JS, Jang W. Noninvasive staging of liver fibrosis: review of current quantitative CT and MRI-based techniques[J]. Abdom Radiol, 2022, 47(9): 3051-3067. DOI:10.1007/S00261-021-03181-X |
| [16] |
Kim J, Jung Y. Radiation-induced liver disease: current understanding and future perspectives[J]. Exp Mol Med, 2017, 49(7): e359. DOI:10.1038/EMM.2017.85 |
| [17] |
Yi L, Hu N, Mu HX, et al. Identification of cofilin-1 and destrin as potential early-warning biomarkers for gamma radiation in mouse liver tissues[J]. Health Phys, 2019, 116(6): 749-759. DOI:10.1097/HP.0000000000001012 |
| [18] |
Wu ZF, Zhang JY, Shen XY, et al. A mouse radiation-induced liver disease model for stereotactic body radiation therapy validated in patients with hepatocellular carcinoma[J]. Med Phys, 2016, 43(7): 4349-4361. DOI:10.1118/1.4953831 |
| [19] |
Kurland IJ, Broin PÓ, Golden A, et al. Integrative metabolic signatures for hepatic radiation injury[J]. PLoS One, 2015, 10(6): e0124795. DOI:10.1371/JOURNAL.PONE.0124795 |
| [20] |
Hu ZT, Qin F, Gao SL, et al. Paeoniflorin exerts protective effect on radiation-induced hepatic fibrosis in rats via TGF-β1/Smads signaling pathway[J]. Am J Transl Res, 2018, 10(3): 1012-1021. |
| [21] |
Dong FF, Weng X, Deng XZ, et al. Clinical utility of a new immobilization method in image-guided intensity-modulated radiotherapy for breast cancer patients after radical mastectomy[J]. J X-Ray Sci Technol, 2022, 30(4): 641-655. DOI:10.3233/XST-221127 |
| [22] |
Salari E, Parsai EI, Shvydka D, et al. Evaluation of parameters affecting gamma passing rate in patient-specific QAs for multiple brain lesions IMRS treatments using ray-station treatment planning system[J]. J Appl Clin Med Phys, 2022, 23(1): e13467. DOI:10.1002/ACM2.13467 |




