电离辐射作用于人体会产生大量自由基,自由基是导致电离辐射损伤的重要机制,筛选安全、高效的自由基清除剂是防治辐射损伤的重要方法[1]。中草药不良反应小,活性成分丰富,已成为当前热门的研究方向[2]。小檗碱是从中草药黄连等植物中提取分离的,是一种低毒的天然异喹啉生物碱,具有广泛的生化和药理活性,包括抗菌、抗炎、抗病毒、抗肿瘤、降血压、降血糖、降血脂、保肝、保心、止泻等作用[3]。研究显示,BBR的多种药理活性与清除自由基抑制氧化应激有关[4]。本研究拟观察小檗碱对辐射损伤大鼠血清超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)、丙二醛(MDA)指标及大鼠骨髓、小肠病理的影响,探究小檗碱对辐射损伤大鼠的保护作用及可能机制。
1 材料与方法 1.1 实验材料及仪器设备超氧化物歧化酶( SOD)、还原型谷胱甘肽(GSH) 、丙二醛( MDA)试剂盒(均购自泉州市睿信生物科技有限公司),10%水合氯醛(福州飞净生物科技有限公司),小檗碱(山东仁和堂药业有限公司),全波长酶标仪(美国伯腾仪器有限公司),TG16W型微量高速离心机(长沙湘智离心机仪器有限公司),TGL16M台式高速冷冻离心机(上海卢湘仪离心机仪器有限公司),XB220A型电子分析天平(上海天美天平仪器有限公司),显微镜(日本奥林巴斯公司) 。
1.2 实验动物分组及给药方法选择SPF级SD大鼠42只,体重在150~200 g之间,购自北京斯贝福生物技术有限公司,动物生产许可证号:SCXK(京)2019—0010。于标准室温(23℃±2℃)和湿度(50%~70%)条件下饲养一周后随机分为 7组(每组6只):正常对照组,1 Gy辐射组,1 Gy低、高剂量小檗碱组(50 mg/kg、150 mg/kg),3 Gy辐射组,3 Gy低、高剂量小檗碱组(50 mg/kg、150 mg/kg), 除正常对照组外, 其他各组均以Varian21EX医用直线加速器20 MeV电子束全身均匀外照射,剂量率300 cGy/min, 照后当天小檗碱组采用灌胃法给药,每天灌胃1次,持续10 d,对照组和辐照组以蒸馏水代替,实验期间所有实验动物普通饲料喂养,自由饮水。
1.3 标本收集及指标检测第10 d用10%水合氯醛按0.3 ml/100 g进行大鼠腹腔注射麻醉,腹主动脉取血,离心取血清−20℃保存。开胸腹取出胸骨、小肠,用10%中性甲醛固定,HE染色,光镜下观察骨髓、小肠病理。
1.4 微量法测定血清SOD、GSH、MDA水平取大鼠血清,参照试剂盒的方法进行SOD、GSH、MDA的测定。
1.5 统计学方法数据采用SPSS 22.0软件进行统计分析,各测定值经正态性检验,符合正态分布,以均数±标准差表示(
与正常对照组相比,辐射组大鼠SOD、GSH血清水平明显降低,MDA血清水平明显升高,差异有统计学意义(P < 0.05)。与1 Gy辐射组相比,1 Gy高剂量小檗碱组SOD、GSH血清水平明显升高,MDA血清水平明显降低,差异有统计学意义( P<0.05),而1 Gy低剂量小檗碱组SOD、GSH、MDA差异都无统计学意义(P>0.05)。与3 Gy辐射组相比,低、高剂量小檗碱组SOD、GSH活性都明显升高,MDA含量明显降低,并且SOD、GSH升高的程度跟小檗碱剂量呈正比,差异有显著统计学意义(P < 0.05),而提高小檗碱剂量对MDA无影响(见 表1)。表明当大鼠受到1 Gy辐照时,仅高剂量的小檗碱能提高SOD、GSH活性,降低MDA含量,而低剂量小檗碱差异没有统计学意义(P>0.05)。当受到3 Gy辐照时,低、高剂量小檗碱都能升高SOD、GSH活性,降低MDA含量;提高小檗碱用量,SOD、GSH活性升高更为明显,但对MDA无影响。
|
|
表 1 小檗碱对辐射大鼠SOD、GSH、MDA的影响(n = 6) Table 1 Effects of berberine on SOD, GSH, and MDA in irradiated rats (n = 6) |
正常对照组大鼠骨髓增生非常活跃。1 Gy辐射组骨髓增生低下,造血细胞明显减少。1 Gy低剂量小檗碱组骨髓增生程度有提高,1 Gy高剂量小檗碱组骨髓增生程度显著改善,接近正常。3 Gy辐射组骨髓增生程度更低下,骨小梁稀疏,造血细胞明显减少,血管扩张、充血。3 Gy低剂量小檗碱组骨髓增生程度有所改善,3 Gy高剂量小檗碱组骨髓增生程度显著改善,但仍未恢复正常(见图1)。表明小檗碱对辐射大鼠骨髓损伤有改善作用,且高剂量效果更好。
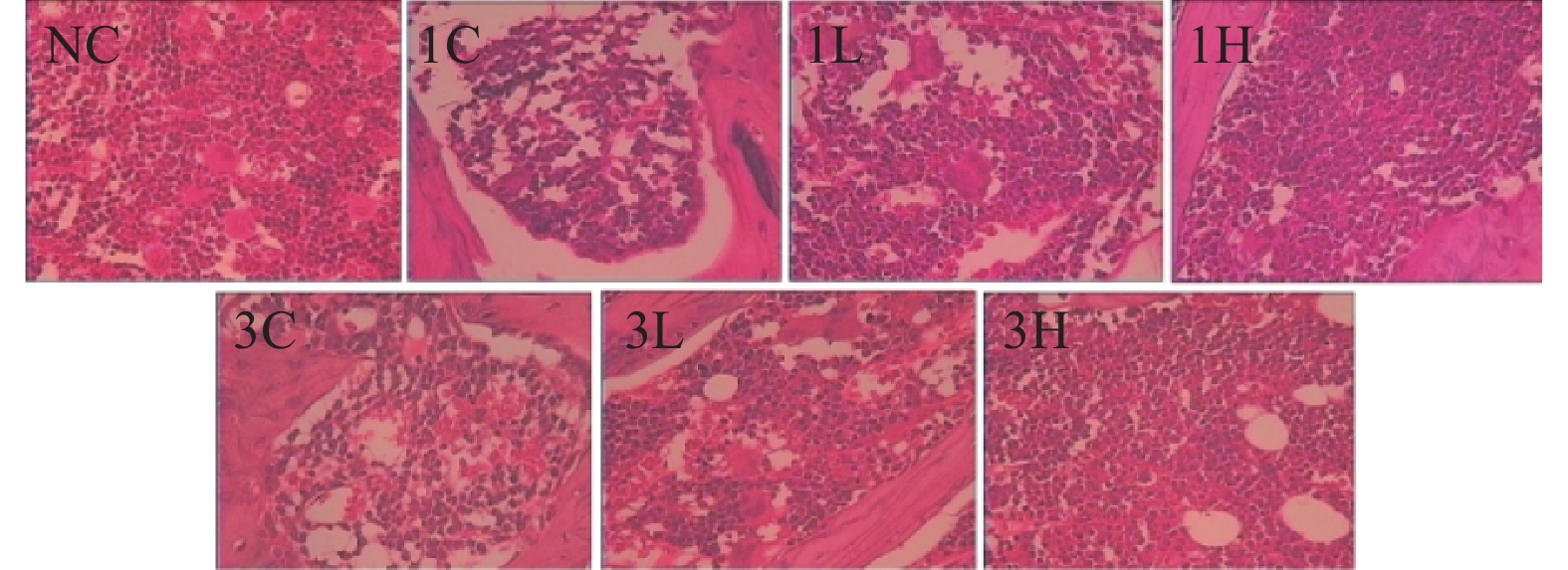
|
图 1 小檗碱对辐射大鼠骨髓病理影响(HE × 100) Figure 1 Pathological effects of berberine on bone marrow in irradiated rats (HE × 100) 注:NC:正常对照组;1C:1 Gy辐射组;1 L:1 Gy低剂量BBR组;1H:1 Gy高剂量BBR组;3C:3 Gy辐射组;3 L:3 Gy低剂量BBR组;3H:3 Gy高剂量BBR组。 |
正常对照组大鼠小肠绒毛茂密,结构完整,绒毛长度无异常;1 Gy辐射对照组小肠绒毛变短,绒毛杂乱,顶端有破损,1 Gy小檗碱低剂量组绒毛长度和整齐性都有明显增加,1 Gy小檗碱高剂量组小肠绒毛恢复正常。3 Gy辐射对照组小肠绒毛变短、稀疏更为明显,绒毛杂乱且有破损,3 Gy小檗碱低剂量组绒毛长度明显增加,趋于整齐,3 Gy小檗碱高剂量组小肠绒毛基本恢复正常(见图2)。表明小檗碱对辐射大鼠小肠损伤有改善作用,高剂量效果更明显。
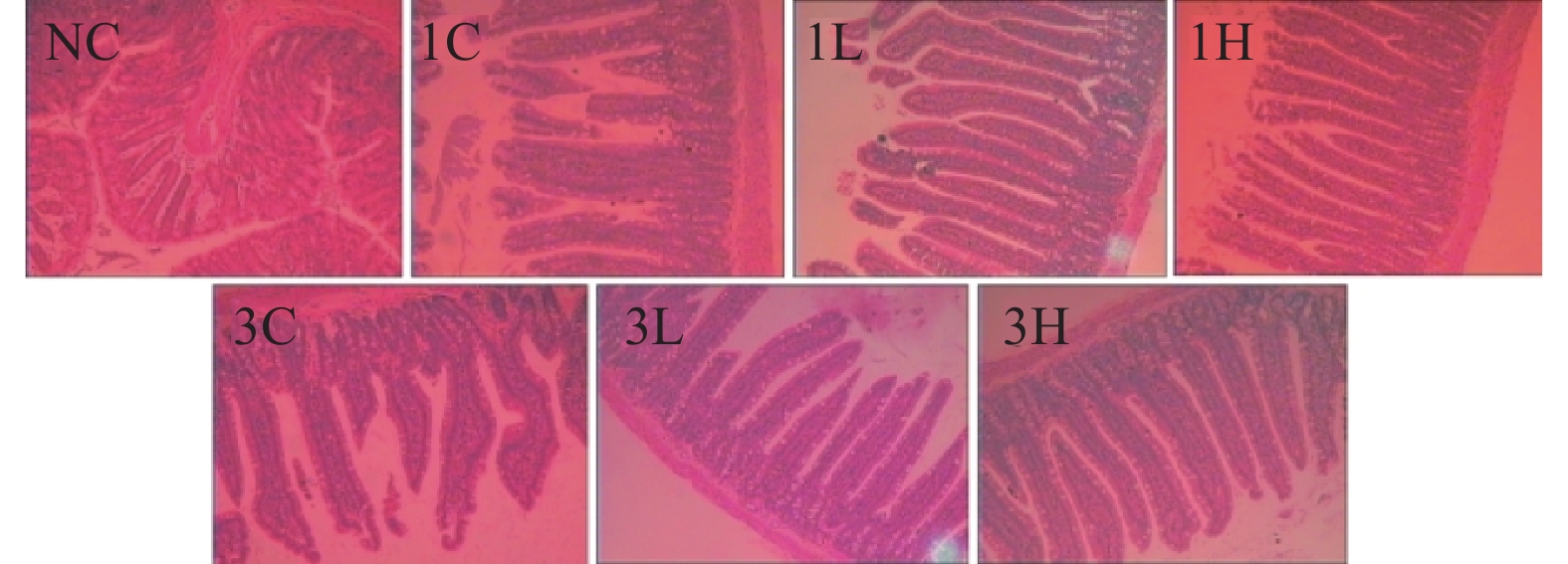
|
图 2 小檗碱对辐射大鼠小肠病理影响(HE × 100) Figure 2 Pathological effects of berberine on small intestinal in irradiated rats (HE × 100) 注:NC:正常对照组;1C:1 Gy辐射组;1 L:1 Gy低剂量BBR组;1H:1 Gy高剂量BBR组;3C:3 Gy辐射组;3 L:3 Gy低剂量BBR组;3H:3 Gy高剂量BBR组。 |
电离辐射作用于人体常表现为多系统损伤。造血组织属高度辐射敏感器官,受照后骨髓造血功能抑制是最主要的病理表现,贯穿于疾病的始终,减轻骨髓造血功能的损伤和促进造血功能的恢复是救治的关键[5]。消化系统对辐射也很敏感,特别是小肠属于自我更新特别迅速的组织,对电离辐射十分敏感,受到辐射损伤后,肠粘膜破坏、脱落,屏障受损,易引起菌血症、败血症。有研究显示,抑制氧化应激可以改善电离辐射引起的肠道损伤[6]。
本实验结果显示,使用医用电子直线加速器辐射后,SD大鼠骨髓造血功能受抑制,造血干细胞减少,骨小梁分布稀疏,且与辐射剂量呈正比。小檗碱灌胃给药后,骨髓造血功能较对照组恢复明显,造血干细胞增多,且高剂量小檗碱组恢复更好。此外,正常组大鼠小肠绒毛茂密,结构完整,绒毛长度无异常;辐照组大鼠小肠绒毛变短,绒毛杂乱,偶见绒毛破损,而小檗碱给药后,小肠绒毛长度、整齐性都明显改善,高剂量小檗碱组基本恢复正常。这些结果表明,小檗碱在动物水平能有效减轻辐射引起的造血系统和肠道损伤。
电离辐射是一种重要的氧化应激因素[7-8],作用于人体后既可直接攻击生物分子形成生物分子自由基;又可先作用于水产生大量的自由基,这些自由基再攻击生物分子形成生物分子自由基。由于水占机体70%以上,因此大多数辐射损伤是由水的辐解造成的,会产生活性氧、活性氮,从而对蛋白质、脂质和DNA造成氧化应激损伤,是电离辐射损伤机体的主要机制。自由基作用于生物膜引起膜的脂质过氧化,丙二醛(MDA)是脂质过氧化终产物之一,是脂质过氧化评估的主要生物标志物,反映机体辐射损伤程度[9]。超氧化物歧化酶(SOD)是最重要的抗氧化清除酶,参与清除自由基,能催化超氧阴离子自由基(O2−)歧化为分子氧和过氧化氢(H2O2)并降低O2−水平,是抵抗活性氧(ROS)介导损伤的第一道防线[10]。SOD活性的高低反映了组织细胞清除O2−的能力。据报道,长期暴露于电离辐射的医务人员和辐射作业人员血液中的MDA水平显著升高,而SOD水平显著降低,导致氧化应激和DNA损伤[11-12]。谷胱甘肽(GSH)主要来源于肝脏,是体内一种重要的非酶抗氧化剂,其通过巯基与体内自由基结合,可直接清除ROS、NO及其衍生物等自由基,是调节氧化还原反应过程的最重要的硫醇还原剂[13]。
越来越多的研究表明,小檗碱是一种有效的抗氧化剂和自由基清除剂,具有多种药理和生物活性。小檗碱能通过增强抗氧化防御来减轻高血糖及其相关的氧化应激[14]。经过小檗碱预处理能增加抗氧化酶(如 CAT、SOD 和 GSH-PX )活性并降低心脏 MDA 水平,保护大鼠心肌免受氧化应激损伤[15]。小檗碱还能减轻大鼠结肠癌的脂质过氧化损伤,增强抗氧化状态,从而抑制肿瘤转化[16]。近年来,放疗联合小檗碱治疗肿瘤病人的研究日益增多,小檗碱可以作为放射增敏剂,增强肿瘤细胞的辐射敏感性和保护正常组织,但机制尚不完全明确[17-18]。本实验证实,辐射可使大鼠血清SOD、GSH水平降低,MDA含量升高,且与受照剂量正相关,表明辐射抑制了抗氧化物质的活性,启动了脂质过氧化反应,导致氧化应激的发生。对于1 Gy辐照大鼠,低剂量小檗碱无明显改善作用,而高剂量小檗碱能有效降低其血清MDA含量,提高血清GSH、SOD水平,原因可能是低剂量辐射大鼠体内产生的自由基水平较低,损伤较轻,自我修复能力较强,小檗碱血液浓度偏低时,自由基清除能力有限,故SOD、GSH、MDA变化不明显。对于3 Gy辐照大鼠,低、高剂量小檗碱都能有效提高血清SOD、GSH水平,降低MDA含量,且高剂量小檗碱升高SOD、GSH更明显,提示小檗碱能对抗辐射对上述抗氧化物质的抑制,提高抗氧化能力,抑制脂质过氧化程度,可以作为抗氧化剂抑制辐射的氧化损伤。
总之,本研究结果表明,小檗碱能有效减轻电离辐射对大鼠造血系统、消化系统的损伤,其机制可能跟小檗碱提高抗氧化物质的活性有关,这有助于克服辐射氧化应激并增加体内自由基的清除能力,其确切完整的机制尚待进一步研究。尽管目前研究还仅限于动物水平,但为临床防治辐射损伤提供了一种新的思路,由于小檗碱来源广泛,提取工艺成熟,成本低,副作用小,因此值得进一步研究。
| [1] |
孙华斌, 于秀欣, 赵勇. 自由基和抗氧化剂生态网络系统理论模型及应用研究[J]. 中国辐射卫生, 2013, 22(5): 513-517. Sun HB, Yu XX, Zhao Y. Study on free radical and antioxidant ecological network system theory model and its application[J]. Chin J Radiol Health, 2013, 22(5): 513-517. DOI:10.13491/j.cnki.issn.1004-714X.2013.05.001 |
| [2] |
Yi JJ, Zhu JQ, Zhao CC, et al. Potential of natural products as radioprotectors and radiosensitizers: opportunities and challenges[J]. Food Funct, 2021, 12(12): 5204-5218. DOI:10.1039/d1fo00525a |
| [3] |
Och A, Podgórski R, Nowak R. Biological activity of berberine—a summary update[J]. Toxins, 2020, 12(11): 713. DOI:10.3390/toxins12110713 |
| [4] |
Abdulredha A, Abosaooda M, Al-Amran F, et al. Berberine protests the heart from ischemic reperfusion injury via interference with oxidative and inflammatory pathways[J]. Med Arch, 2021, 75(3): 174-179. DOI:10.5455/medarh.2021.75.174-179 |
| [5] |
王晶, 周芳. 造血干细胞移植治疗骨髓型急性放射病的研究进展[J]. 中国辐射卫生, 2021, 30(3): 381-385. Wang J, Zhou F. Research progress in hematopoietic stem cell transplantation for bone marrow acute radiation syndrome[J]. Chin J Radiol Health, 2021, 30(3): 381-385. DOI:10.13491/j.issn.1004-714X.2021.03.024 |
| [6] |
Li YH, He Q, Chen YZ, et al. p-Coumaric acid ameliorates ionizing radiation-induced intestinal injury through modulation of oxidative stress and pyroptosis
[J]. Life Sci, 2021, 278: 119546. DOI:10.1016/j.lfs.2021.119546 |
| [7] |
Nuszkiewicz J, Woźniak A, Szewczyk-Golec K. Ionizing radiation as a source of oxidative stress—the protective role of melatonin and Vitamin D[J]. Int J Mol Sci, 2020, 21(16): 5804. DOI:10.3390/ijms21165804 |
| [8] |
李鹏, 陈凡, 孙祥益, 等. 放射性心脏损伤动物模型相关实验研究进展[J]. 中国辐射卫生, 2020, 29(1): 93-97. Li P, Chen F, Sun XY, et al. Advances in experimental research on radiation-induced heart injury in animal models[J]. Chin J Radiol Health, 2020, 29(1): 93-97. DOI:10.13491/j.issn.1004-714X.2020.01.022 |
| [9] |
Mas-Bargues C, Escrivá C, Dromant M, et al. Lipid peroxidation as measured by chromatographic determination of malondialdehyde. human plasma reference values in health and disease[J]. Arch Biochem Biophys, 2021, 709: 108941. DOI:10.1016/j.abb.2021.108941 |
| [10] |
Wang Y, Branicky R, Noë A, et al. Superoxide dismutases: dual roles in controlling ROS damage and regulating ROS signaling[J]. J Cell Biol, 2018, 217(6): 1915-1928. DOI:10.1083/jcb.201708007 |
| [11] |
Bolbol SA, Zaitoun MF, El-Magd SAA, et al. Healthcare workers exposure to ionizing radiation: oxidative stress and antioxidant response[J]. Indian J Occup Environ Med, 2021, 25(2): 72-77. DOI:10.4103/ijoem.IJOEM_198_20 |
| [12] |
刘剑英, 尚伟华, 马得勋, 等. 长期低剂量核辐射接触人员机体相关指标变化[J]. 中国辐射卫生, 2023, 32(2): 167-170. Liu JY, Shang WH, Ma DX, et al. Changes in body-related indices in people exposed to long-term low-dose nuclear radiation[J]. Chin J Radiol Health, 2023, 32(2): 167-170. DOI:10.13491/j.issn.1004-714X.2023.02.015 |
| [13] |
Vairetti M, Di Pasqua LG, Cagna M, et al. Changes in glutathione content in liver diseases: an update[J]. Antioxidants, 2021, 10(3): 364. DOI:10.3390/antiox10030364 |
| [14] |
Liu C, Wang Z, Song YL, et al. Effects of berberine on amelioration of hyperglycemia and oxidative stress in high glucose and high fat diet-induced diabetic hamsters in vivo[J]. BioMed Res Int, 2015, 2015: 313808. DOI:10.1155/2015/313808 |
| [15] |
Wu YZ, Zhang L, Wu ZX, et al. Berberine ameliorates doxorubicin-induced cardiotoxicity via a SIRT1/p66Shc-mediated pathway[J]. Oxid Med Cell Longev, 2019, 2019: 2150394. DOI:10.1155/2019/2150394 |
| [16] |
Thirupurasundari CJ, Padmini R, Devaraj SN. Effect of berberine on the antioxidant status, ultrastructural modifications and protein bound carbohydrates in azoxymethane-induced colon cancer in rat[J]. Chem-Biol Interact, 2009, 177(3): 190-195. DOI:10.1016/j.cbi.2008.09.027 |
| [17] |
Ramesh G, Das S, Sadashiva SRB. Berberine, a natural alkaloid sensitizes human hepatocarcinoma to ionizing radiation by blocking autophagy and cell cycle arrest resulting in senescence[J]. J Pharm Pharmacol, 2020, 72(12): 1893-1908. DOI:10.1111/jphp.13354 |
| [18] |
Wang J, Liu Q, Yang QF. Radiosensitization effects of berberine on human breast cancer cells[J]. Int J Mol Med, 2012, 30(5): 1166-1172. DOI:10.3892/ijmm.2012.1095 |




