甲状腺癌的发病率占全身恶性肿瘤2%,近年来发病率趋于稳定[1],95%病理类型为分化型甲状腺癌(differentiated thyroid cancer,DTC),大多数DTC患者预后良好,10年生存率可达90.00%~95.00%,当分化型甲状腺癌发生骨转移,10年生存率仅为13%~21%[2],而且大部分骨转移患者的生存质量降低。国内外有很多针对DTC骨转移的研究,但是有些研究病例数较少[3-5],有些研究仅仅采用了风险比(hazard ratio,HR)作为研究终点[6],有些仅仅研究了接受131I治疗的患者[7-9]。本研究回顾性分析我院1991年1月至2018年9月收治的108例DTC骨转移患者,探究其预后及影响因素,进一步为临床决策提供依据。
1 资料与方法 1.1 研究对象回顾性研究1991年1月—2018年9月在中国医学科学院肿瘤医院接受DTC骨转移治疗的108例患者。研究对象的纳入标准包括:原发灶病理结果为DTC;符合BM诊断标准;临床资料齐全。排除标准包括:原发灶病理证实非DTC或DTC合并未分化癌细胞;不符合骨转移标准的;临床资料不全。
DTC的诊断基于甲状腺切除术后病理或甲状腺癌病灶穿刺病理结果,包括乳头状癌、滤泡状癌及混合性癌。骨转移的诊断标准如下:1)病理结果诊断为骨转移(n = 57);2)甲状腺全切后131I全身显像(131I whole-body scan, 131I-WBS)显示骨病灶131I摄取阳性,并且至少一项影像学检查(X线、CT或MRI)显示骨转移,同时伴有血清甲状腺球蛋白(serum thyroglobulin , Tg)水平升高(n = 29);3)未行甲状腺全切或甲状腺全切后未行131I-WBS者,至少2项影像学检查(18FDG-PET/CT、X线、CT、MRI、骨扫描)结果为骨转移(n = 22),而无法用其它原因来解释。
1.2 治疗与随访所有患者均接受了针对DTC骨转移灶治疗,包括131I治疗和非131I治疗。非131I治疗方式包括手术、放疗、化疗、靶向治疗、动脉栓塞、153Sm-EDTMP、99Tcm-MDP以及粒子植入。107位患者接受了甲状腺全切,其中66例行全甲状腺切除术,41例行补充甲状腺全切术,只有1例未行131I治疗者未行甲状腺切除术。
共有79例患者接受131I治疗,治疗前均接受了甲状腺全切,所有患者在停用甲状腺激素和低碘饮食4周,血清TSH > 30 mIU/mL后,接受 131I治疗。患者口服131I单次剂量中位7.4 GBq(范围:3.7~7.4 GBq),治疗次数中位3次(范围:1~12次),治疗间隔时间中位为6个月(范围:5~12月)。口服131I 1周后行131I-WBS。131I治疗后6~8周常规检测甲状腺功能(T3、T4、FT3、FT4、TSH、Tg和TgAb)、肝肾功、血常规,必要时行颈部超声、X线、CT、MRI等影像学检查。中位随访时间为172.5月(范围25~371月)。
1.3 影响预后的因素我们的研究纳入的影响因素包括:确诊DTC时的年龄、确诊骨转移(bone metastases,BM)时的年龄、性别、病理类型、首发症状、骨转移灶个数、是否有其他远处转移(研究中有1例腋窝淋巴结转移的患者被归入远处转移组)、是否合并肺转移、是否发生临床骨相关事件(SREs)、治疗方式、是否有颈部淋巴结转移,是否有颈部复发,是否有第二原发癌,每个影响因素分类标准如下:
患者出现以下任一情况时诊断为该患者发生SREs[10]:病理性骨折;脊髓受压;为控制疼痛或预防即将发生的骨折而进行的放疗或手术;高钙血症 。
若患者在诊断DTC之前或同时发现骨转移,则归入首发症状为骨转移组。
从确诊BM至随访结束,若发现全身只有一处骨转移灶,则归为单一骨转移灶组。
淋巴结转移及第二原发癌的诊断均基于病理结果。若患者第一次行甲状腺切除术时发现了转移的淋巴结,则归为淋巴结转移组,若随访期间行颈部清扫发现的转移淋巴结归为颈部复发组。
1.4 统计学处理骨转移后总体生存率(overall survival , OS)定义为从诊断骨转移到患者死亡的时间,以月为单位。连续变量以中位数和范围表示。采用Kaplan Meier生存分析构建生存曲线,应用log-rank检验比较各组生存差异。将单因素分析中与较好的OS相关的预后因素纳入多变量分析中,以评估预后因素与OS的关系,以上通过构建Cox比例风险模型来实现。采用SPSS 26.0进行统计分析,检验水准α = 0.05。
2 结 果 2.1 一般临床资料特点入组的108例DTC骨转移患者由43名男性和65名女性组成,诊断为DTC时的中位年龄为55岁,诊断为骨转移时的中位年龄为58岁。107例患者接受了甲状腺全切(全甲状腺切除术n = 67,补充甲状腺全切n = 40),只有1例患者行靶向治疗与化疗未行甲状腺全切。58例患者发生了除骨以外其他器官转移,最常见的部位为肺(n = 52),其次为纵膈(n = 10),肝(n = 8),脑(n = 3),胸膜(n = 2),另外各有1例侵犯以下器官或组织:甲状旁腺、胰腺、食管、气管、喉、脾脏、腋下淋巴结。3例患者发生第二原发癌,分别为肺癌、膀胱癌、小阴唇腺鳞癌,这3例患者DTC骨转移的诊断均由手术或穿刺病理证实。
79例患者接受了131I治疗,其中29例患者只接受131I 治疗,50例患者接受联合治疗(131I + 非131I治疗方式),131I治疗中位累积剂量为20.35 GBq(范围:3.7~7.4 GBq),共有19例患者骨转移灶不摄碘。另有29例患者只接受了非131I治疗。由于非131I治疗组与联合治疗组患者接受了非131I治疗方式,各组患者接受非131I治疗方式见表1。
|
|
表 1 非131I治疗组与联合治疗组使用非131I治疗方式的人数 Table 1 Number of patients treated with non-131I therapies in the non-131I treatment group and the combination treatment group |
survival及影响因素 79.6%(86/108)的患者发生结局事件,中位生存时间为70 m(95%CI 57.10~82.90 m),5年、10年、15年、20年总体生存率分别为54.4%、24.3%、9.8%、4.3%,见图1。
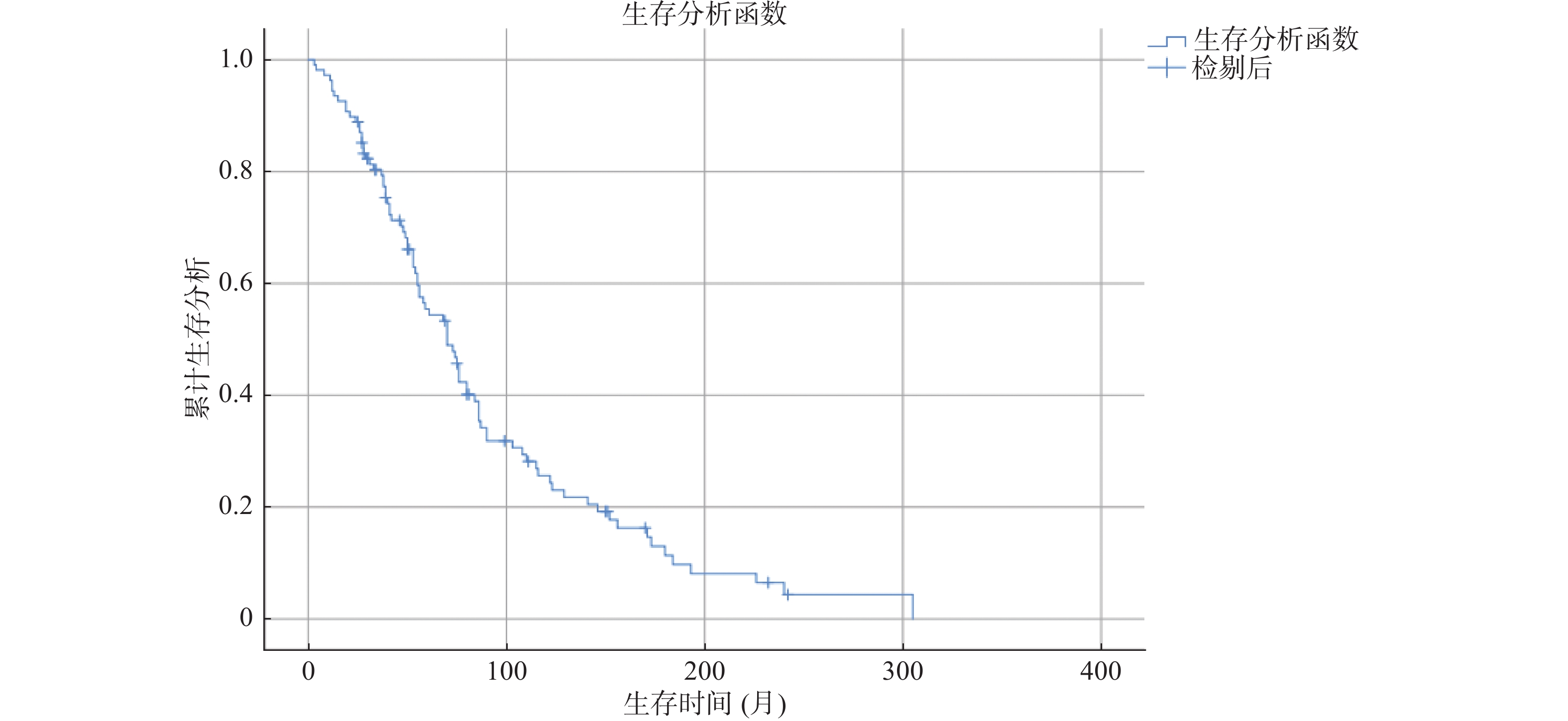
|
图 1 108例的DTC骨转移患者的总体生存率 Figure 1 Overall survival in 108 DTC patients with bone metastasis |
单因素分析结果显示,骨转移灶个数、是否发生SREs、治疗方式、淋巴结转移情况与预后显著相关。相较于多发骨转移灶,单一骨转移的患者预后更好[86.0 m (95%CI 59.2~112.9 m) vs. 56.0 m (95%CI 46.2~65.8 m);P = 0.012]。患者出现SREs预示着更差的预后[53.0 m (95%CI 35.8~70.3 m) vs. 76.0 m (95%CI 63.2~88.8 m);P = 0.019]。患者发生颈部淋巴结转移,不论转移至单侧的还是双侧,中位生存期都较短。相较于没有颈部淋巴结转移的患者[90 m (95%CI 53.8~126.2 m)],单侧颈部淋巴结转移中位生存期为55.0 m[(95%CI 35.1~74.9 m);P = 0.004],双侧颈部淋巴结转移中位生存期为50.0 m[(95%CI 31.2~68.8 m);P = 0.003]。治疗方式也会影响患者的预后,接受联合治疗的患者预后最好[80.0 m (95%CI 65.8~94.2 m),P < 0.001],其次为只接受 131I的患者[68.0 m (95%CI 46.2~89.8 m),P = 0.109],只接受了非131I的治疗的患者预后最差[47.0 m (95%CI 16.8~77.2 m)],见表2,不同治疗方式对DTC骨转移患者预后的影响见图2。
|
|
表 2 108例DTC骨转移患者的临床特征及与预后的关系(单因素分析结果) Table 2 Clinical characteristics of 108 DTC patients with bone metastases and their relationship with prognosis (univariate analysis) |

|
图 2 不同治疗方式对DTC骨转移患者OS的影响 Figure 2 Influence of treatment methods on OS of DTC patients with bone metastasis |
从多因素变量分析中发现,只有单一骨转移灶、SREs、治疗方式是独立预后因素,见表3。
|
|
表 3 影响108例DTC骨转移患者的预后因素(多因素分析结果) Table 3 Prognostic factors affecting 108 DTC patients with bone metastasis (multivariate analysis) |
本研究分析了经过长期随访的108例的DTC骨转移患者的临床资料,探索了影响预后的因素,重点研究有关治疗方式对OS的影响的问题。
本研究中,研究总体的中位生存期为70 m(5.8年),略低于Wu等[9]研究的6.4年,可能是因为他们只把接受131I治疗的患者作为研究群体,而这部分患者往往预后较好。由于131 I发出β射线能量较高(0.61 MeV)[11],并且131I治疗具有疗效好、不良反应少、并发症轻的优势,被广泛用于治疗DTC患者。我们的研究结果也显示,相较于接受非131I治疗,接受131I治疗或者131I治疗联合其他治疗的患者中位生存期明显更长,尤其是接受131I治疗联合其他治疗的患者,131I治疗联合其他治疗的患者中位生存期6.6年。2015年美国甲状腺协会(ATA)指南推荐使用131I治疗DTC骨转移患者,其他非131I治疗手段,不论局部治疗还是全身治疗,也应该考虑。先前也有多篇文章证实131I联合其他治疗手段(手术、动脉栓塞、骨水泥成形术、射频消融、抗骨吸收药物)有助于改善患者预后[4, 8, 9, 12-16],降低DTC骨转移患者发生新SREs的机会[17],缓解骨痛、增强骨稳定性[18]。
本研究结果也发现,131I进行治疗联合其他治疗手段,可以提高DTC骨转移患者的生存率。而近期一篇包含178例DTC-BM患者的研究结果显示[19],骨转移灶摄碘阳性的患者,在131I联合多种病灶治疗下预后很好,甚至可以达到骨转移完全缓解(complete-BM-response, C-BM-R),文章将C-BM-R定义为:在131I-WBS上BM摄碘消失,在形态学检查中BM消失或病灶FDG摄取消失,未出现新的BM,并伴有未检测到的Tg (< 1 ng/mL,在L-甲状腺素治疗且没有Tg抗体的情况下)。结合临床经验来看,单一骨转移灶经过根治性手术,并在术后辅以131I等治疗手段,可以在临床上达到治愈效果,本研究中3位生存时间在20年以上的患者均符合上述情况。而在癌症终末期,仅用姑息治疗骨转移的患者往往预后很差。本研究未将非131I治疗手段区分为根治性治疗和姑息性治疗,这也会引起结果误差。
SREs的发生是威胁患者生命的重要因素,这与很多研究结果一致[6, 10, 17, 20],如果患者出现如病理性骨折、脊髓受压等SREs的症状,可在无禁忌症的情况下进行手术治疗、放疗等。
患者在确诊DTC 的同时发现颈部淋巴结转移也是导致预后较差的因素,尽管这个结果与大多数先前作者的结论不同。一种可能的原因是,发生双侧颈部淋巴结转移患者中,部分已经达到T4期,而T4期预后较差[6]。另一种可能的原因是,我们评价淋巴结转移的标准是病理结果,而这与手术范围紧密相关,这会导致转移的淋巴结未能被及时发现,从而引起结果的误差。目前普遍认为淋巴结转移与局部高复发率相关[21-24],并不是疾病特异性生存率的独立危险因素[25]。由于受到手术范围、诊断标准的限制,很难准确评估淋巴结转移与预后的关系。
对于分化型甲状腺癌骨转移的患者,本研究发现骨转移的诊断时间对预后没有影响。单因素分析显示,以骨转移为首发症状诊断为DTC患者生存率似乎略有提高,但差异没有统计学意义。虽然国内有研究[26]认为以骨转移为首发症状诊断为DTC患者的预后要优于甲状腺癌术后诊断为骨转移的DTC患者,但是此研究缺少首发症状组与随访发现BM组间临床特征的比较,比如首发症状组的良好预后可能是由于此组患者年龄更小、单一骨转移灶更多、更多患者采用联合治疗等因素导致的。国外不少研究[6, 12-14, 27]认为,如果BM与DTC同时确诊,那么患者预后更好,但这些研究均没有说明同时确诊的分组标准及依据。所以探讨骨转移的诊断时间对预后的影响仍需要更多、更严谨的证据。
当然本研究也有很多不足。由于临床数据缺失,没有办法比较短期疗效,比如骨痛缓解和Tg水平降低。另外预后指标仅仅采用了全因死亡率,并不能完全表现疾病对生存率的影响。
综上所述,对于DTC骨转移的患者,仅有单一骨转移,没有发生SREs以及采用131I治疗联合多种治疗手段与良好预后显著相关。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [2] |
Muresan MM, Olivier P, Leclère J, et al. Bone metastases from differentiated thyroid carcinoma[J]. Endocr Relat Cancer, 2008, 15(1): 37-49. DOI:10.1677/ERC-07-0229 |
| [3] |
Do MY, Rhee Y, Kim DJ, et al. Clinical features of bone metastases resulting from thyroid cancer: a review of 28 patients over a 20-year period[J]. Endocr J, 2005, 52(6): 701-707. DOI:10.1507/endocrj.52.701 |
| [4] |
Zettinig G, Fueger BJ, Passler C, et al. Long-term follow-up of patients with bone metastases from differentiated thyroid carcinoma-surgery or conventional therapy?[J]. Clin Endocrinol, 2002, 56(3): 377-382. DOI:10.1046/j.1365-2265.2002.01482.x |
| [5] |
Hindie E, Zanotti-Fregonara P, Keller I, et al. Bone metastases of differentiated thyroid cancer: impact of early 131I-based detection on outcome
[J]. Endocr Relat Cancer, 2007, 14(3): 799-807. DOI:10.1677/ERC-07-0120 |
| [6] |
Mazziotti G, Formenti AM, Panarotto MB, et al. Real-life management and outcome of thyroid carcinoma-related bone metastases: results from a nationwide multicenter experience[J]. Endocrine, 2018, 59(1): 90-101. DOI:10.1007/s12020-017-1455-6 |
| [7] |
Petrich T, Widjaja A, Musholt TJ, et al. Outcome after radioiodine therapy in 107 patients with differentiated thyroid carcinoma and initial bone metastases: side-effects and influence of age[J]. Eur J Nucl Med, 2001, 28(2): 203-208. DOI:10.1007/s002590000420 |
| [8] |
Qiu ZL, Song HJ, Xu YH, et al. Efficacy and survival analysis of 131I therapy for bone metastases from differentiated thyroid cancer
[J]. J Clin Endocrinol Metab, 2011, 96(10): 3078-3086. DOI:10.1210/jc.2011-0093 |
| [9] |
Wu D, Gomes Lima CJ, Moreau SL, et al. Improved survival after multimodal approach with 131I treatment in patients with bone metastases secondary to differentiated thyroid cancer
[J]. Thyroid, 2019, 29(7): 971-978. DOI:10.1089/thy.2018.0582 |
| [10] |
Farooki A, Leung V, Tala H, et al. Skeletal-related events due to bone metastases from differentiated thyroid cancer[J]. J Clin Endocrinol Metab, 2012, 97(7): 2433-2439. DOI:10.1210/jc.2012-1169 |
| [11] |
陈春晖, 贾茹, 陈飚. 131I甲状腺癌治疗住院管理及放射防护状况调查
[J]. 中国辐射卫生, 2022, 31(1): 64-69. Chen CH, Jia R, Chen B. An investigation of hospitalization management and radiation protection in 131I treatment for thyroid cancer [J]. Chin J Radiol Health, 2022, 31(1): 64-69. DOI:10.13491/j.issn.1004-714X.2022.01.012 |
| [12] |
Bernier MO, Leenhardt L, Hoang C, et al. Survival and therapeutic modalities in patients with bone metastases of differentiated thyroid carcinomas[J]. J Clin Endocrinol Metab, 2001, 86(4): 1568-1573. DOI:10.1210/jcem.86.4.7390 |
| [13] |
Proye CAG, Dromer DHR, Carnaille BM, et al. Is it still worthwhile to treat bone metastases from differentiated thyroid carcinoma with radioactive iodine?[J]. World J Surg, 1992, 16(4): 640-645. DOI:10.1007/BF02067343 |
| [14] |
Mishra A, Kumar C, Chand G, et al. Long-term outcome of follicular thyroid carcinoma in patients undergoing surgical intervention for skeletal metastases[J]. World J Surg, 2016, 40(3): 562-569. DOI:10.1007/s00268-016-3402-8 |
| [15] |
Cazzato RL, Bonichon F, Buy X, et al. Over ten years of single-institution experience in percutaneous image-guided treatment of bone metastases from differentiated thyroid cancer[J]. Eur J Surg Oncol, 2015, 41(9): 1247-1255. DOI:10.1016/j.ejso.2015.06.005 |
| [16] |
Eustatia-Rutten CFA, Romijn JA, Guijt MJ, et al. Outcome of palliative embolization of bone metastases in differentiated thyroid carcinoma[J]. J Clin Endocrinol Metab, 2003, 88(7): 3184-3189. DOI:10.1210/jc.2003-030231 |
| [17] |
Andrade F, Probstner D, Decnop M, et al. The impact of zoledronic acid and radioactive iodine therapy on morbi-mortality of patients with bone metastases of thyroid cancer derived from follicular cells[J]. Eur Thyroid J, 2019, 8(1): 46-55. DOI:10.1159/000493190 |
| [18] |
Song HJ, Wu CG, Xue YL, et al. Percutaneous osteoplasty combined with radioiodine therapy as a treatment for bone metastasis developing after differentiated thyroid carcinoma[J]. Clin Nucl Med, 2012, 37(6): e129-e133. DOI:10.1097/RLU.0b013e31824786d0 |
| [19] |
Jannin A, Lamartina L, Moutarde C, et al. Bone metastases from differentiated thyroid carcinoma: heterogenous tumor response to radioactive Iodine therapy and overall survival[J]. Eur J Nucl Med Mol Imaging, 2022, 49(7): 2401-2413. DOI:10.1007/s00259-022-05697-w |
| [20] |
Choi YM, Kim WG, Kwon H, et al. Early prognostic factors at the time of diagnosis of bone metastasis in patients with bone metastases of differentiated thyroid carcinoma[J]. Eur J Endocrinol, 2016, 175(3): 165-172. DOI:10.1530/EJE-16-0237 |
| [21] |
Beasley NJP, Lee J, Eski S, et al. Impact of nodal metastases on prognosis in patients with well-differentiated thyroid cancer[J]. Arch Otolaryngol Head Neck Surg, 2002, 128(7): 825-828. DOI:10.1001/archotol.128.7.825 |
| [22] |
Wada N, Masudo K, Nakayama H, et al. Clinical outcomes in older or younger patients with papillary thyroid carcinoma: impact of lymphadenopathy and patient age[J]. Eur J Surg Oncol, 2008, 34(2): 202-207. DOI:10.1016/j.ejso.2007.10.001 |
| [23] |
Bardet S, Malville E, Rame JP, et al. Macroscopic lymph-node involvement and neck dissection predict lymph-node recurrence in papillary thyroid carcinoma[J]. Eur J Endocrinol, 2008, 158(4): 551-560. DOI:10.1530/EJE-07-0603 |
| [24] |
Wada N, Suganuma N, Nakayama H, et al. Microscopic regional lymph node status in papillary thyroid carcinoma with and without lymphadenopathy and its relation to outcomes[J]. Langenbecks Arch Surg, 2007, 392(4): 417-422. DOI:10.1007/s00423-007-0159-4 |
| [25] |
Gillanders SL, O'Neill JP. Prognostic markers in well differentiated papillary and follicular thyroid cancer (WDTC)[J]. Eur J Surg Oncol, 2018, 44(3): 286-296. DOI:10.1016/j.ejso.2017.07.013 |
| [26] |
许艳红, 宋红俊, 邱忠领, 等. 以骨转移为首发症状的分化型甲状腺癌的临床特征与生存分析[J]. 肿瘤, 2011, 31(6): 538-541. Xu YH, Song HJ, Qiu ZL, et al. Differentiated thyroid carcinoma patients with bone metastasis as the initial presentation: clinical characteristics and survival analysis[J]. Tumor, 2011, 31(6): 538-541. DOI:10.3781/j.issn.1000-7431.2011.06.012 |
| [27] |
Orita Y, Sugitani I, Matsuura M, et al. Prognostic factors and the therapeutic strategy for patients with bone metastasis from differentiated thyroid carcinoma[J]. Surgery, 2010, 147(3): 424-431. DOI:10.1016/j.surg.2009.10.009 |




