放射治疗是治疗肿瘤的主要手段,约60%~70%的肿瘤患者均需要接受不同程度的放射治疗[1-2]。由于电离辐射存在损伤效应,在肿瘤剂量足够的同时,应尽可能减少正常组织受量,保证疗效并降低辐射损伤。由于呼吸运动、心脏及大血管搏动、胃肠蠕动等生理性活动导致肿瘤的移位、变形,严重影响临床靶区勾画结果[3]。
呼吸运动对胸部肿瘤勾画的影响最为显著。常规CT扫描的只是某一呼吸时相的肿瘤静止状态,不能代表整个呼吸过程中位置改变。四维CT(four-dimensional computed tomography,4D CT)技术与传统CT相比引入了时间维度,能够动态地捕捉患者呼吸规律,通过绘制平稳的呼吸波形采集患者整个呼吸周期的CT图像,为运动肿瘤靶区的勾画提供了更为准确的估计手段。四维CT有多种呼吸信号采集方式,其中包括GE公司的锡丝标记方法,还有美国瓦里安公司的图像实时位置管理系统(real time position management, RPM)等。本研究探讨GE锡丝标记法和RPM法对于运动靶区勾画精度的影响,旨在选择较为精确的图像采集方式,为临床运动靶区勾画提供科学参考。
1 材料与方法 1.1 材料及设备① CIRS 008PL呼吸运动平台,该装置能够自主设置运动的周期和振幅,在主平台上放置检测模体,同时连接一个独立控制的模拟呼吸信号平台,通过与主平台运动周期一致的上下移动来模拟呼吸运动。② GE Discovery 590RT大孔径4D CT模拟定位机完成四维图像信息采集。③ CIRS编号038-05边长为6.35 cm正方体(中心含不同密度直径为3 cm的均匀球体)作为检测模体,用来模拟2种不同大小不同形状的运动肿瘤。
1.2 模拟呼吸运动及靶区移动将检测模体置于主平台上,通过运动控制软件设置不同呼吸周期、不同呼吸幅度的肿瘤运动状态,分别设定沿头脚方向以±5 mm、±10 mm、±15 mm的幅度做周期为3 s、4 s和5 s的规律运动。利用2种呼吸信号采集方式:① 第一种方式为RPM系统,利用红外线摄影装置追踪置于运动平台上模块的荧光标记点的运动轨迹,收集呼吸波形信号,本研究简称其为RPM法。具体步骤为在小平台上放置一个含有红外荧光点的模块,扫描床尾部放置红外线发射器和接收红外信号的摄像机来采集荧光模块的运动轨迹,由专用计算机将荧光模块的运动轨迹转换为患者的呼吸信号,CT设备接收到RPM系统的呼吸信号后采集数据。② 第二种方式为GE自带呼吸信号采集方法,本研究简称GE法,具体步骤为在小平台上固定一段锡丝,GE模拟机在扫描过程中探测锡丝信号,根据锡丝位移变化绘制呼吸曲线,由GE四维工作站采集并重建运动图像。
2 种方法均是利用激光定位系统对准检测模体,规则运动状态下采用大孔径CT模拟定位机行四维扫描,扫描范围大于模体运动范围,重建层厚2.5 mm,四维CT工作站依据呼吸曲线,将一个完整呼吸周期的图像序列平均分成10个呼吸时相,指定T0为吸气末时相,T5为呼气末时相。然后重建最大密度投影图像序列,用于靶区勾画。
1.3 靶区勾画CT扫描图像重建完成后上传至Eclipse13.6放疗计划系统进行靶区勾画及体积计算工作,在MIP图像序列中勾画正方体及球体轮廓作为靶区。为提高靶区勾画准确性,由同一位高年资医师勾画所有图像序列,勾画条件统一处理,窗宽窗位保持一致。在传统CT扫描图像中勾画静止状态下正方体靶区与球体靶区,比较勾画体积与静止理论体积差异(均 < 1%),保证后续勾画准确性。其中每个运动状态勾画3次,测量体积求均值,以降低勾画随机误差。
1.4 统计分析本研究采用 SPSS 22.0 统计软件进行分析。数据经正态性检验符合正态分布,用
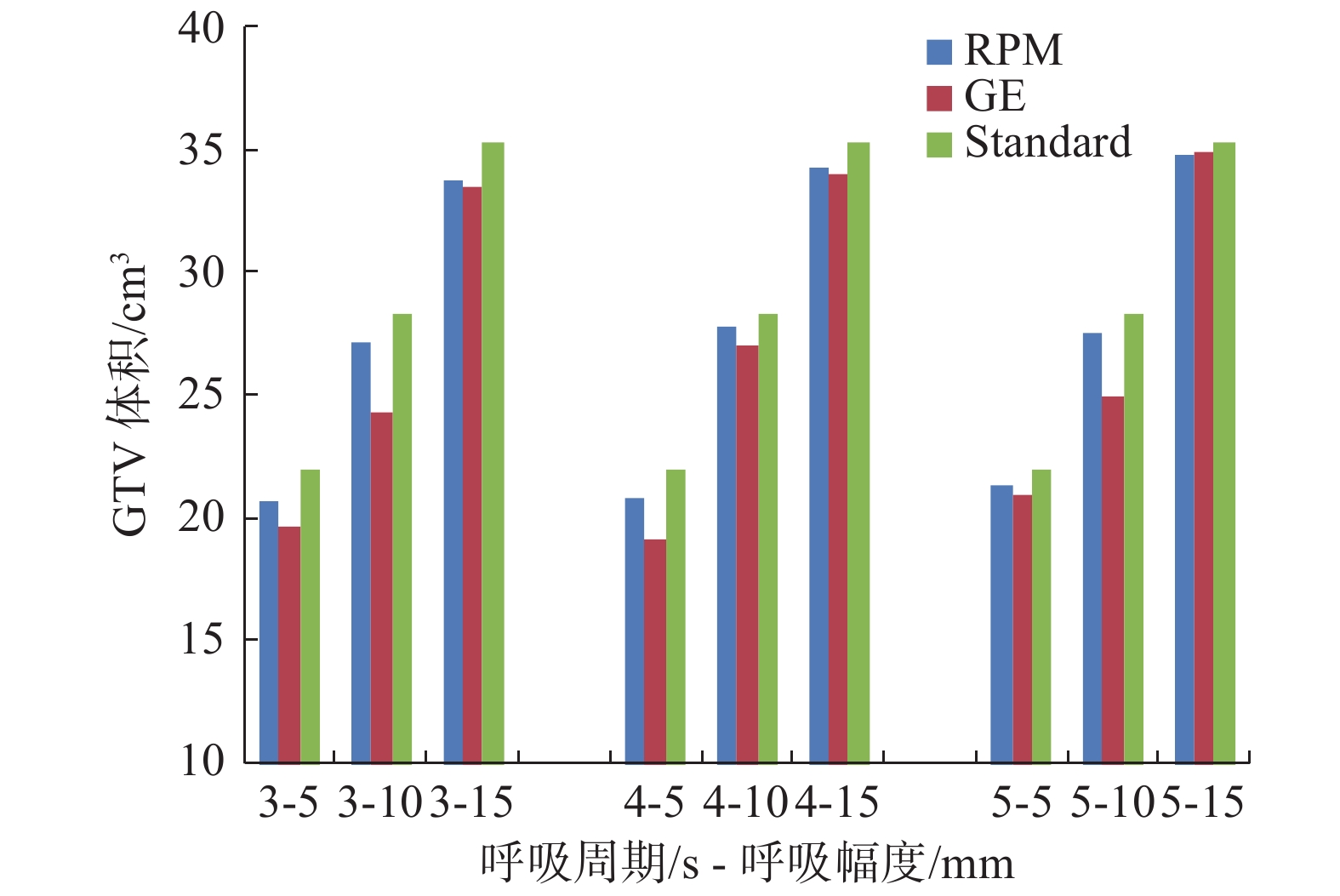
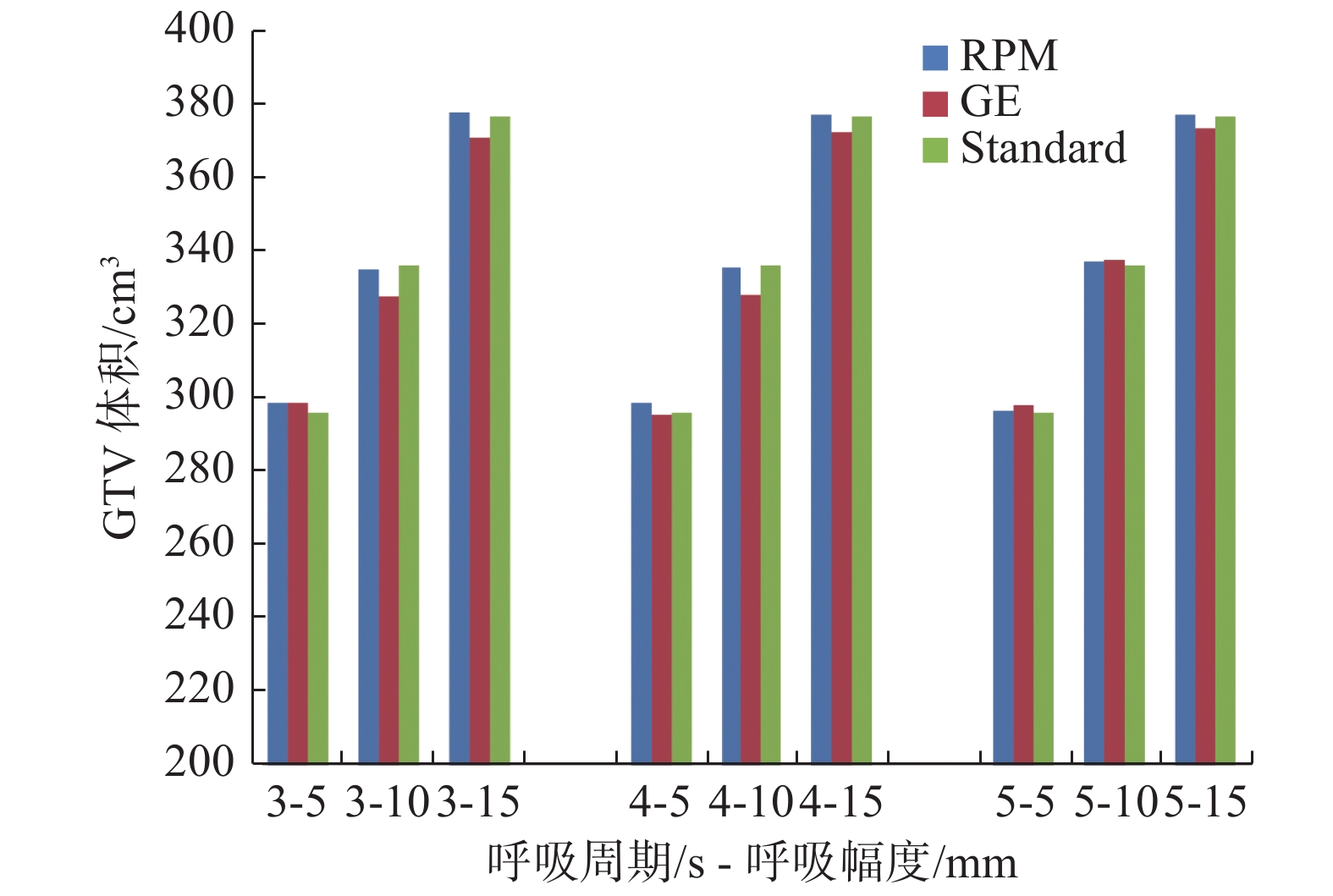
不同呼吸状态下球体和正方体靶区重建体积具体见表1,与理论计算结果比较见图1和图2。在呼吸周期相同条件下,随着头脚方向呼吸幅度增大,肿瘤出现的范围增大,运动靶区重建体积增大。在振幅为5~15 mm,球体靶区运动与静止体积变化在50%~150%;正方体靶区体积变化在16%~47%。相同呼吸幅度,不同呼吸频率的重建体积差异相对较小。
|
|
表 1 不同呼吸呼吸信号采集方式下球体和正方体靶区重建体积 Table 1 Reconstructed volumes with different respiratory signal acquisition methods for sphere and cube targets |
|
图 1 球体靶区在不同呼吸状态下重建体积与理论运动体积比较 Figure 1 Comparison of reconstructed volume and theoretical moving volume of sphere target under different breathing states |
|
图 2 正方体靶区在不同呼吸状态下重建体积与理论运动体积比较 Figure 2 Comparison of reconstructed volume and theoretical moving volume of cube target under different breathing states |
不同靶区不同呼吸周期RPM法与GE法重建体积及其与理论运动体积差异的统计结果见表2。对于球体小靶区而言,RPM法重建体积与理论运动体积偏差在−1.5%~5.7%;GE法重建体积与理论运动体积偏差在−1.3%~−13.8%。对于正方体大靶区,RPM法重建体积与理论运动体积偏差在0.2%~0.9%;GE法重建体积与理论运动体积偏差在−2.6%~0.9%。结果显示,对于小体积的球体靶区,RPM法重建得到的图像所勾画的靶区体积与理论运动体积差异有统计学意义(t = −7.570,P < 0.05)。GE法重建得到的图像所勾画的靶区体积与理论运动体积差异有统计学意义( t = −5.253,P < 0.05)。2种方法结果均普遍偏小;对于相对大体积的正方体靶区,RPM法和GE法两者重建得到的图像所勾画的靶区体积与理论运动体积相比差异均无统计学意义( P > 0.05)。
|
|
表 2 不同靶区不同呼吸周期RPM法与GE法重建体积与理论运动体积比较 Table 2 Comparison of reconstruction volume and theoretical moving volume of targets in different respiratory periods using RPM method and GE method |
具体结果如表3。分析可见,无论是对于小体积球体靶区还是相对大体积的正方体靶区而言,GE法图像重建误差均高于RPM法,两者差异有统计学意义(t = 2.990,2.943,P < 0.05);总体来讲,2种方法的重建效果差异明显,有统计学意义( t = 3.220,P < 0.05)。
|
|
表 3 RPM法与GE法重建体积偏差△V绝对值比较(
|
GTV指临床可见的、可通过临床诊断检查手段确定的肿瘤范围,是靶区勾画的起始和放射治疗的基础,通常基于CT图像确定[4]。一般根据群体平均值或临床经验值确定一定外放范围最终得到治疗所用PTV靶区,但无法解决运动伪影导致的剂量偏差[5]。对于运动肿瘤而言,存在极大的过度照射或欠量照射风险[6]:若靶区不确定度外扩范围小于其真实运动轨迹,会使靶区边缘剂量不足而降低疗效,增大复发风险;若外扩范围大于其真实运动轨迹,则会增加不必要的正常组织受量。Erridge等[7]利用EPID系统动态监测25例肺癌患者肿瘤运动情况,发现肿瘤在头脚方向的位移较大,达(12.5 ± 7.3) cm。有研究显示,运动靶区CT图像重建的体积变化在常规呼吸运动范围内可能达到67%[8]。本研究实验条件下模拟的正方体靶区运动体积与静止体积相比,偏差最大达47%,而体积较小的球体靶区偏差则达150%。偏差结果受靶区体积与呼吸幅度影响较大。
精确放疗首先要保证靶区勾画精确[9-10],对靶区外扩范围的估计也更为严格苛刻。4DCT可以采集整个呼吸周期的图像[11],该技术的出现很好地解决了靶区运动带来的不确定性问题[12]。其中最大密度投影(maximal intensity projection,MIP)序列是所有图像序列的最大密度投影集合,涵盖整个呼吸过程中肿瘤运动的最大范围,对于与周围组织密度相差较大或距离较远的病灶,能很好地显示肿瘤位移信息[13]。本研究利用RPM法和GE法分别进行图像重建,两者均有相应的不足之处。其中,RPM系统探测并记录到荧光标记挡块的运动是一维矢量,会丢失靶区部分运动信息[14]。RPM法耗时、出束时间长,操作较GE法复杂,对咳嗽等不规律的呼吸信号较为敏感。Mizuno等[15]研究显示,当呼吸幅度 < 3 mm时,RPM系统通常检测不到呼吸信号。而对于GE法来说,重建图像的呼吸幅度小时,GE法也无法探测到锡丝的运动轨迹。并且伪影相对较重,部分容积效应更为明显,靶区边缘重建清晰度不如RPM系统,从而影响临床医生的靶区边缘确定,易引入一定的人工勾画误差。另一方面实际病人扫描时,RPM法采集的是整个扫描周期内的病人呼吸信号,而GE法仅采集了几个呼吸周期的呼吸信号,对于病人扫描过程中出现的呼吸变化,GE法就无法真实反应,从而会导致重建误差增大。当出现不规则呼吸波时2种方法的重建误差均较大,在此条件下进行GTV勾画很有可能导致肿瘤靶区边缘甚至野外复发概率增加。因此对于呼吸运动下肿瘤靶区GTV的确定,必须参考患者呼吸规律性和呼吸幅度加以修正,必要时对患者进行呼吸训练。
真实情况下肿瘤靶区边缘毛糙且形状各异,加上患者呼吸过程复杂,重建误差不可忽视[16-17]。呼吸运动中头脚方向位移最大,因此本研究模拟了头脚方向运动,真实情况下运动是三维的,运动过程中也可能会发生形变,因此运动轨迹也更加复杂[18]。本研究结果显示,实际体积较大的正方体靶区与体积小的球体靶区相比,图像重建体积误差小,因此特别提示对于小体积靶区,肿瘤体积越小,部分容积效应越大,重建误差和勾画误差也更大。另外,对于小体积靶区,根据四维CT的RPM法和GE法不同呼吸信号采集方式重建得到的MIP图像勾画的靶区体积均小于实际肿瘤体积,与真实运动体积存在一定偏差,因此在临床应用中对于小靶区的处理应更为谨慎,应适当修正扫描条件,提高分辨率,如减小扫描层厚,减少FOV等。对于大体积靶区,2 种方法重建方法与理论体积比较无明显差异。然而对于小体积靶区,考虑到重建偏差和重建图像质量,建议使用RPM法进行四维重建,以减小勾画误差。本研究模拟较为简化,肿瘤模型规则,呼吸曲线规律,无法反应真实情况,还需后续更为深入细致的研究。
| [1] |
Zubizarreta EH, Fidarova E, Healy B, et al. Need for radiotherapy in low and middle income countries - the silent crisis continues[J]. Clin Oncol, 2015, 27(2): 107-114. DOI:10.1016/j.clon.2014.10.006 |
| [2] |
刘思涵, 张大昕, 宋颖辉. PPARγ与放射治疗联合应用的前景[J]. 现代生物医学进展, 2012, 12(29): 5786-5788,5800. Liu SH, Zhang DX, Song YH. The prospect of the combination use of PPARγ and radiotherapy[J]. Prog Mod Biomed, 2012, 12(29): 5786-5788,5800. DOI:10.13241/j.cnki.pmb.2012.29.046 |
| [3] |
王银亮, 王慧涛, 郑安平, 等. TOMO-HD图像引导不同部位肿瘤放疗摆位误差的研究[J]. 中国辐射卫生, 2021, 30(3): 331-338. Wang YL, Wang HT, Zheng AP, et al. Study on setup errors for different body carcinoma radiotherapy with image guidance in TOMO-HD[J]. Chin J Radiol Health, 2021, 30(3): 331-338. DOI:10.13491/j.issn.1004-714X.2021.03.015 |
| [4] |
刘茹佳, 陈颖, 钟志鹏, 等. 两种算法在非小细胞肺癌调强放疗中的剂量学比较[J]. 中国辐射卫生, 2019, 28(6): 705-708. Liu RJ, Chen Y, Zhong ZP, et al. Dosimetric comparison of two algorithms in intensity-modulated radiation therapy for NSCLC[J]. Chin J Radiol Health, 2019, 28(6): 705-708. DOI:10.13491/j.issn.1004-714X.2019.06.029 |
| [5] |
Borm KJ, Oechsner M, Wiegandt M, et al. Moving targets in 4D-CTs versus MIP and AIP: comparison of patients data to phantom data[J]. BMC Cancer, 2018, 18(1): 760. DOI:10.1186/s12885-018-4647-4 |
| [6] |
黄玉玲, 潘纯国, 袁星星, 等. 4D-CT在肺转移瘤个体化精准放疗中的研究[J]. 实用癌症杂志, 2021, 36(12): 2007-2010. Huang YL, Pan CG, Yuan XX, et al. Internal target volume determined with 4D-CT in lung metastases[J]. Pract J Cancer, 2021, 36(12): 2007-2010. DOI:10.3969/j.issn.1001-5930.2021.12.026 |
| [7] |
Erridge SC, Seppenwoolde Y, Muller SH, et al. Portal imaging to assess set-up errors, tumor motion and tumor shrinkage during conformal radiotherapy of non-small cell lung cancer[J]. Radiother Oncol, 2003, 66(1): 75-85. DOI:10.1016/S0167-8140(02)00287-6 |
| [8] |
戴威, 邓小武, 黄劭敏, 等. 放疗靶区呼吸运动对CT模拟定位图像重建的几何体积精度的体模实验研究[J]. 中国医学物理学杂志, 2007, 24(6): 391-395,414. Dai W, Deng XW, Huang SM, et al. Precision analyzing on virtual volume by using respiration motion phantom[J]. Chin J Med Phys, 2007, 24(6): 391-395,414. DOI:10.3969/j.issn.1005-202X.2007.06.001 |
| [9] |
Zhang JJ, Srivastava S, Wang CY, et al. Clinical evaluation of 4D MRI in the delineation of gross and internal tumor volumes in comparison with 4DCT[J]. J Appl Clin Med Phys, 2019, 20(9): 51-60. DOI:10.1002/acm2.12699 |
| [10] |
Dai HD, Dong LF, Lv BW, et al. Feasibility study of permanent magnet-based tumor tracking technique for precise lung cancer radiotherapy[J]. IEEE Trans Instrum Meas, 2021, 70: 4002010. DOI:10.1109/TIM.2020.3039645 |
| [11] |
Dupre PJ, Fitzherbert CM, Hand CM, et al. A new technique using 4DCT scans to create custom cardiac blocks for left-sided breast cancer treatments[J]. Pract Radiat Oncol, 2019, 9(6): e572-e578. DOI:10.1016/j.prro.2019.06.002 |
| [12] |
McWilliam A, Lee L, Harris M, et al. Benefit of using motion compensated reconstructions for reducing inter-observer and intra-observer contouring variation for organs at risk in lung cancer patients[J]. Radiother Oncol, 2018, 126(2): 333-338. DOI:10.1016/j.radonc.2017.11.021 |
| [13] |
Koksal C, Kesen ND, Okutan M, et al. Investigation of approaches for internal target volume definition using 4-dimensional computed tomography in stereotactic body radiotherapy of lung cancer[J]. Med Dosim, 2021, 46(2): 136-142. DOI:10.1016/j.meddos.2020.10.004 |
| [14] |
Li G, Wei J, Li D, et al. SU-E-J-120: Characterization of 4D lung ventilation based on 4DCT lung density[J]. Med Phys, 2019, 39(6Part7): 3680. DOI:10.1118/1.4734956 |
| [15] |
Mizuno K, Song YL, Obcemea C. Comparison of the sensitivities of two 4DCT techniques: RPM and bellows system[J]. Int J Biomed Eng Technol, 2012, 8(2/3): 220-229. DOI:10.1504/IJBET.2012.046087 |
| [16] |
Chung H, Jung J, Jeong C, et al. Evaluation of delivered dose to a moving target by 4D dose reconstruction in gated volumetric modulated arc therapy[J]. PLoS One, 2018, 13(9): e0202765. DOI:10.1371/journal.pone.0202765 |
| [17] |
Rabe M, Thieke C, Düsberg M, et al. Real-time 4DMRI-based internal target volume definition for moving lung tumors[J]. Med Phys, 2020, 47(4): 1431-1442. DOI:10.1002/mp.14023 |
| [18] |
Chi YW, Liang J, Qin X, et al. Respiratory motion sampling in 4DCT reconstruction for radiotherapy[J]. Med Phys, 2012, 39(4): 1696-1703. DOI:10.1118/1.3691174 |




