胶质瘤是最常见的颅内肿瘤,其发病率为5/10万~8/10万[1]。自20世纪80年代以来,全球胶质瘤发病率呈上升趋势,造成了极大疾病、经济和社会负担[2]。胶质母细胞瘤属于世界卫生组织(WHO)分级标准中的4级胶质瘤,是成人最常见、侵袭性最强、恶性程度最高的原发性脑部肿瘤,约占全部中枢神经系统原发性恶性肿瘤患者的77%~81%、全部胶质瘤病例的54%、约占全部原发性脑部肿瘤患者的16%[3]。流行病学数据显示,胶质母细胞瘤年发病率在0.59/10万~5/10万,且全球发病率呈上升趋势[4]。胶质母细胞瘤恶性程度高、疗效差、生存期短,一般患者中位生存期仅为9个月、接受手术治疗和辅助放化疗标准治疗患者中位生存期可延伸至15~16个月,5年生存率仅为7.2%[5-7]。
胶质母细胞瘤高侵袭性、遗传异质性及血脑屏障保护等因素对胶质母细胞瘤治疗造成了巨大挑战[8]。目前,手术及术后放化疗是胶质母细胞瘤的标准治疗方案[9],最大范围安全切除肿瘤、术后替莫唑胺同步放疗加辅助化疗是我国目前推荐的成人新诊断胶质母细胞瘤标准治疗方案[10]。外科手术切除病灶后放疗是胶质母细胞瘤治疗的必要手段,但照射靶区范围尚无统一方案[11]。本研究对2017 年12月至2021 年7月本院收治的29例胶质母细胞瘤患者临床资料进行回顾性分析,以评估脑胶质母细胞瘤术后照射缩小靶区放疗方案的疗效。
1 对象与方法 1.1 研究对象以2017 年12月—2021 年7月在厦门大学附属中山医院肿瘤放疗科收治的胶质母细胞瘤患者作为研究对象。病例纳入标准:① 按照WHO中枢神经系统肿瘤分类标准[12],经术后病理确诊为胶质母细胞瘤,并进行组织学基因检测明确为IDH1/2野生型、1p19q无联合缺失、MGMT无甲基化;② 接受最大安全肿瘤切除术,根据术后复查脑 MRI 评估肿瘤切除程度分为全切除(> 95%)、次全切除 (80%~95%) 和部分切除(< 80%);③ 在术后6周内能够开始实施同步放化疗,且完成标准同步放化疗和序贯化疗疗程[13]。排除病例资料不全、术后未能完成同步放化疗和序贯化疗疗程患者。
本研究经厦门大学附属中山医院医学伦理委员会审核通过。实验操作均符合《赫尔辛基宣言》和《涉及人的生物医学研究伦理审查办法》中的相关规定。
1.2 治疗方法 1.2.1 手术治疗按照中枢神经肿瘤手术治疗操作规范实施最大安全肿瘤切除术,术后复查颅脑MRI(图1),以评估肿瘤切除范围。
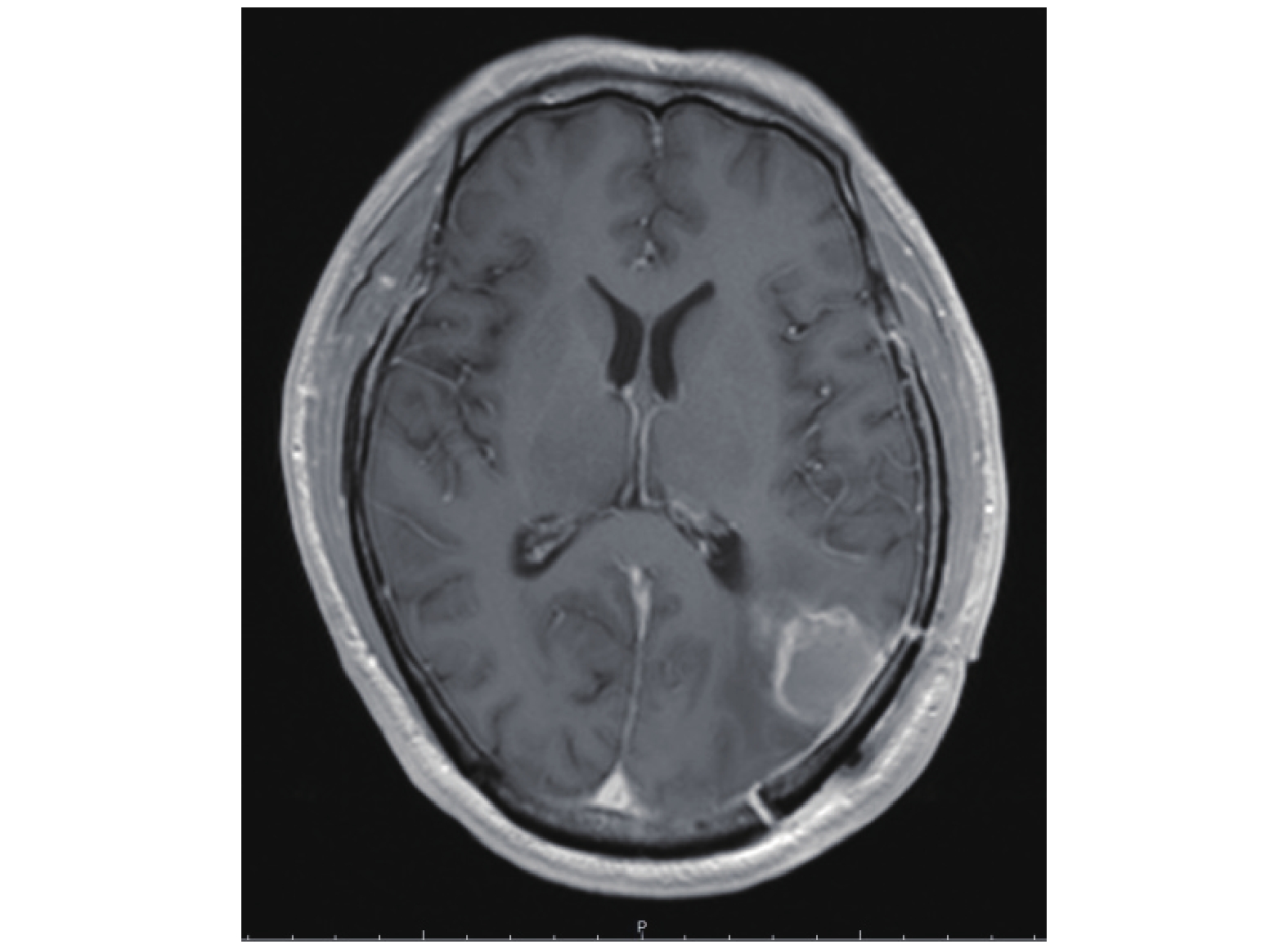
|
图 1 术后T1加权脑部MRI扫描成像 Figure 1 Postoperative T1-weighted brain MRI image |
根据患者术后体力状态和手术切口愈合情况,自术后3~6 周内开始启动实施辅助放疗。患者头膜固定后CT模拟定位,螺旋扫描层厚3 mm(图2)。将CT图像导入放疗计划系统,将患者术后脑 MRI 图像导入治疗计划系统,并与定位CT图像融合后完成图像重建。参考患者术前术后影像资料,在治疗计划系统融合后的图像上进行靶区勾画(图3),包括肿瘤靶区(gross tumor volume,GTV)、临床靶区(clinical target volume,CTV)和危及器官(脑干、晶体、视神经、视交叉、眼球、脊髓等)。靶区设计:GTV包括术后瘤腔、残留灶,CTV指GTV外扩2.5 cm根据危及器官和解剖结构适当修正后的区域,计划肿瘤靶区(PGTV)和计划亚临床靶区(PCTV)为 GTV和CTV外放 3 mm后产生。计划设计:放疗计划满足95%计划靶体积,PGTV 60 Gy/30次,PCTV 54 Gy/30次。危及器官限量:脑干、视神经和视交叉最大点剂量 < 54 Gy,脊髓最大点剂量< 45 Gy,晶体最大点剂量< 8 Gy。PGTV和PCTV采用调强放射治疗(IMRT)同步加量,每次分割剂量为2.0 Gy和1.8 Gy,每周照射5次,共30次 [14]。
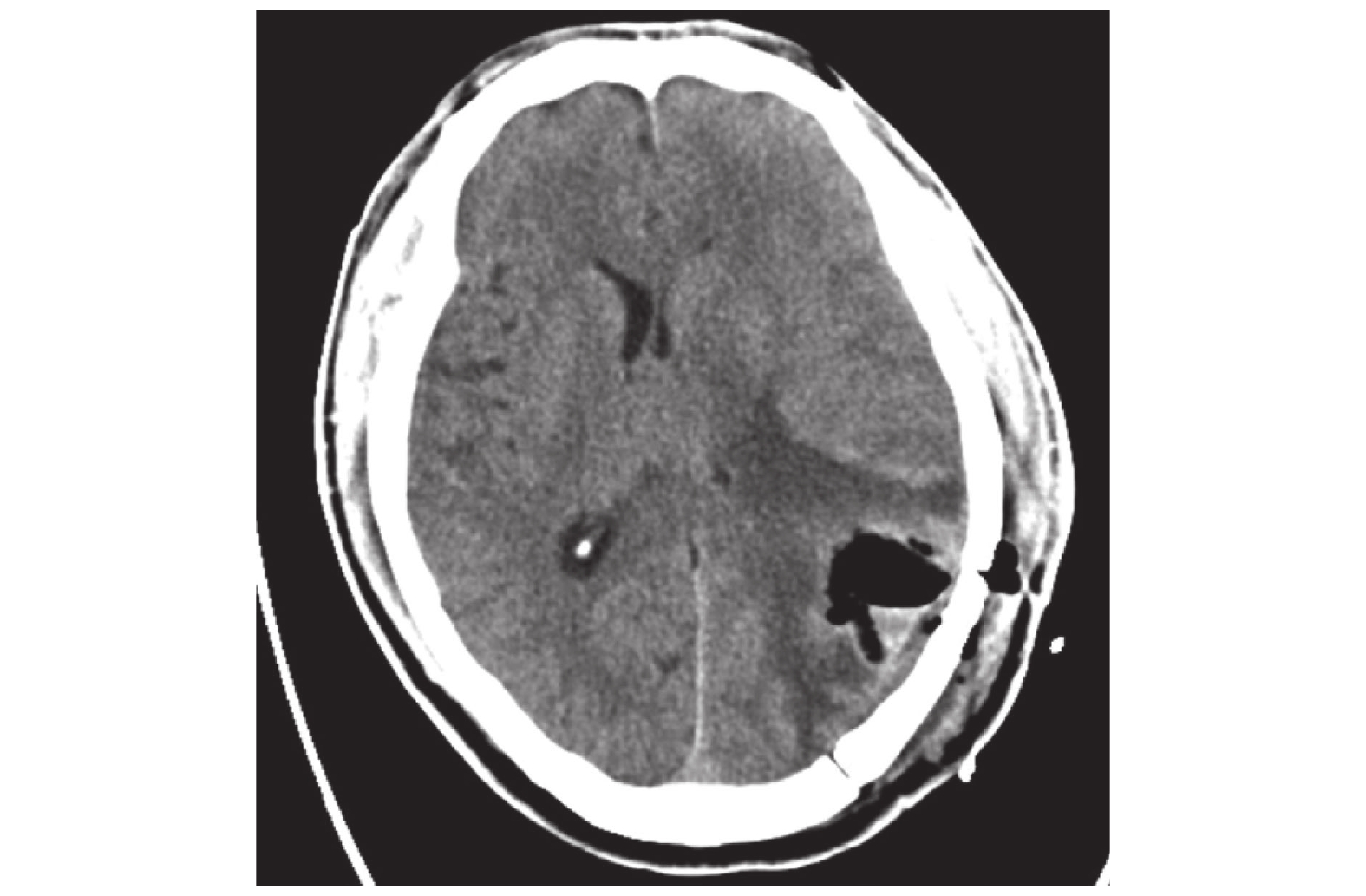
|
图 2 术后脑部CT扫描成像 Figure 2 Postoperative brain CT image |
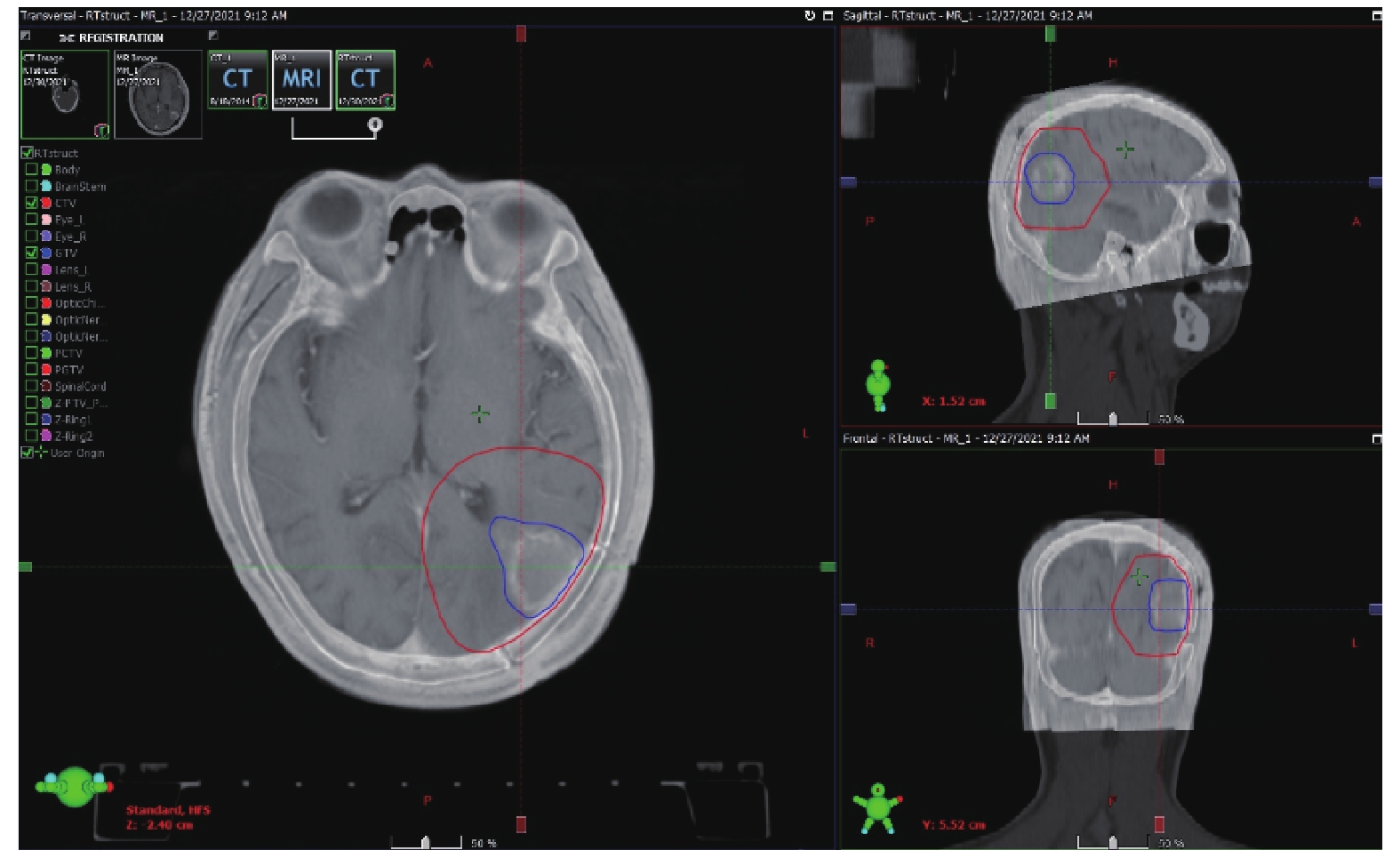
|
图 3 放疗靶区勾画 Figure 3 Delineation of radiotherapy target volume |
所有入组患者均采用放疗同步替莫唑胺化疗后序贯替莫唑胺辅助化疗方案。同步放疗期间每日口服替莫唑胺75 mg/m2,放疗后4周开始服用替莫唑胺,第1周期每日剂量150 mg/m2,共5 d;若可耐受,调整日疗程为200 mg/m2,共5 d。每28 d为一个周期,共服用6个周期。
1.2.4 疗效评价采用电话、门诊复诊和住院等方式对患者进行随访,随访内容包括生活状态、不良反应和肿瘤复发等。随访终点事件为肿瘤复发。无进展生存期(PFS)定义为患者手术之日到患者首次影像学证实出现颅内病灶进展或肿瘤复发的间隔时间,且需排除假性颅内病灶进展和放射性脑坏死 。
2 结 果 2.1 患者基本情况共有29例符合病例纳入和排除标准的胶质母细胞瘤患者纳入本研究。其中男性16例、女性13例;年龄24~74岁,中位年龄53岁;病灶位于左侧大脑10例,位于右侧大脑19例;22例患者行病灶全切除术和次全切除术,7例患者行部分病灶切除术。
2.2 生存期分析随访至2022年3月。29例胶质母细胞瘤患者中,3例无复发生存,无复发生存期分别为52、20、19个月(图4)。26例复发胶质母细胞瘤患者中,无CTV内复发;25例GTV内复发,其中3例同时伴颅内播散;另1例仅表现为颅内播散无GTV内复发,中位PFS为7个月(4~15个月)。3例GTV内复发同时伴颅内播散的胶质母细胞瘤患者中,1例原发灶在右额顶叶、转移灶在右枕叶,1例原发灶在右枕叶、转移灶在小脑多发,1例原发灶在左额叶、转移灶在右额叶。无GTV复发而出现颅内转移的胶质母细胞瘤患者原发灶在右额叶、转移灶在右桥脑小脑角。行部分切除术的7例胶质母细胞瘤患者PFS为4~5个月,行全切除术和次全切除术者PFS为6~15个月,3例无复发生存者均行全切除术。

|
图 4 29例胶质母细胞瘤患者无进展生存期 Figure 4 Progression-free survival of 29 patients with glioblastoma |
原发性脑胶质母细胞瘤是最常见的原发性恶性中枢神经系统肿瘤,恶性程度高且治疗困难[3]。2016年WHO中枢神经系统肿瘤分类方案反映出胶质母细胞瘤病理学和分子病理学进展,IDH1/2野生型、1p19q无联合缺失和MGMT无甲基化提示高度恶性和预后不良的胶质母细胞瘤[15]。对于新诊断胶质母细胞瘤,目前我国临床指南推荐标准治疗方案是手术、术后替莫唑胺同步放化疗和替莫唑胺序贯化疗[11]。
放射治疗是高级别脑胶质瘤的标准疗法,对于术后放疗靶区目前并未统一标准[16]。目前,主要有欧洲癌症研究与治疗组织(EORCT)和美国肿瘤放射治疗协作组(RTOG)2种勾画方法,其照射范围略有不同,但2种靶区勾画方式在疗效上并无显著差异[17]。Chang等[18]将48例胶质母细胞瘤患者GTV外扩2.5 cm为CTV,针对GTV和CTV分别给予 60 Gy/30次和50 Gy/25次照射剂量,局部失败方式与 RTOG 设定方法类似,结果野边缘和野外复发率均为10.0%。本研究采用了罗学臣等[19]描述的靶区勾画方法,对29例胶质母细胞瘤患者随诊发现,复发患者主要是GTV内复发、未发现CTV内复发,提示同步放化疗 54 Gy/30次分割剂量对瘤腔和残留灶外的亚临床区域可能足够而不需要 60 Gy剂量,放弃瘤周水肿带照射亦并未增加胶质母细胞瘤复发率;而较高GTV失败率提示60 Gy剂量不足以控制瘤腔和残留灶。既往广大学者在提高照射剂量上进行了不同探索。Chang等[20]研究发现,更高放疗剂量70 Gy/(8~9周)较常规放疗60 Gy/(6~7周) + 推量10 Gy/(1~2周)并未在恶性胶质瘤患者中显示显著获益。Chan等[21]用三维适形放疗技术将剂量提高到90 Gy,随访11.7个月高级别胶质瘤复发率为 67.6%(23/34),肿瘤控制率仍不满意。Monjazeb等[22]等采用增加剂量分割模式将日剂量提高至2.5 Gy(1.8 Gy/次 + 推量0.7 Gy),总剂量分别增加至70、75、80 Gy,不同剂量组新诊断胶质母细胞瘤患者总生存期和PFS无显著差异。Souhami等[23]将203例幕上胶质母细胞瘤患者随机分为术后立体定向放疗 + 外照射放疗(60 Gy) + 卡莫司汀化疗组(80 mg/m2,每8周1~3 d,共6个周期)和外照射放疗 + 卡莫司汀化疗组,在61个月的中位随访期间,2组患者中位生存时间未见获益(13.5 vs. 13.6个月,P = 0.571)。上述诸多研究提示 60 Gy/30次剂量不足以控制胶质母细胞瘤病灶进展,在较大照射体积内提高照射剂量并不能带来生存获益。因此,需要探索精准确定肿瘤靶区的影像学技术以缩小高照射剂量体积、减少放疗毒性,并通过改变分割模式、射线种类、药物联合等多种模式提高胶质母细胞瘤局部控制,从而延长生存时间。
本研究中,胶质母细胞瘤患者中部分切除患者肿瘤复发时间明显短于次全切除和全切除者,而3例无复发生存者均为全切除术者,也提示尽最大可能全部切除肿瘤是获得最长生存期的有效途径。随着多模态MRI等影像学技术进步[24],通过精准确定肿瘤范围以指导手术切除和术后高剂量精准放疗,有望改善胶质母细胞瘤患者预后和临床结局、提高患者生活质量。
| [1] |
Ostrom QT, Gittleman H, Stetson L, et al. Epidemiology of gliomas[M]//Raizer J, Parsa A. Current Understanding and Treatment of Gliomas. Cham: Springer, 2015: 1-14. DOI: 10.1007/978-3-319-12048-5_1.
|
| [2] |
Weller M, Wick W, Aldape K, et al. Glioma[J]. Nat Rev Dis Primers, 2015, 1: 15017. DOI:10.1038/nrdp.2015.17 |
| [3] |
Wirsching HG, Galanis E, Weller M. Glioblastoma[J]. Handb Clin Neurol, 2016, 134: 381-397. DOI:10.1016/B978-0-12-802997-8.00023-2 |
| [4] |
Grech N, Dalli T, Mizzi S, et al. Rising incidence of glioblastoma multiforme in a well-defined population[J]. Cureus, 2020, 12(5): e8195. DOI:10.7759/cureus.8195 |
| [5] |
Bi WL, Beroukhim R. Beating the odds: extreme long-term survival with glioblastoma[J]. Neuro Oncol, 2014, 16(9): 1159-1160. DOI:10.1093/neuonc/nou166 |
| [6] |
Delgado-López PD, Corrales-García EM. Survival in glioblastoma: a review on the impact of treatment modalities[J]. Clin Transl Oncol, 2016, 18(11): 1062-1071. DOI:10.1007/s12094-016-1497-x |
| [7] |
Tykocki T, Eltayeb M. Ten-year survival in glioblastoma. A systematic review[J]. J Clin Neurosci, 2018, 54: 7-13. DOI:10.1016/j.jocn.2018.05.002 |
| [8] |
Nam JY, de Groot JF. Treatment of glioblastoma[J]. J Oncol Pract, 2017, 13(10): 629-638. DOI:10.1200/JOP.2017.025536 |
| [9] |
Wu W, Klockow JL, Zhang M, et al. Glioblastoma multiforme (GBM): an overview of current therapies and mechanisms of resistance[J]. Pharmacol Res, 2021, 171: 105780. DOI:10.1016/j.phrs.2021.105780 |
| [10] |
《中国中枢神经系统胶质瘤诊断和治疗指南》编写组. 中国中枢神经系统胶质瘤诊断与治疗指南(2015)[J]. 中华医学杂志, 2016, 96(7): 485-509. DOI: 10.3760/cma.j.issn.0376-2491.2016.07.003. Expert Group of Guidelines for Diagnosis and Treatment of Glioma in the Central Nervous System in China[J]. Natl Med J Chin, 2016, 96(7): 485-509. DOI: 10.3760/cma.j.issn.0376-2491.2016.07.003. |
| [11] |
中华医学会放射肿瘤治疗学分会. 胶质瘤放疗中国专家共识(2017)[J]. 中华放射肿瘤学杂志, 2018, 27(2): 123-131. Subcommittee of Tumor Radiotherapeutics, Chinese Medical Association. Expert consensus of China on radiation therapy for gliomas in 2017[J]. Chin J Radiat Oncol, 2018, 27(2): 123-131. DOI:10.3760/cma.j.issn.1004-4221.2018.02.001 |
| [12] |
Louis DN, Perry A, Wesseling P, et al. The 2021 WHO classification of tumors of the central nervous system: a summary[J]. Neuro Oncol, 2021, 23(8): 1231-1251. DOI:10.1093/neuonc/noab106 |
| [13] |
Stupp R, Mason WP, van den Bent MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J]. N Engl J Med, 2005, 352(10): 987-996. DOI:10.1056/NEJMoa043330 |
| [14] |
陈姣红, 李红燕. 三维适形放射治疗70岁以上老年食管癌临床观察[J]. 中国辐射卫生, 2016, 25(4): 500-501. Chen JH, Li HY. Clinical observation on three dimensional conformal radiotherapy for elderly patients with esophageal carcinoma at ages of over years[J]. Chin J Radiol Health, 2016, 25(4): 500-501. DOI:10.13491/j.cnki.issn.1004-714X.2016.04.046 |
| [15] |
Louis DN, Perry A, Reifenberger G, et al. WHO classification and grading of tumors of the central nervous system[M]. Lyon: IARC Press, 2016: 12-13.
|
| [16] |
Frosina G. Improving control of high-grade glioma by ultra-hyper-fractionated radiotherapy[J]. J Neurosci Res, 2022, 100(4): 933-946. DOI:10.1002/jnr.25030 |
| [17] |
Frosina G, Fontana V, Verzola D, et al. Ultra-hyper-fractionated radiotherapy for high-grade gliomas[J]. J Neurosci Res, 2021, 99(12): 3182-3203. DOI:10.1002/jnr.24929 |
| [18] |
Chang EL, Akyurek S, Avalos T, et al. Evaluation of peritumoral edema in the delineation of radiotherapy clinical target volumes for glioblastoma[J]. Int J Radiat Oncol Biol Phys, 2007, 68(1): 144-150. DOI:10.1016/j.ijrobp.2006.12.009 |
| [19] |
罗学臣, 李雪南, 沙翔燕, 等. 基于锥形束CT研究头颈部肿瘤调强放射治疗的计划靶区外放边界[J]. 中国医学装备, 2018, 15(4): 50-52. Luo XC, Li XN, Sha XY, et al. A study on the extended margin of planning target volume of intensity modulate radiotherapy for head and neck neoplasm base on CBCT[J]. Chin Med Equip, 2018, 15(4): 50-52. DOI:10.3969/J.ISSN.1672-8270.2018.04.013 |
| [20] |
Chang CH, Horton J, Schoenfeld D, et al. Comparison of postoperative radiotherapy and combined postoperative radiotherapy and chemotherapy in the multidisciplinary management of malignant gliomas. A joint radiation therapy oncology group and eastern cooperative oncology group study[J]. Cancer, 1983, 52(6): 997-1007. DOI:10.1002/1097-0142(19830915)52:6<997::aid-cncr2820520612>3.0.co;2-2 |
| [21] |
Chan JL, Lee SW, Fraass BA, et al. Survival and failure patterns of high-grade gliomas after three-dimensional conformal radiotherapy[J]. J Clin Oncol, 2002, 20(6): 1635-1642. DOI:10.1200/JCO.2002.20.6.1635 |
| [22] |
Monjazeb AM, Ayala D, Jensen C, et al. A phase I dose escalation study of hypofractionated IMRT field-in-field boost for newly diagnosed glioblastoma multiforme[J]. Int J Radiat Oncol Biol Phys, 2012, 82(2): 743-748. DOI:10.1016/j.ijrobp.2010.10.018 |
| [23] |
Souhami L, Seiferheld W, Brachman D, et al. Randomized comparison of stereotactic radiosurgery followed by conventional radiotherapy with carmustine to conventional radiotherapy with carmustine for patients with glioblastoma multiforme: report of Radiation Therapy Oncology Group 93-05 protocol[J]. Int J Radiat Oncol Biol Phys, 2004, 60(3): 853-860. DOI:10.1016/j.ijrobp.2004.04.011 |
| [24] |
余力, 刘宵雪, 闫朝阳, 等. 面向多模态MRI脑胶质瘤区域三维分割与生存期预测的级联U-Net网络[J]. 中国图象图形学报, 2022, 27(3): 850-861. Yu L, Liu XX, Yan CY, et al. Brain glioma tumor segmentation and survival prediction from multi-modality MRIs via cascaded U-Net[J]. J Image Graphics, 2022, 27(3): 850-861. DOI:10.11834/jig.210137 |




