2. 徐州医科大学徐州临床学院放疗科,江苏 徐州 221000
2. Department of Radiotherapy, Xuzhou Clinical College of Xuzhou Medical University, Xuzhou 221000 China
乳腺癌是全球女性最常见的癌症,在中国的发病率和死亡率也分别居女性恶性肿瘤的第1位和第5位[1]。放疗作为乳腺癌的综合治疗手段之一,可显著提高局部控制率及总生存率[2]。近年来,除常规分割放疗(conventional fractionation radiotherapy, CFRT),大分割放疗(hypofractionated radiotherapy, HFRT)也逐渐在临床应用。研究发现,淋巴细胞在肿瘤的发生发展中发挥着重要作用,在胶质瘤、肺癌、胰腺癌、肝癌等癌种的研究中提示淋巴细胞减少与不良预后存在密切联系[3-7],放疗可以诱导外周血淋巴细胞减少(Radiation therapye-induced lymphopenia, RIL)。一些实体瘤研究已经证实了RIL风险和严重程度与放疗分割模式、放疗技术以及照射体积等因素相关[5, 8-11]。虽然大分割放疗可明显缩短治疗疗程,但是否能降低RIL发生率尚不清晰。目前关于乳腺癌的研究中,将外周血淋巴计数与相关放疗分割模式相结合进行分析仍未像其他癌种广泛。因此本研究拟分析HFRT与CFRT在外周血淋巴细胞计数(peripheral lymphocyte count,PLC)上的差异。
1 材料与方法 1.1 一般资料回顾性分析2019年11月—2021年8月于徐州市中心医院接受保乳手术放射治疗的早期乳腺癌患者的病历资料。纳入标准:1)保乳术后;2)经病理检查证实为乳腺癌;3)TNM分期为 T1~2N0~1M0期。排除标准:1)伴有胶原性疾病者;2)同侧肢体放疗史;3)双侧乳腺癌;4)术中行乳房重建;5)炎性乳癌;6)临床资料不全。根据纳入、排除标准,共纳入40例早期乳腺癌患者,随机分为观察组(大分割放疗,n = 20)和对照组(常规分割放疗,n = 20),2组患者的临床特征比较,差异均无统计学意义(P > 0.05)( 表1),具有可比性。
|
|
表 1 40例患者的临床特征 Table 1 Baseline characteristics of the 40 patients with breast cancer |
在CT模拟机下定位并行颈部+胸部模拟CT增强扫描后传入TPS,在TPS下由科室高年资主治医师负责靶区勾画、审核并交由高年资物理师进行计划设计,审核合格后进行放疗。靶区勾画:临床靶区(clinical target volume,CTV)、危及器官(organs at risk,OAR)(心脏、左右肺、健侧乳腺、脊髓),CTV包括患侧乳腺、胸大肌筋膜(不含皮肤、胸大小肌、肋骨与肋间肌),在 CTV 基础上内界、外界与后界各外扩5 mm 得到计划靶区(planning target volume,PTV),处方剂量线覆盖95%的靶区体积。所有治疗均在Varian Truebeam电子直线加速器上进行,采用6-MV能量的X线,每日1次,每周5次。常规分割组全乳腺放疗剂量为50 Gy/25 f,瘤床区加量10 Gy,疗程6周。大分割组全乳腺放疗剂量42.56 Gy/15 f,瘤床区加量10 Gy,疗程4周。
1.2.2 观察指标在基线(开始放疗前)和开始放疗后每隔一周收集患者血常规资料,记录淋巴细胞计数。依据美国癌症常见不良反应事件评价标准(Common Terminology Criteria for Adverse Events version 4.03. ) 4.3版。放疗期间最低点的外周血淋巴细胞严重程度分级为:0级(PLC < 1.0 × 10 9/L), 1级 (0.8 × 109/L < PLC < 1.0 × 10 9/L), 2级(0.5 × 109/L < PLC < 0.8 × 10 9/L), 3级(0.2 × 109/L < PLC < 0.5 × 10 9/L), 4级 (PLC < 0.2 × 10 9/L)。
1.2.3 统计学处理采用SPSS 26.0 软件处理数据,计数资料以例数及率[n%]表示,组间比较采用χ2 检验;计量资料以均数 ± 标准差(
40例可评估患者的临床特征见表1,2组患者在年龄、肿瘤分期、受体表达等方面均无统计学差异。患者中位年龄为46岁,所有患者都已接受化疗。
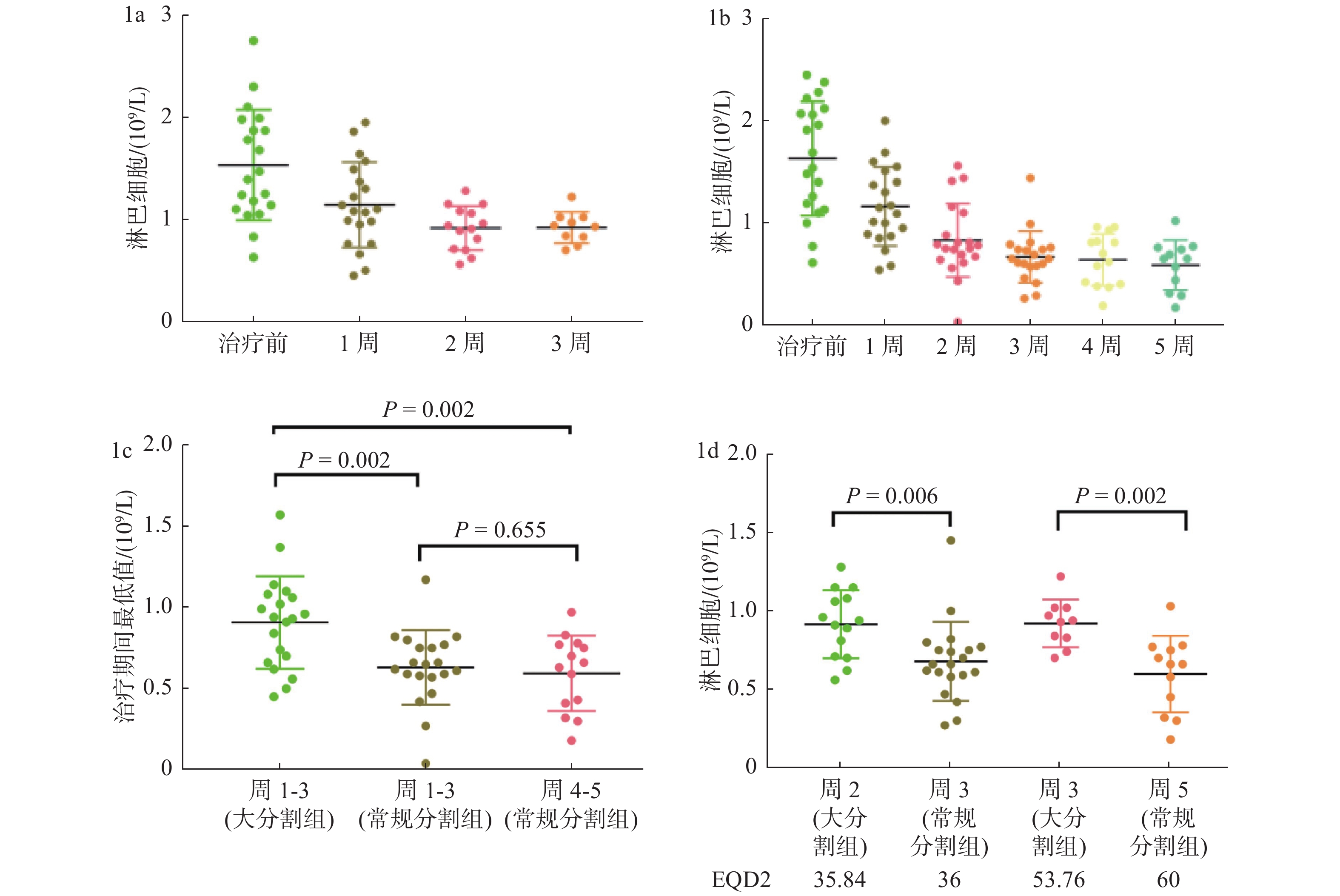
2.2 外周血淋巴细胞计数与分割关系如表2,HFRT组和CFRT组的基线PLC平均值无差异。在放疗期间,2组的PLC在放疗期间稳定下降,在放疗接近结束时达到最低值。(图1a和1b)。
|
图 1 大分割放疗组与常规分割组外周淋巴细胞计数随时间变化趋势及不同时间点的比较 Figure 1 Changing trend of peripheral blood lymphocyte count over time in the two groups and comparison between different time points |
|
|
表 2 外周血淋巴细胞计数与放疗分割 Table 2 Relationship between peripheral blood lymphocyte count and fractionated radiotherapy |
2组放疗前3周外周淋巴细胞值平均最低点大分割组高于常规分割组。大分割放疗前3周的平均最低点PLC不仅高于常规分割的前3周,也高于常规分割组后2周的平均最低点PLC(图1c)。尽管HFRT第二周和CFRT第三周之间,以及HFRT第三周和CFRT第五周之间淋巴细胞的生物等效剂量相似(假设α/β = 10),在这2种情况下,HFRT组的平均最低点PLC显著高于CFRT组:分别为0.917 5×109/L vs 0.678 5 × 109/L(P < 0.05)以及0.921 × 10 9/L vs 0.598 3 × 109/L(P < 0.05)( 图1d)。大分割放射治疗期间的最低外周血淋巴细胞计数与基线阶段的比值明显高于常规分割(0.64 ± 0.24 vs 0.38 ± 0.21, P < 0.05)。
2.3 淋巴细胞减少及其危险因素放疗前,40例患者中有4例(10.0%)出现基线淋巴细胞减少;HFRT组和CFRT组的基线淋巴细胞减少患者例数相同,每组各2例。共有33例 (82.5%) 患者在放射治疗期间出现淋巴细胞减少:6例 (18.1%) 患者为1级,18例 (54.5%) 为2级,7(21.2%) 例为3级,2例(6.0%)为4级。HFRT组淋巴细胞减少的发生率低于CFRT组(32.5% vs 50.0%),但差异无统计学意义(P > 0.05)。将患者放疗期间淋巴细胞最低值以0.5 × 10 9(CTCAE2级毒性)为标准分为2组。2组患者在T分期、腋窝淋巴结个数2个临床指标中差异有统计学意义(P < 0.05),而在年龄、肿瘤偏侧、激素受体等指标中差异无统计学意义( P > 0.05)。( 表3)
|
|
表 3 乳腺癌患者放疗期间淋巴细胞最低值与临床病理资料的关系 Table 3 Relationship between lymphocyte nadir during radiotherapy and clinicopathological factors in patients with breast cancer |
淋巴细胞作为机体免疫的重要组成成分,在肿瘤的发生发展中发挥着重要作用。研究证明,淋巴细胞在免疫监视中通过发挥细胞毒性及诱导细胞凋亡的作用来抑制肿瘤的进展和转移[12-13,17]。一些关于实体瘤的研究发现[5, 9] ,放疗会导致外周血淋巴细胞减少,而淋巴细胞减少与不良预后密切相关,如在食管癌新辅助放化疗的患者中,发生4级淋巴细胞减少患者的无远处转移生存率显著低于1~3级的患者。在接受放疗的晚期胰腺癌患者中也发现,发生中重度淋巴细胞减少的患者的中位生存期也低于未发生的患者。放疗分割次数又是严重辐射相关淋巴细胞减少的一个重要预测因子。本研究目的是为观察乳腺癌放疗患者在不同分割模式下不同时段外周血淋巴细胞计数的变化。
在本研究中,有33名(82.5%)患者在放射治疗期间出现淋巴细胞减少,但大都程度较轻,多数为1~2级,4例患者发生3~4级淋巴结减少。虽然乳腺癌相较于肺癌、食管癌等可导致RIL发生的危及器官接受辐射剂量较低。但自1916年RIL这个概念被提出后大量的研究发现,RIL发生的机制之一为循环淋巴细胞的消耗,即RIL这一现象可在任何解剖部位照射后出现。如乳房和大脑这类含有很少的骨髓和淋巴组织的器官在接受放疗后也会出现淋巴细胞减少[14]。在本研究中,外周淋巴细胞计数在放射治疗期间呈稳步下降趋势,在放射治疗的最后一周达到最低点。这类趋势在接受放射治疗5周的食管癌患者中也有发生。以往的研究证明,RIL发生风险与放疗分割相关,减少放疗次数可以减少循环血液的暴露,保护循环淋巴细胞[9]。如Yovino的研究组对循环血液接受的放疗剂量进行建模,计算了循环血液中淋巴细胞所接受的照射剂量,结果显示在单次放疗(2 Gy)后有5%的循环细胞受到了0.5 Gy的照射,而随着放疗分割次数的增加,在接受10次、20次和30次放疗后则分别有62%、92%和99%的循环血液接受了至少0.5 Gy的照射,这项模型提示RIL与放疗分割相关[15] 。在MacLennan和Kay对接受预防性头颅照射的急性淋巴细胞白血病儿童进行的前瞻性研究中,治疗的总剂量恒定在24 Gy,但放疗次数由研究人员决定,范围为5到15次,这项研究观察到每增加一次放疗次数,放疗后的淋巴细胞计数会下降7%至8%[16]。Zhao等人发现,在非小细胞肺癌患者中,总体治疗时间(OTT)为4周的HFRT患者的3~4级淋巴细胞减少发生率明显低于OTT大于4周的患者。在一项关于晚期胰腺癌放疗的研究中发现,接受低分割方案放疗的患者发生重度RIL的比率也显著低于常规分割组[5]。这些研究结果与我们的研究结果相似,数据显示,治疗期间CFRT组患者的最低点PLC明显低于HFRT患者。2组放疗前3周HFRT组患者的外周淋巴细胞值平均最低点高于CFRT组,且HFRT组前3周的平均最低点高于CFRT组的前3周及后2周。即使在生物等效剂量相似的情况下,HFRT组的平均最低点PLC也显著高于CFRT组。由于本研究患者外周血的采集是在放疗前和放疗期间每周进行,因此在一些患者中可能没有评估真实的最低点淋巴细胞计数。其次,本研究中所有的患者都接受过化疗,虽然2组患者的基线PLC无统计学差异,在化疗影响下接受放疗的重新聚合的淋巴细胞以及淋巴细胞亚类型的敏感度可能不同,尽管本研究中只有10%的患者有基线水平的淋巴细胞减少,但化疗如何对外周淋巴细胞计数产生影响还尚未可知。此外,本研究的放疗分割模式较为单一,未来可进行分割模式较为细化的前瞻性研究来分析其对淋巴细胞的影响。
综上,对于乳腺癌患者来说大分割放疗相对于常规分割更能降低放疗期间RIL发生的风险。目前将乳腺癌患者中的外周淋巴细胞计数与相关放疗因素相结合进行分析的研究较其他癌种相对较少,考虑到上述结果的发生还可能与肿瘤分期及淋巴结转移等因素相关,因此有必要进一步探究来推进临床治疗决策和放疗方案的优化。
| [1] |
中国医师协会放射肿瘤治疗医师分会. 乳腺癌放射治疗指南(中国医师协会2020版)[J]. 中华放射肿瘤学杂志, 2021, 30(4): 321-342. DOI: 10.3760/cma.j.cn113030-20210107-00010. Radiotherapy Oncologist Branch of Chinese Medical Association. Guidelines for radiotherapy of breast cancer (Chinese Medical Doctor Association 2020 edition)[J]. Chin J Radiat Oncol, 2021, 30(4): 321-342. DOI: 10.3760/cma.j.cn113030-20210107-00010. |
| [2] |
翟静, 张鹏程, 耿凯, 等. 乳腺癌应用保乳术辅助放疗的临床疗效观察[J]. 中国辐射卫生, 2014, 23(3): 270-272. Zhai J, Zhang PC, Geng K, et al. The observation on the clinical curative effect of breast conserving surgery with adjuvant radiotherapy in breast cancer[J]. Chin J Radiol Health, 2014, 23(3): 270-272. DOI:10.13491/j.cnki.issn.1004-714X.2014.03.035 |
| [3] |
Campian JL, Ye XB, Brock M, et al. Treatment-related lymphopenia in patients with stage III non-small-cell lung cancer[J]. Cancer Invest, 2013, 31(3): 183-188. DOI:10.3109/07357907.2013.767342 |
| [4] |
Grossman SA, Ye XB, Lesser G, et al. Immunosuppression in patients with high-grade gliomas treated with radiation and temozolomide[J]. Clin Cancer Res, 2011, 17(16): 5473-5480. DOI:10.1158/1078-0432.CCR-11-0774 |
| [5] |
Wild AT, Herman JM, Dholakia AS, et al. Lymphocyte-sparing effect of stereotactic body radiation therapy in patients with unresectable pancreatic cancer[J]. Int J Radiat Oncol Biol Phys, 2016, 94(3): 571-579. DOI:10.1016/j.ijrobp.2015.11.026 |
| [6] |
Venkatesulu BP, Mallick S, Lin SH, et al. A systematic review of the influence of radiation-induced lymphopenia on survival outcomes in solid tumors[J]. Crit Rev Oncol Hematol, 2018, 123: 42-51. DOI:10.1016/j.critrevonc.2018.01.003 |
| [7] |
Zhuang Y, Yuan BY, Chen GW, et al. Association between circulating lymphocyte populations and outcome after stereotactic body radiation therapy in patients with hepatocellular carcinoma[J]. Front Oncol, 2019, 9: 896. DOI:10.3389/fonc.2019.00896 |
| [8] |
Saito T, Toya R, Matsuyama T, et al. Dosimetric predictors of treatment-related lymphopenia induced by palliative radiotherapy: predictive ability of dose-volume parameters based on body surface contour[J]. Radiol Oncol, 2017, 51(2): 228-234. DOI:10.1515/raon-2016-0050 |
| [9] |
Shiraishi Y, Fang P, Xu C, et al. Severe lymphopenia during neoadjuvant chemoradiation for esophageal cancer: a propensity matched analysis of the relative risk of proton versus photon-based radiation therapy[J]. Radiother Oncol, 2018, 128(1): 154-160. DOI:10.1016/j.radonc.2017.11.028 |
| [10] |
Ellsworth SG, Yalamanchali A, Zhang H, et al. Comprehensive analysis of the kinetics of radiation-induced lymphocyte loss in patients treated with external beam radiation therapy[J]. Radiat Res, 2019, 193(1): 73-81. DOI:10.1667/RR15367.1 |
| [11] |
Van Rossum PSN, Deng W, Routman DM, et al. Prediction of severe lymphopenia during chemoradiation therapy for esophageal cancer: development and validation of a pretreatment nomogram[J]. Pract Radiat Oncol, 2020, 10(1): e16-e26. DOI:10.1016/j.prro.2019.07.010 |
| [12] |
Mohme M, Riethdorf S, Pantel K. Circulating and disseminated tumour cells-mechanisms of immune surveillance and escape[J]. Nat Rev Clin Oncol, 2017, 14(3): 155-167. DOI:10.1038/nrclinonc.2016.144 |
| [13] |
Zhang XL, Kim S, Hundal J, et al. Breast cancer neoantigens can induce CD8+ T-cell responses and antitumor immunity
[J]. Cancer Immunol Res, 2017, 5(7): 516-523. DOI:10.1158/2326-6066.CIR-16-0264 |
| [14] |
Meyer KK. Radiation-induced lymphocyte-immune deficiency. A factor in the increased visceral metastases and decreased hormonal responsiveness of breast cancer[J]. Arch Surg, 1970, 101(2): 114-121. DOI:10.1001/archsurg.1970.01340260018003 |
| [15] |
Yovino S, Kleinberg L, Grossman SA, et al. The etiology of treatment-related lymphopenia in patients with malignant gliomas: modeling radiation dose to circulating lymphocytes explains clinical observations and suggests methods of modifying the impact of radiation on immune cells[J]. Cancer Invest, 2013, 31(2): 140-144. DOI:10.3109/07357907.2012.762780 |
| [16] |
Maclennan ICM, Kay HEM. Analysis of treatment in childhood leukemia. IV. The critical association between dose fractionation and immunosuppression induced by cranial irradiation[J]. Cancer, 1978, 41(1): 108-111. DOI:10.1002/1097-0142(197801)41:1<108::aid-cncr2820410116>3.0.co;2-z |
| [17] |
张琳, 刘东仁, 侯殿俊, 等. 不同剂量X射线照射对介入放射工作人员离体外周血淋巴细胞凋亡率的影响[J]. 中国辐射卫生, 2019, 28(4): 368-370. Zhang L, Liu DR, Hou DJ, et al. Effects of different doses of X-ray irradiation on the apoptosis rate of peripheral blood lymphocytes in interventional radiology workers[J]. Chin J Radiol Health, 2019, 28(4): 368-370. DOI:10.13491/j.issn.1004-714X.2019.04.005 |




