随着核能技术在工业应用及现代医学技术的发展,人类暴露在低剂量电离辐射中的机会越来越多[1-3]。电离辐射能直接作用于人体细胞DNA引起损伤,或通过一些生物活性分子引起细胞基因表达改变而间接导致细胞、组织及机体损伤[4-6]。越来越多研究表明,低剂量辐射能引起人体免疫防御功能增强或使小鼠生命延长和肿瘤延迟发生,提示低剂量辐射诱导的适应性反应可能具有降低辐射损伤的作用[7-8]。探讨低剂量电离辐射诱导的适应性效应机制不仅对放射生物学的研究具有理论意义,而且对辐射防护和临床医学肿瘤放射治疗均有实用价值。本研究拟探索低剂量X射线辐照对A549细胞凋亡的适应性效应及时间效应,并观察产生适应性反应细胞的DNA损伤及细胞周期分布情况,初步探索辐射适应性效应的可能机制。
1 材料和方法 1.1 细胞系、主要试剂及仪器人非小细胞腺癌细胞A549来源于ATCC,保存于本实验室,培养代次为16~27代。DMEM培养基,胎牛血清(FBS),0.25%胰酶均购于GIBCO公司。AnnexinV-FITC/PI细胞凋亡双染试剂盒购自于BD公司。RNase A(TAKARA公司),溴化乙锭(PI)(Sigma)。X射线辐照仪为Precision X-ray (PXi),型号X-RAY 225,225 kV,13.3 mA。流式细胞检测仪Accuri C6 Plus(BD)。
1.2 细胞培养A549细胞培养于10%胎牛血清,10%青链霉素的DMEM完全培养基中,培养条件为37℃,5% CO2。细胞贴壁生长,平均3 d用0.25%胰酶-EDTA消化后,按1/5比例传代一次。细胞生长处于对数生长期时用于实验研究。
1.3 照射及实验分组铜滤板,低剂量照射(50 mGy、200 mGy、500 mGy)时剂量率分别为0.38 Gy/min,源靶距为96 cm;效应剂量20 Gy剂量率为0.96 Gy/min,源靶距为60 cm。A549细胞消化后接种于T25细胞培养瓶,培养12 h后,分别用50 mGy、200 mGy、500 mGy初始剂量进行照射,分别间隔3 h、6 h、12 h、24 h、48 h后,3组细胞再进行20 Gy的效应剂量进行照射。同时设置仅用20 Gy的效应剂量照射组和未照射组(0 Gy)为对照组。
1.4 细胞凋亡检测采用PI/Annexin双染法进行细胞凋亡检测。末次照射细胞培养24 h后,胰酶消化细胞,用完全生长培养基终止细胞并转移至流式管,用1X Binding buffer重悬细胞,洗2次,用100 uL 1X Binding buffer重悬细胞。按照实验设计加入PI/Annexin染料,4℃避光条件染色30 min,并分别设置PI及Annexin染料单染管。染色后加入1X Binding buffer,4℃,1500 rpm/min,5 min洗2次,细胞用400目尼龙膜过滤,用Accuri C6 Plus进行检测。
1.5 细胞周期检测用流式细胞仪检测A549细胞周期分布情况,分别于末次照射后24 h进行细胞周期检测。A549细胞消化离心,收集细胞,用1 mL的4℃预冷PBS洗细胞2次,1000 rpm/min,5 min。用100 uL 4℃预冷PBS重悬细胞,逐滴加入到4℃预冷的75%乙醇中。第二天收集细胞,用PBS洗2次后,加入500 uL PBS重悬细胞,加入RNase A使其终浓度为50 μg/mL,37℃水浴孵育30 min;最后加入溴化乙锭(PI),终浓度为60 μg/mL,4℃避光孵育30 min。将细胞悬液用400目尼龙膜过滤后进行流式检测,收集10000个细胞,细胞周期各时相数据用Flowjo V10(BD)软件进行分析。
1.6 细胞DNA损伤检测流式细胞仪检测细胞DNA损伤。A549细胞提前一天接种,培养12 h。按照设定条件进行辐照。放入培养箱37℃,5% CO2条件下平衡20 min。离心后,吸弃上清。加入1 mL PBS洗2次,吸弃上清。加入300 uL固定破膜液,重悬后,4℃孵育30 min。加入1 mL wash buffer,1500 rpm/min,5 min,离心后,吸弃上清。加入400 uL预冷PBS(2% FBS)重悬,过滤后上机检测。
1.7 统计学分析比较分析组间细胞凋亡和细胞周期数据,用SPSS17.0软件进行统计分析。本研究中实验为至少3次独立实验结果,数据用均数 ± 标准差表示。组间比较采用非配对t检验分析,P < 0.05有统计学差异。
2 结 果 2.1 低剂量X线辐射诱导A549细胞凋亡适应性反应及时间效应关系低剂量初始照射剂量和效应剂量间隔24 h,50 mGy、200 mGy、500 mGy初始剂量叠加20 Gy效应剂量,照射24 h后A549细胞早期凋亡百分数分别为2.1%,2.5%和2.8%,低于20 Gy照射组的8.8%(图1所示单次实验结果,Q1-LR为早期凋亡细胞,Q1-UR为死亡或晚期凋亡细胞)。A549细胞分别用50 mGy、200 mGy、500 mGy初始剂量进行照射后,分别间隔3 h、6 h、12 h、24 h、48 h,再进行20 Gy的效应剂量进行照射,观察低剂量辐射诱导A549细胞凋亡适应性反应是否有时间效应。结果显示,A549细胞在低剂量照射间隔3 h、6 h、12 h、24 h后再接受20 Gy照射,50 mGy~20 Gy、200 mGy~20 Gy、500 mGy~20 Gy组细胞凋亡率均分别显著低于仅20 Gy剂量照射组,且有统计学意义(aP < 0.01、bP < 0.01、cP < 0.01、dP < 0.05)。低剂量辐射后间隔48 h后照射,50 mGy~20 Gy、200 mGy~20 Gy、500 mGy~20 Gy组细胞凋亡率比单纯20 Gy组细胞凋亡率低,但无统计学差异( 图2)。
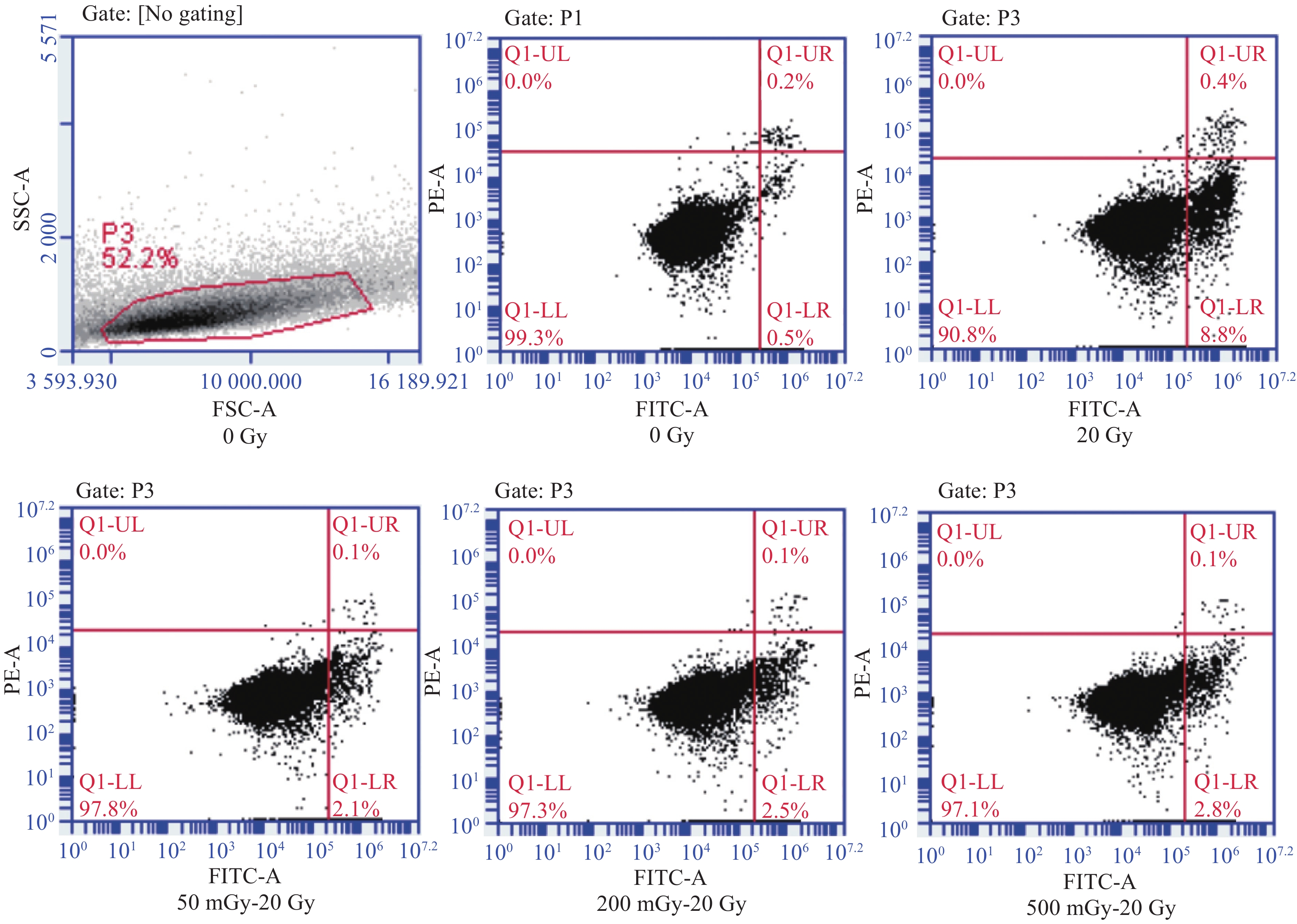
|
图 1 低剂量X线辐射诱导A549细胞凋亡适应性反应(初始剂量与效应剂量间隔照射24 h) Figure 1 Adaptive response of A549 cell apoptosis induced by low-dose X-Ray irradiation (at an interval of 24 h between the initial dose and the effect dose) |
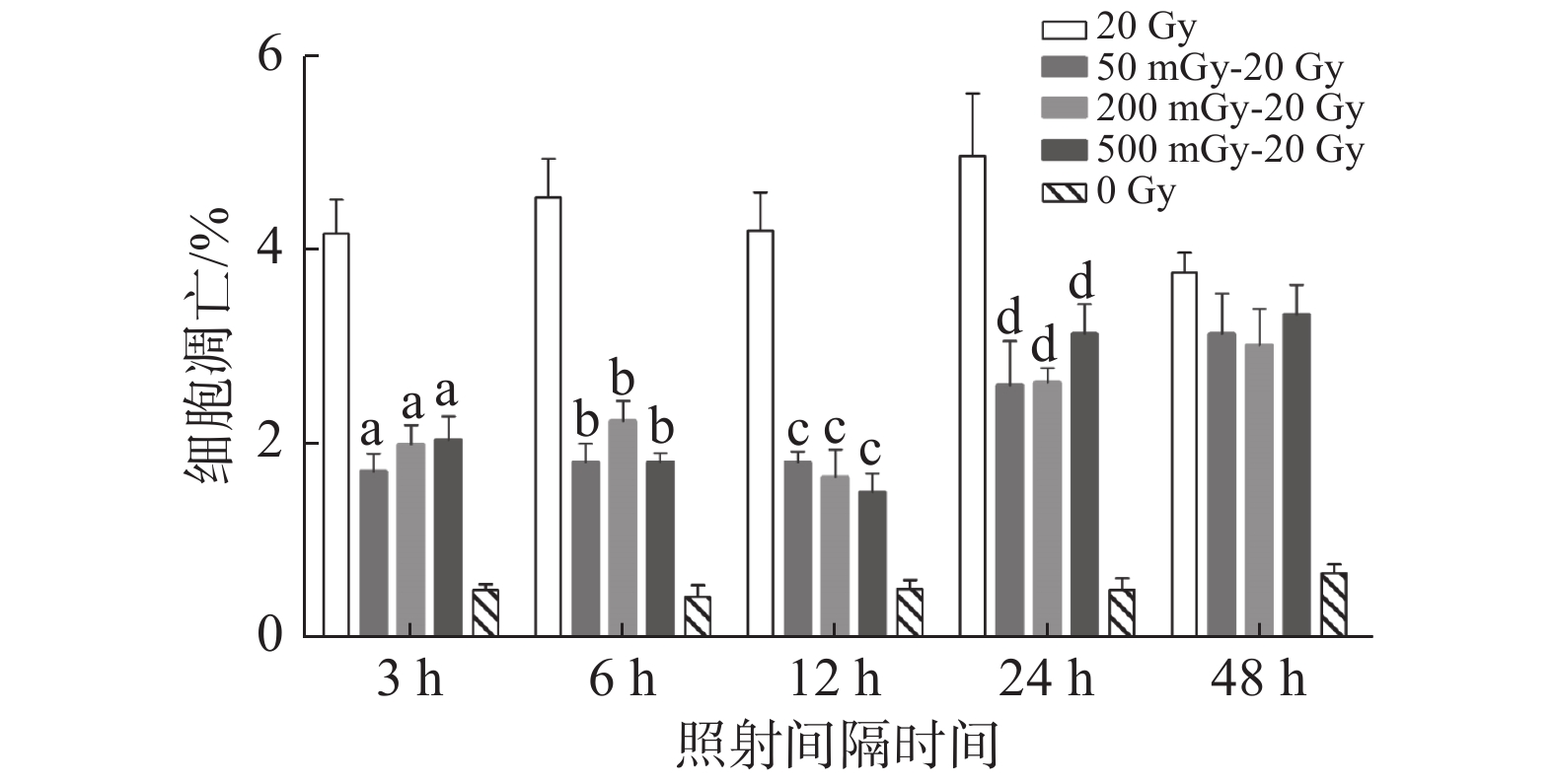
|
图 2 低剂量X线辐射诱导A549细胞凋亡适应性反应的时间效应 Figure 2 Time effect of low-dose X-ray irradiation on adaptive response of A549 cell apoptosis 注:与20 Gy对照组比较,at = 10.72、9.320、8.552,P < 0.01;bt = 10.68、8.854、11.54,P < 0.01;ct = 9.977、8.981、10.51,P < 0.01;dt = 5.808、5.775、4.749,P < 0.05 |
A549细胞分别用50 mGy、200 mGy、500 mGy初始剂量进行照射后,6 h后用20 Gy的效应剂量进行照射,末次照射30 min内,流式检测细胞DNA损伤情况。结果表明,50 mGy、200 mGy及500 mGy初始剂量照射后,与效应剂量间隔6 h,叠加20 Gy效应剂量照射30 min后A549细胞ϒH2AX百分数分别为38.57 ± 1.34、41.8 ± 0.95和41.1 ± 2.05,均低于20 Gy剂量照射组的44.03 ± 1.38,DNA损伤降低,但不具有统计学意义,见图3。
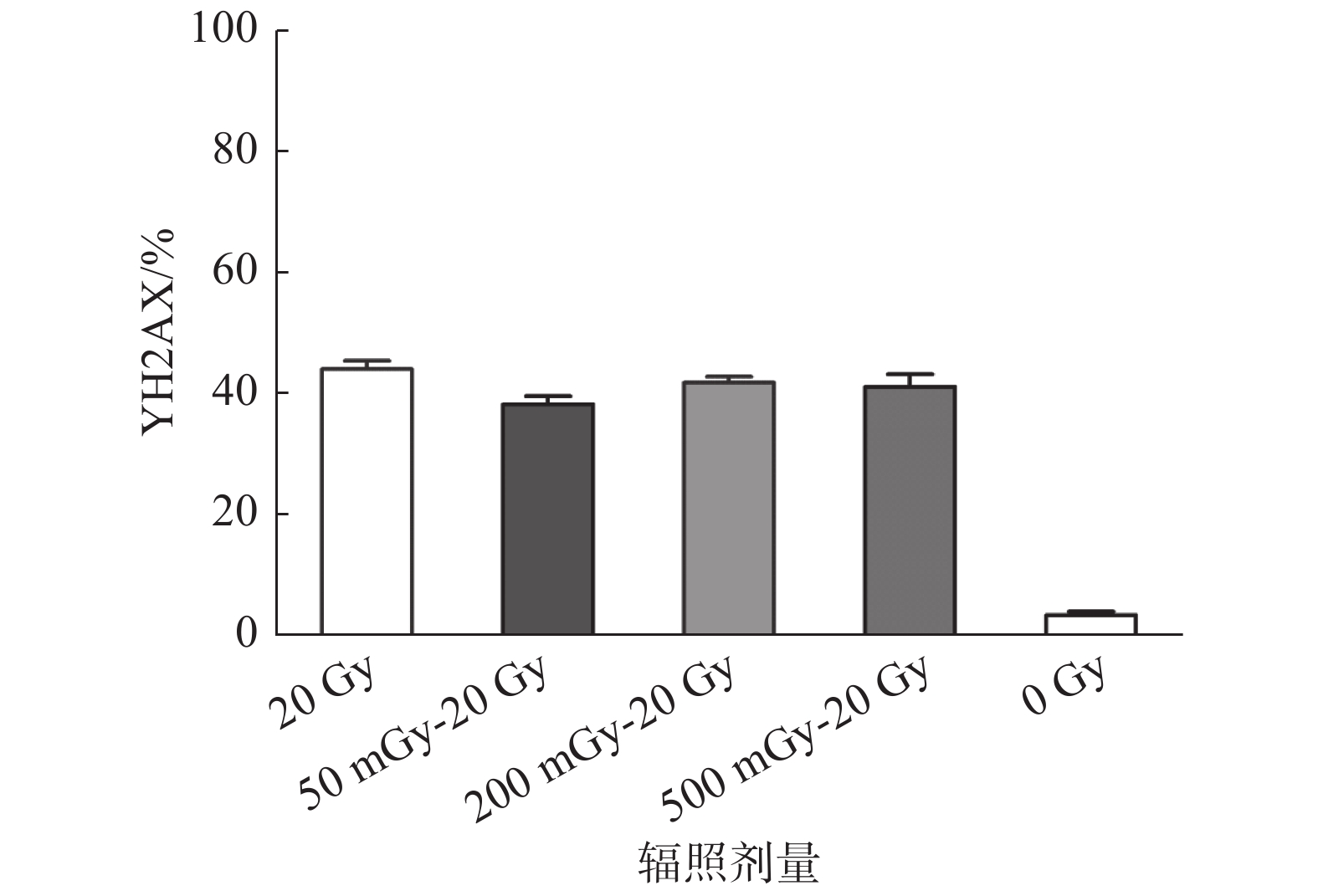
|
图 3 低剂量X射线辐射后A549细胞DNA损伤 Figure 3 A549 cell DNA damage after low-dose X-ray irradiation |
A549细胞分别用50 mGy、200 mGy、500 mGy初始剂量进行照射后,6 h后用20 Gy的效应剂量进行照射,末次照射24 h后检测细胞周期。与单纯20 Gys效应剂量照射组相比,50 mGy、200 mGy低剂量照射叠加20 Gy剂量组,细胞G0/G1期百分数明显增加 (t = 4.612、3.916,P < 0.05),500 mGy~20 Gy组无统计学差异;50 mGy~20 Gy、200 mGy~20 Gy组G2/M期细胞百分数明显低于20 Gy照射组( t = 6.534、4.557,P < 0.05),500 mGy~20 Gy组G2/M期细胞百分数与20 Gy照射组无统计学差异,见 表1。
|
|
表 1 低剂量X射线照射对A549细胞周期分布的影响(
|
长期以来,低剂量辐射的生物学效应研究大多针对辐射敏感的正常细胞,如高本底地区人群免疫系统的流行病学研究,动物活体内的免疫细胞及体外一些正常细胞。对肿瘤细胞接受低剂量照射后的生物学效应研究相对较少。本研究选取了50 mGy、200 mGy、500 mGy 3个低剂量,同时将效应剂量增加到20 Gy,研究低剂量辐射诱导A549细胞凋亡适应性反应。
研究结果显示,低剂量照射间隔3 h、6 h、12 h、24 h后再接受20 Gy照射,50 mGy~20 Gy、200 mGy~20 Gy、500 mGy~20 Gy组细胞凋亡率均分别显著低于仅20 Gy剂量照射组,能诱导A549细胞凋亡的适应性反应(图2)。之前研究表明,针对体内和体外低剂量辐射后可诱导小鼠胸腺细胞或EL4淋巴瘤细胞凋亡及细胞周期的适应性反应[9],与本研究结果一致。另外,Chen等人研究表明,A549细胞暴露于50 mGy a粒子可诱导对750 mGy a粒子辐射后的放射抗性,并发现对LDR反应的ROS升高可能促进A549细胞的自噬/Nrf2/HO-1而产生了适应性效应[10]。
细胞凋亡是辐射损伤严重时一种防卫机制,机体长期暴露在低剂量辐射下,会通过调控凋亡相关因子的表达来促进细胞对受损的DNA进行及时修复而不走向凋亡[11],这也是低剂量电离辐射诱导细胞出现适应反应的一个机制。有一些研究报告了一种相反的表型,Liang等人证明,LDR能诱导人胚肺成纤维细胞2BS的增殖,但不能诱导肺癌细胞NCI-H446对20~75 mGy射线的反应[12]。这些差异可能是由于癌细胞系、辐照类型、照射剂量和实验时间点不同造成的。本研究中低剂量照射与20Gy大剂量照射间隔48 h,50 mGy、200 mGy及500 mGy 3个照射剂量均未诱导出适应性反应。提示低剂量辐射诱导凋亡适应性反应可能与照射的时间有一定关系,其分子机制有待深入研究。
电离辐射引起的DNA双链断裂损伤是DNA损伤最严重的损伤形式,细胞中ATM酶会迅速检测到双链断裂部位,使细胞H2AX磷酸化(ϒH2AX),从而启动系列的细胞修复机制对损伤进行修复[13-14]。本研究检测了A549细胞辐射后DNA损伤情况,发现低剂量辐射引起适应性的细胞中ϒH2AX的产生降低,但与20 Gy对照组无统计学差异。可能低剂量造成细胞DNA损伤程度较轻,或者DNA损伤在2次照射间隔已迅速启动了细胞修复机制,减缓了DNA损伤发生。研究结果提示低剂量辐射适应性效应可能与辐射后DNA损伤程度无直接关系,有待深入研究确证。
细胞周期阻滞也是细胞应对辐射所致DNA损伤的重要反应。低剂量X射线照射后可诱导中国仓鼠细胞出现G1期阻滞现象,且细胞对辐射的敏感性与细胞所处的周期阶段有关,G2期和M期细胞对辐射较为敏感,G1期次之,处于S期的细胞对辐射的敏感性较低[15-16]。不同的射线类型,在不同组织或细胞中均会引起DNA损伤介导的细胞周期阻滞效应[17-18]。
本研究中,对A549细胞低剂量辐射6 h后,再进行大剂量照射,结果发现50 mGy、200 mGy叠加20 Gy照射组G0/G1期细胞百分数明显比20 Gy剂量组增加,提示低剂量辐射可能引起细胞G1期阻滞,其机制有待深入研究。在电离辐射所致的损伤调控效应中,G1期和G2/M期检查点发挥了重要作用[19],它们通过不同的信号途径调控细胞周期进程,产生不同的辐射生物学效应。有辐射机制方面的研究表明,ATM-Chk2-Cdc25A通路及ATR-Chk1-Cdc25A通路介导引起的细胞G1/S期阻滞都是一种短暂而快速的细胞反应,而细胞长期G1/S期的阻滞则依赖p53的介导[16]。有研究用75 mGy剂量ϒ射线对荷瘤小鼠进行全身照射,分析发现小鼠移植瘤细胞于照射后24 h发生了G0/G1期阻滞[20]。
我们研究还发现,所有照射剂量组均有G2/M期阻滞;与20 Gy照射组相比,50 mGy及200 mGy低剂量叠加20Gy照射组G2/M期阻滞减轻。研究表明中红外辐射(MIR)能引起A549细胞G2/M期阻滞[17],且调控细胞周期的相关蛋白表达水平发生了变化。还有研究表明低剂量预照射能诱导人肝癌细胞HepG2短时的G2/M期阻滞或减少大剂量照射引起的G2/M期阻滞[21],与本研究中50 mGy及200 mGy低剂量组结果一致。而500 mGy照射剂量虽然减轻了20 Gy照射引起的G2/M期阻滞,但与20 Gy组比较无统计学差异,可能是因为500 mGy剂量已超出低剂量辐射的界限范围。
综上所述,在一定的剂量范围内,低剂量X射线照射能诱导A549细胞凋亡的适应性反应,且与初始剂量和效应剂量间隔的时间有关;低剂量照射组产生的G1/G0期阻滞及G2/M期阻滞减轻可能与适应性效应产生有关,其分子机制有待进一步深入研究。本研究为进一步辐射生物效应研究及辐射防护均提供了理论依据。
| [1] |
翟贺争, 杜仲庆, 吴香君, 等. 2016—2018年参加全国个人剂量监测能力考核结果分析[J]. 中国辐射卫生, 2020, 29(1): 45-48. Zhai HZ, Du ZQ, Wu XJ, et al. Comparison and analysis of the intercomparison results of national personal dose monitoring from 2016 to 2018[J]. Chin J Radiol Health, 2020, 29(1): 45-48. DOI:10.13491/j.issn.1004-714X.2020.01.010 |
| [2] |
Overbey EG, Paul AM, da Silveira WA, et al. Mice exposed to combined chronic low-dose irradiation and modeled microgravity develop long-term neurological sequelae[J]. Int J Mol Sci, 2019, 20(17): 4094. DOI:10.3390/ijms20174094 |
| [3] |
Colceriu-Simon IM, Hedesiu M, Toma V, et al. The effects of low-dose irradiation on human saliva: a surface-enhanced Raman spectroscopy study[J]. Diagnostics (Basel), 2019, 9(3): 101. DOI:10.3390/diagnostics9030101 |
| [4] |
方连英, 李卫国, 马娅, 等. X射线对人淋巴母细胞基因表达谱的影响[J]. 中国辐射卫生, 2019, 28(4): 371-375. Fang LY, Li WG, Ma Y, et al. Alterations of gene transcriptional profiles in human lymphoblastoid cells by X-ray exposure[J]. Chin J Radiol Health, 2019, 28(4): 371-375. DOI:10.13491/j.issn.1004-714X.2019.04.006 |
| [5] |
王畅, 黎金荣, 莫素芳, 等. 放射工作人员淋巴细胞微核异常影响因素的病例对照研究[J]. 中国辐射卫生, 2018, 27(3): 209-212. Wang C, Li JR, Mo SF, et al. Matched case-control study on the influencing factors of lymphocyte micronucleus rate abnormality in radiation workers[J]. Chin J Radiol Health, 2018, 27(3): 209-212. DOI:10.13491/j.issn.1004-714X.2018.03.005 |
| [6] |
Cervelli T, Panetta D, Navarra T, et al. A new natural antioxidant mixture protects against oxidative and DNA damage in endothelial cell exposed to low-dose irradiation[J]. Oxid Med Cell Longev, 2017, 2017: 9085947. DOI:10.1155/2017/9085947 |
| [7] |
de Olza MO, Bourhis J, Irving M, et al. High versus low dose irradiation for tumor immune reprogramming[J]. Curr Opin Biotechnol, 2020, 65: 268-283. DOI:10.1016/j.copbio.2020.08.001 |
| [8] |
Song KH, Kim MH, Kang SM, et al. Analysis of immune cell populations and cytokine profiles in murine splenocytes exposed to whole-body low-dose irradiation[J]. Int J Radiat Biol, 2015, 91(10): 795-803. DOI:10.3109/09553002.2015.1068461 |
| [9] |
刘淑春, 赵文举, 吕喆, 等. 低剂量辐射诱导EL-4淋巴瘤细胞凋亡及细胞周期进程适应性反应的剂量率效应[J]. 吉林大学学报(医学版), 2008, 34(1): 24-27. Liu SC, Zhao WJ, Lv Z, et al. Dose-rate effect of adaptive response of apoptosis and cell cycle progression induced by low-dose ionizing radiation in EL-4 lymphoma cells in vitro [J]. J Jilin Univ (Med Ed), 2008, 34(1): 24-27. DOI:10.3969/j.issn.1671-587X.2008.01.006 |
| [10] |
Chen N, Wu LJ, Yuan H, et al. ROS/autophagy/Nrf2 pathway mediated low-dose radiation induced radio-resistance in human lung adenocarcinoma A549 cell[J]. Int J Biol Sci, 2015, 11(7): 833-844. DOI:10.7150/ijbs.10564 |
| [11] |
Yushkova E, Zainullin V. Interaction between gene repair and mobile elements-induced activity systems after low-dose irradiation[J]. Int J Radiat Biol, 2016, 92(9): 485-492. DOI:10.1080/09553002.2016.1206221 |
| [12] |
Liang XY, Gu JL, Yu DH, et al. Low-dose radiation induces cell proliferation in human embryonic lung fibroblasts but not in lung cancer cells: importance of ERK1/2 and AKT signaling pathways[J]. Dose Response, 2016, 14(1): 1559325815622174. DOI: 10.1177/1559325815622174.
|
| [13] |
Khanna KK, Jackson SP. DNA double-strand breaks: signaling, repair and the cancer connection[J]. Nat Genet, 2001, 27(3): 247-254. DOI:10.1038/85798 |
| [14] |
Zhao L, Bao CY, Shang YX, et al. The determinant of DNA repair pathway choices in Ionising radiation-induced DNA double-strand breaks[J]. Biomed Res Int, 2020, 2020: 4834965. DOI:10.1155/2020/4834965 |
| [15] |
Sinclair WK, Morton RA. X-ray sensitivity during the cell generation cycle of cultured Chinese hamster cells[J]. Radiat Res, 1966, 29(3): 450-474. DOI:10.2307/3572025 |
| [16] |
Honjo Y, Ichinohe T. Stage-specific effects of ionizing radiation during early development[J]. Int J Mol Sci, 2020, 21(11): 3975. DOI:10.3390/ijms21113975 |
| [17] |
Chang HY, Shih MH, Huang HC, et al. Middle infrared radiation induces G2/M cell cycle arrest in A549 lung cancer cells
[J]. PLoS One, 2013, 8(1): e54117. DOI:10.1371/journal.pone.0054117 |
| [18] |
Biever JJ, Brinkman D, Gardner G. UV-B inhibition of hypocotyl growth in etiolated Arabidopsis thaliana seedlings is a consequence of cell cycle arrest initiated by photodimer accumulation
[J]. J Exp Bot, 2014, 65(11): 2949-2961. DOI:10.1093/jxb/eru035 |
| [19] |
Bartek J, Lukas J. Mammalian G1- and S-phase checkpoints in response to DNA damage[J]. Curr Opin Cell Biol, 2001, 13(6): 738-747. DOI:10.1016/s0955-0674(00)00280-5 |
| [20] |
于洪升, 宋爱琴, 费从合, 等. 低剂量辐射对肿瘤细胞凋亡、细胞周期以及凋亡相关蛋白Bcl-2的影响(英文)[J]. 中德临床肿瘤学杂志, 2005, 4(2): 89-92. Yu HS, Song AQ, Fei CH, et al. Effects of low dose radiation on tumor apoptosis, cell cycle and apoptosis-related protein Bcl-2 in tumor-bearing mice (English)[J]. Chin Ger J Clin Oncol, 2005, 4(2): 89-92. DOI:10.1007/S10330-004-0276-2 |
| [21] |
夏景光, 李文建, 王菊芳, 等. 低剂量电离辐射预处理对高剂量辐射诱导的肝癌细胞hepG2细胞周期阻滞的影响[J]. 辐射研究与辐射工艺学报, 2005, 23(1): 49-52. Xia JG, Li WJ, Wang JF, et al. Effects of low priming dose irradiation on cell cycle arrest of HepG2 cells caused by high dose irradiation[J]. J Radiat Res Radiat Process, 2005, 23(1): 49-52. DOI:10.3969/j.issn.1000-3436.2005.01.011 |




