2. 中国辐射防护研究院,放射医学与环境医学研究所,山西 太原 030006
2. Department of Radiation Medicine and Environment Medicine, China Institute for Radiation Protection, Taiyuan 030006 China
铀是自然界普遍存在的最重的重金属元素,其在地壳中的含量达到了2.3 μg/g。铀矿开采、浓缩、贫铀武器的使用等使环境中铀的含量急剧增加,铀的健康效应因此受到了持续关注[1]。铀具有重金属化学毒性和放射毒性,尽管公众对于铀的放射毒性关注度更高,但铀作为重金属的化学毒性是其环境暴露的主要风险,也是铀和贫铀暴露的主要毒性来源[2]。铀的毒性效应主要包括肾毒性、骨毒性、肝毒性、肺毒性、脑毒性及神经毒性等,肾是可溶性铀急性暴露后重要的毒性靶器官[3]。肾脏作为铀的主要蓄积及排泄器官,铀在肾内的暂时性蓄积和吸收造成肾近曲小管损伤和细胞死亡,剩余的滞留在肾脏内,引起肾小球病变和肾小管上皮细胞损害[4]。
尽管针对铀的毒性及生物效应已经开展了充分的研究,但主要以动物整体和器官水平的损伤为主。随着透射电镜、扫描电镜和分析检测技术的发展,人们对铀的微观效应及毒性产生机理有了新的认识。UO22+被肾小管中的细胞吸收后与细胞内的溶酶体结合,溶酶体中的磷酸酯酶与UO22+形成磷酸铀晶体,导致溶酶体及所在的细胞结构破坏[5]。铀进入肝脏细胞中可形成磷酸铀酰沉淀,引起细胞的凋亡,激活了线粒体依赖信号途径和死亡受体途径,多种细胞的研究均证实了铀的细胞毒性效应主要是铀的化学毒性导致[6]。铀的渗透及在细胞中的分布与其毒性的关系也在多种细胞中进行了研究,但目前对于铀在细胞及分子水平的代谢、转运及与有机、无机分子的作用过程认识不足,特别是对于细胞摄入、排出铀的过程仍不清楚[7]。因此本实验以人肾近曲小管细胞(HK-2)为研究对象,从细胞层面对可溶性铀的毒性及内吞外排过程进行研究,探讨铀的化学毒性及产生机制,为铀的毒性机制研究、治疗和解毒提供新的思路。
1 材料与方法 1.1 试剂和溶液DMEM/F12培养基、胎牛血清、青链霉素、胰酶购自美国GIBCO公司,磷酸缓冲液(PBS)购自上海生工生物工程有限公司,DMSO购自索莱宝生物技术有限公司。硝酸铀酰购自天津莱斯博科技有限公司,编号RYU190501,经中国计量科学研究院检测,比活度为85.9 Bq/g。CCK-8检测试剂盒购自东仁化学科技上海有限公司(JE603),细胞周期检测试剂盒(KGA511)购自江苏凯基生物有限公司,细胞凋亡试剂盒(BA00101)购自北京博奥森生物技术有限公司。优级纯硝酸购自国药集团化学试剂有限公司,其余试剂均为分析纯。
1.2 细胞培养和铀染毒人肾近曲小管细胞(HK-2,中科院上海细胞库),使用含有10%胎牛血清、1%青链霉素的DMEM/F12培养基,于37℃ 5%CO2的培养箱中培养,每3~4天更换一次培养基,当细胞融合度达到90%以上时按照1∶3传代,细胞生长融合度达到70%~80%时用于实验。
将硝酸铀酰溶于超纯水制成(40 μmol/L)铀储存液,染毒前用完全培养基将铀储存液稀释成不同浓度的铀染毒液,细胞使用一系列浓度(0、50、100、300、500 μmol/L)铀溶液分别染毒24 或48 h。
1.3 细胞活性检测细胞活性采用CCK-8法测定,将对数期HK-2细胞以5 × 103个/孔的密度接种于96孔板中,过夜贴壁后吸去培养基,加入含有一系列铀浓度的染毒液于37℃分别孵育24 h和48 h,同时设定对照组(含有细胞的培养基、CCK-8)和空白组(只含培养基、CCK-8),每个浓度组设置3个复孔。孵育结束后,用PBS清洗细胞3次,每孔加入110 μL CCK-8:培养基按照1∶10配制的溶液,于37℃孵育2 h,用酶标仪(Multiskan Go,Thermo Fisher)测定450 nm处的吸光度,实验重复3次。细胞活性(%) = (As − Ab/Ac − Ab) × 100%,As:实验孔吸光度,Ac:对照孔吸光度,Ab:空白孔吸光度。
1.4 透射电镜观察细胞接种于T75培养瓶中贴壁过夜,用300 μmol/L铀染毒液处理24 h后,用磷酸缓冲液(PBS,0.1 mol/L,pH = 7.4)清洗2次,用刮刀小心刮下细胞转移到离心管中,离心后收集细胞用3%戊二醛4℃固定过夜。PBS清洗细胞后用2%四氧化锇4℃固定1.5 h,随后用梯度乙醇脱水,转入丙酮。环氧树脂包埋,分别于37℃、45℃、60℃干燥24 h。采用徕卡超薄切片机制备超薄切片,柠檬酸铅染色,透射电镜(HT7700,Hitachi)观察样本细胞超微结构。
1.5 铀的内吞和外排将对数期HK-2细胞以2 × 105个/孔的密度接种于24孔板中,培养过夜。弃去培养基,加入分别含不同铀浓度(0、50、100、300 μmol/L)的新鲜培养基,分别于37℃孵育2、6、24和48 h,孵育结束后收集上清液,用800 μL的冰的PBS清洗并与上清液合并;随后酸洗每孔(0.02 mol/L NaOAc,pH5,800 μL × 2次)并收集清洗液;最后用65%的硝酸溶解细胞(500 μL × 2次)并收集至EP管中。上清液、酸洗液及细胞裂解液中的铀含量采用电感耦合等离子体质谱法(ICP-MS)进行测定。为了计算铀的内吞率,结果以铀暴露总量的百分数计算。
外排实验中,细胞以同样方法暴露于不同浓度的铀溶液6 h,弃去铀染毒液,用冷的PBS清洗2次,加入1 mL新鲜的完全培养基,于37℃分别孵育1、2、4和8 h。孵育结束后收集上清液并用PBS清洗,合并清洗液,作为细胞外排的铀含量;随后用65%的硝酸溶解细胞(500 μL × 2次)并收集至EP管中,代表细胞内剩余的铀含量。
1.6 ICP-MS测定ICP-MS具有高灵敏度,低检测限,宽动态范围,多元素同时分析,基体干扰小等优点,可以准确测量细胞内的铀含量[8]。将细胞样本消解后,用0.5 mol/L的硝酸稀释后上机检测,硝酸使用超纯水(Milli-Q A10)稀释。ICP-MS分析仪器的型号是NexION 5000系列(PerkinElmer,美国),质控品为U-238标准品溶液(IRMM-183,比利时标准物质研究所)。
1.7 细胞周期、细胞凋亡测定将对数期HK-2细胞以1×106个/孔的密度接种于6孔板中培养24 h。弃去培养基,加入分别含不同铀浓度(0、50、100、300、500 μmol/L)的新鲜培养基染毒24 h。胰酶消化收集细胞,用PBS洗涤细胞一次,收集并调整细胞浓度为1 × 106/mL,取1 mL制备的单细胞悬液离心后去除上清,加入500 μL体积分数为70%的冷乙醇,4℃固定过夜,用PBS洗去固定液,细胞悬液用200目筛网过滤一次,收集细胞加入500 μL提前配制好的PI/RNase A染色工作液,室温避光30 min后,流式细胞仪检测。
铀染毒方法同上,染毒结束后用不含EDTA的胰酶消化后收集细胞,用预冷的PBS洗涤细胞2次,收集5 × 105个细胞;吸弃PBS,加入100 μL Binding buffer重悬细胞。加入5 μL Annexin V-FITC和5 μL PI 溶液,轻轻混匀,室温避光孵育15 min。加入400 μL Binding buffer,混匀后置于冰上,1 h内用流式细胞仪测定。
1.8 数据统计采用SPSS软件进行数据统计和分析,采用GraphPad Prism 8.0.1软件进行绘图,所有数据均来源于3次重复实验,数据经正态性检验符合正态分布,用
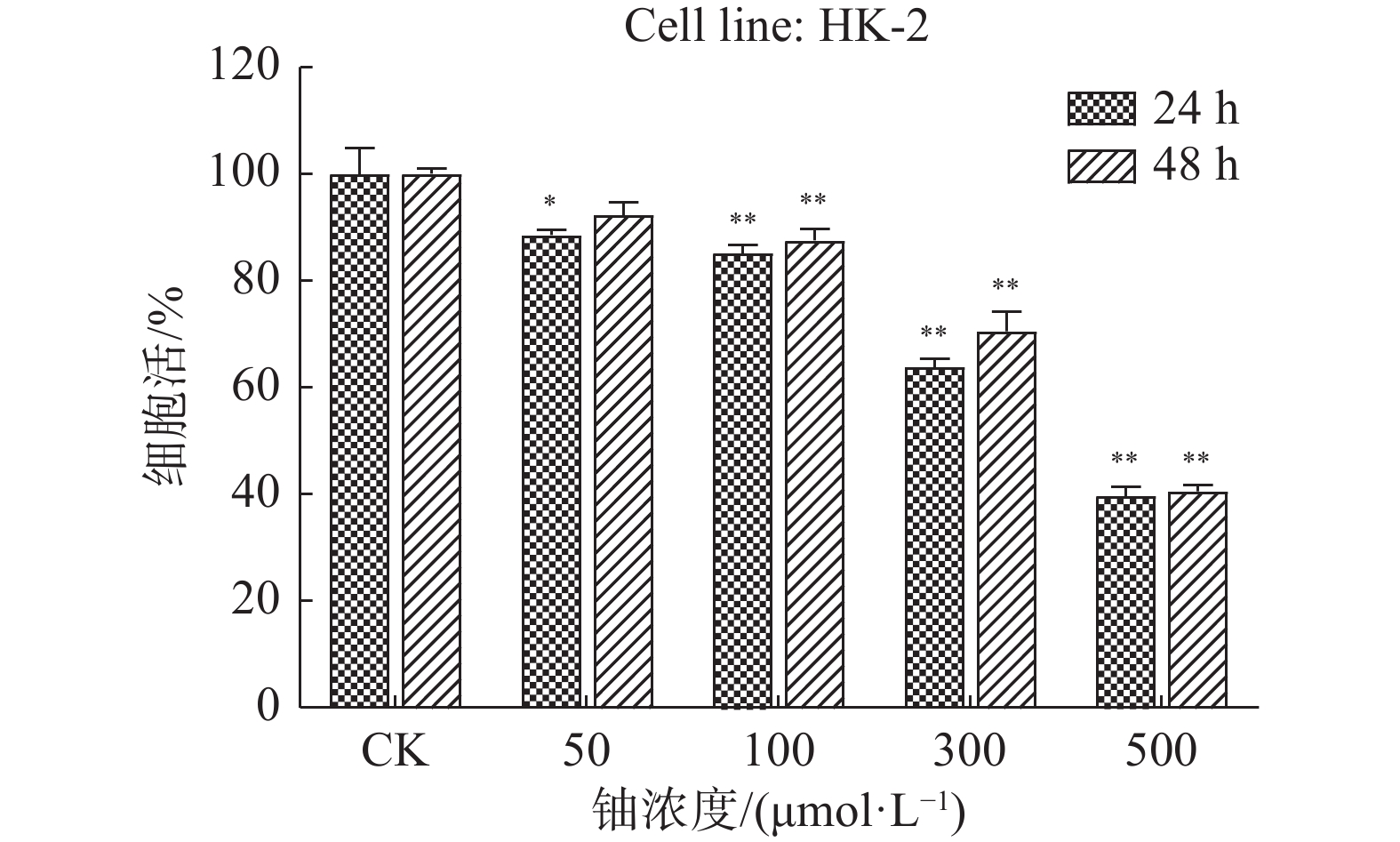
铀染毒后,HK-2细胞活性呈剂量依赖性降低(图1)。与对照组相比较,100、300和500 μmol/L组在24 h和48 h细胞活性均明显下降(P < 0.01),50 μmol/L组在24 h活性明显下降( P < 0.05),但在48 h后细胞活性与对照组差异无统计学意义。相差显微镜下可见铀染毒后细胞收缩,透光性和贴壁性变差,悬浮细胞增多,细胞活性变差( 图2)。
|
图 1 不同浓度铀染毒后HK-2细胞活性的比较 Figure 1 Cell viability of HK-2 after various concentrations of uranium exposure 注:与对照组相比,*P < 0.05,**P < 0.01 |

|
图 2 500 μmol/L铀染毒24 h后HK-2细胞的光镜观察图 Figure 2 Optical microscopy images of HK-2 cells after 500 μmol/L uranium exposure for 24 h 注:A.对照组(× 100);B.对照组(× 400);C.500 μmol/L组(× 100);D.500 μmol/L组(× 400) |
不同浓度铀染毒后,细胞内吞的铀含量逐渐增加,并且100 μmol/L和300 μmol/L组内吞铀含量分数在24 h达到了最大,50 μmol/L组随时间延长内吞铀含量分数逐渐增加,在48 h达到最大,达到了26.63%(图3A)。细胞表面结合的铀含量分数随暴露时间延长略有增加(图3B),但整体较低(< 0.2%),细胞外液中可溶性铀的含量逐渐降低,0~24 h相比24~48 h降低更明显(图3C)。更换新鲜培养基后,细胞内吞的可溶性铀可以很快的排出细胞外,在1 h内细胞内吞的铀约40%都可以排出细胞外,并且随时间延长,外排量逐渐增加(图3D)。

|
图 3 HK-2细胞对铀的内吞、外排情况 Figure 3 Endocytosis and exocytosis of uranium in HK-2 cells 注:A.细胞内吞铀的百分数;B.细胞表面结合铀的百分数;C.细胞外可溶性铀的浓度;D.细胞外排中内吞铀含量剩余的百分数 |
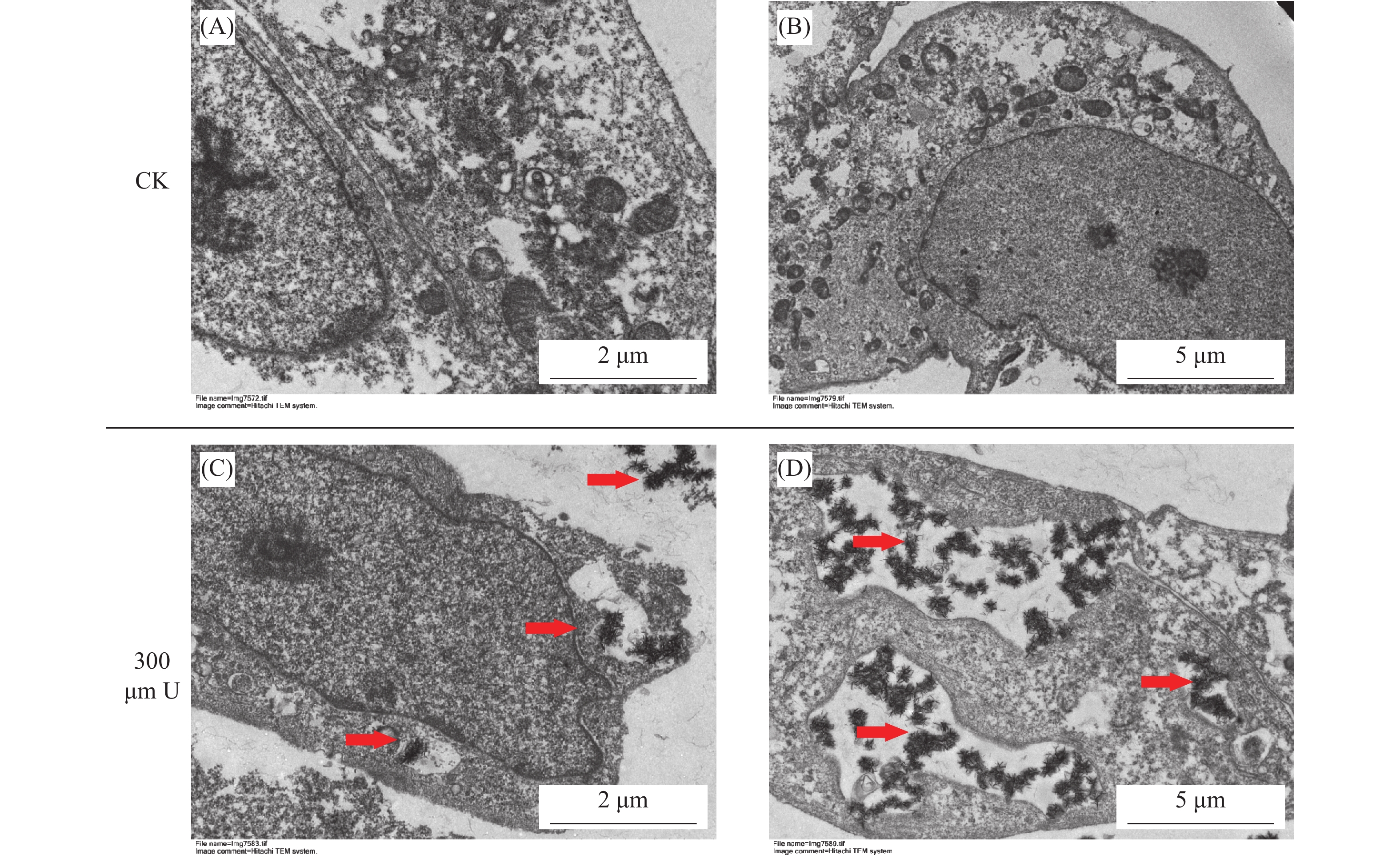
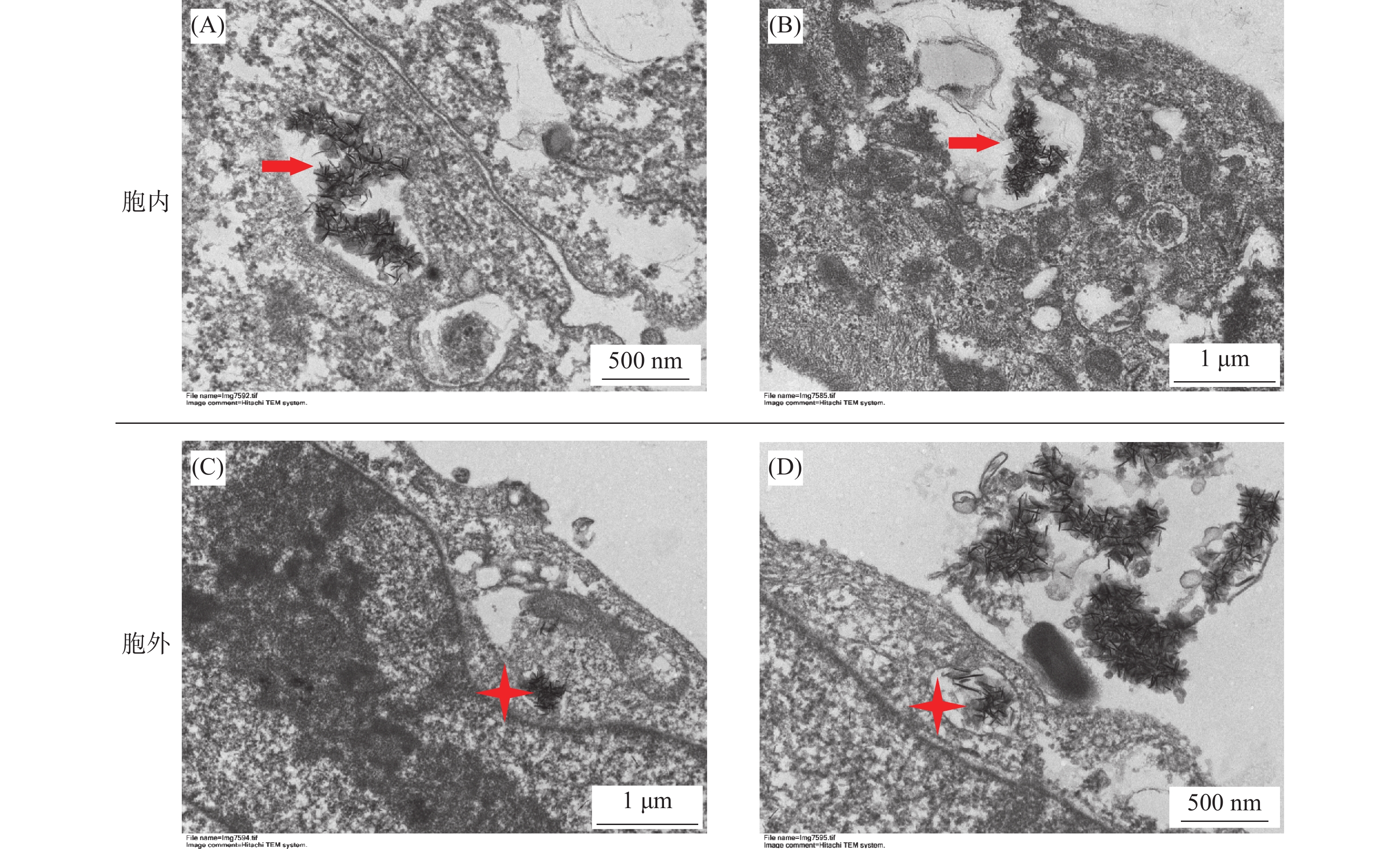
透射电镜观察HK-2细胞300 μmol/L铀染毒24 h后,在细胞外、细胞内均出现了针状样的沉淀,沉淀呈孤立或成簇聚集状(图4)。在细胞内铀沉淀形成于胞质或溶酶体样的囊泡中(图5A和5B),在细胞外铀沉淀成簇聚集,在紧贴细胞膜的外侧,可见少量针样沉淀正在形成或排出(图5C和5D)。
|
图 4 透射电镜观察300 μM铀染毒24 h后HK-2细胞 Figure 4 Transmission electron microscopy images of HK-2 cells after 300 μM uranium exposure for 24 h 注:A 和 B.CK 组细胞(A × 5 000;B × 2 000);C.细胞外形成的沉淀(× 5 000);D.细 胞内形成的沉淀(× 5 000) |
|
图 5 铀染毒24 h后HK-2细胞透射电镜细节图 Figure 5 Transmission electron microscopy details of HK-2 cells after uranium exposure for 24 h 注:A.铀沉淀(溶酶体样的囊泡中,箭头,× 12 000);B.铀沉淀(胞质中,箭头,× 7 000);C.正在排出的沉淀(星形,× 7 000);D.正在形成的沉淀(星形,× 12 000) |
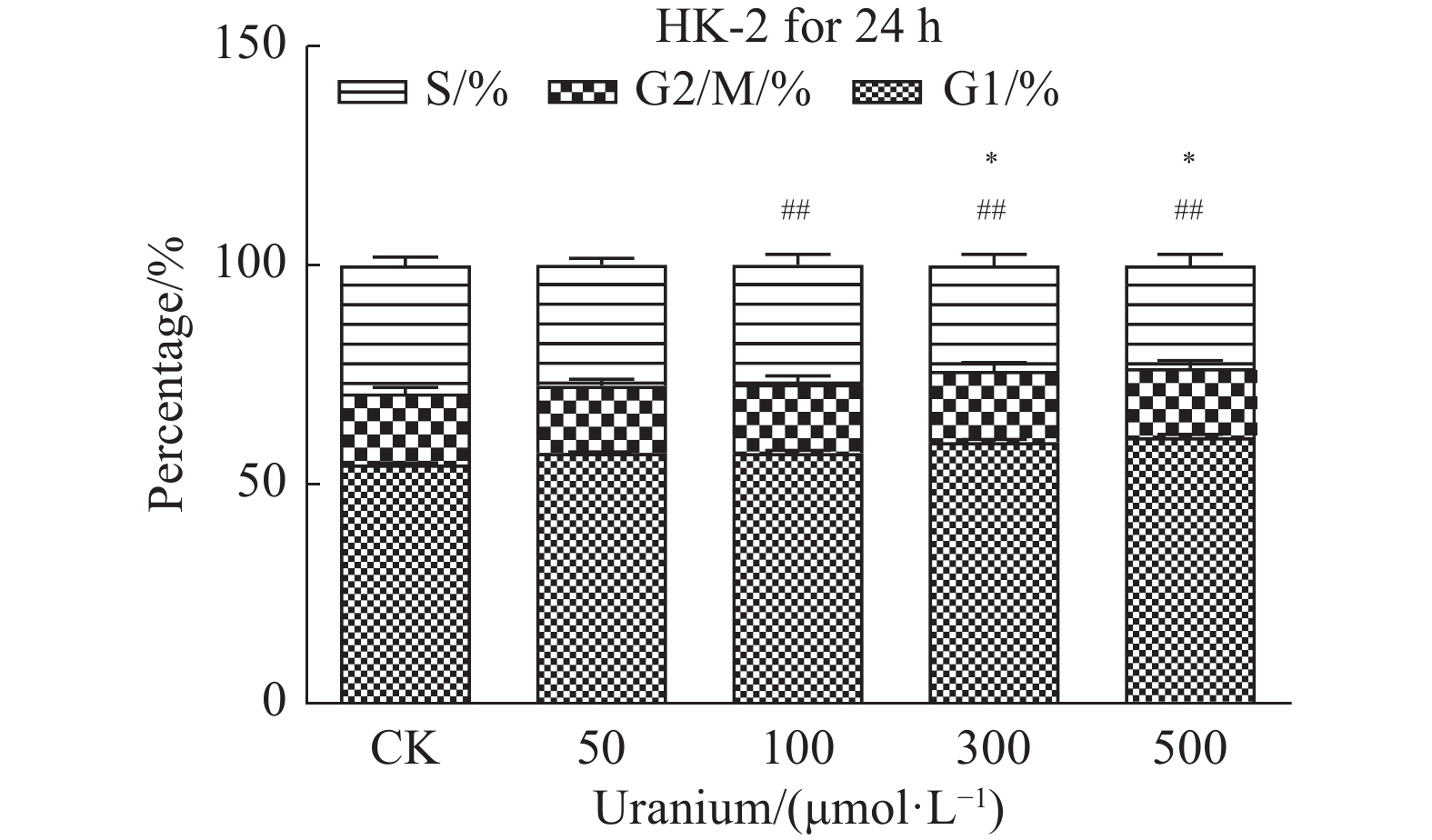
铀染毒后100、300和500 μmol/L组细胞周期均出现明显改变,与对照组相比,100、300和500 μmol/L组均出现了G1期阻滞(P < 0.01,图6,表1),但S期细胞仅300和500 μmol/L组出现了明显下降(P < 0.05),而50 μmol/L组剂量较低,细胞周期变化无统计学意义( P >0.05)。50 μmol/L铀染毒24 h后细胞出现早期凋亡和少量坏死,500 μmol/L铀染毒24 h后细胞早期凋亡、晚期凋亡和坏死数量都明显增加(P < 0.01,图7),提示细胞出现了严重损伤。
|
图 6 铀染毒后HK-2细胞周期的变化 Figure 6 Changes in HK-2 cell cycle after uranium exposure 注:S期与对照组相比,*P < 0.05,G1期与对照组相比,**P < 0.01 |
|
|
表 1 铀染毒后 HK-2 细胞周期的变化 Table 1 Changes in HK-2 cell cycle after uranium exposure |

|
图 7 铀染毒后HK-2细胞凋亡的变化 Figure 7 Changes in HK-2 cell apoptosis after uranium exposure |
铀染毒后HK-2细胞活性出现剂量依赖性降低,在光镜下可见细胞收缩,游离细胞增多,细胞透光性下降,提示出现了细胞损伤。并且同一浓度下(除500 μmol/L组),48 h的细胞活性均高于24 h,提示随着铀暴露时间的延长,细胞表现出了一定的适应性反应。多聚磷酸盐颗粒、脂多糖及磷脂双分子层构成了细胞的磷酸储存,当暴露于铀时,细胞主动释放无机磷酸盐,通过螯合作用降低铀的毒性,这是细胞“自我防护”或“解毒”的重要途径,是细胞应对一定浓度重金属暴露时的适应性反应[9-10]。当铀浓度增加到500 μmol/L时,24 h和48 h的细胞活性无差异,说明高浓度的铀暴露超过了细胞的解毒能力,导致细胞出现了持续损伤。
本研究对可溶性铀的内吞外排情况进行了研究:100和300 μmol/L组细胞内吞的铀百分数在24 h后增加不明显,50 μmol/L组内吞百分数逐渐增加,说明铀的内吞存在阈值。相比内吞含量细胞表面结合的铀含量分数较低,随时间略有波动。溶液中的可溶性铀含量在24 h内下降明显,24 h后与100和300 μmol/L组相比,50 μmol/L组下降更明显。本实验首次发现细胞内铀的外排非常迅速,1 h内40%以上的铀都会排出胞外,铀外排量随时间逐渐增加,8 h后50%以上的铀都会排出。铀进入细胞的机制较为复杂,目前尚无直接证据证明存在铀转运蛋白,可能同时存在特异性的转运途径和非特异性的铀内吞途径,第1种途径可以导致低浓度下235U在细胞内的富集;第2种可以导致高浓度下细胞内的铀同位素分数与细胞外的溶液无明显差异,2种途径可能存在浓度阈值,当高于阈值时会触发第2种铀摄入途径[7]。二次离子质谱法(SIMS)实时分析发现铀在接触细胞后的5 min内即出现在细胞核[11],结合本实验结果,说明铀的穿膜(内吞、外排)和运输都是非常迅速的过程。
铀在进入细胞后的代谢和转化过程与其毒性密切相关,透射电镜下观察到铀在细胞内和细胞外均出现了针状样沉淀,沉淀成簇聚集或呈孤立状。关于细胞外的铀沉淀是从细胞内转运出来的还是直接形成于细胞外目前尚无一致结论[11]。本实验除了在细胞内观察到沉淀形成于胞质或溶酶体样的囊泡中,同时还观察到了少量针样沉淀正在形成或从细胞内排出,因此铀沉淀可能是在细胞内形成后,经胞吐过程排出细胞外。高浓度铀暴露后形成的这种针状样沉淀主要由铀、磷酸盐、钾和钙等组成,除了在肾细胞观察到了这种铀形成的沉淀[12],在肝细胞及骨细胞中也发现了沉淀的形成[13-14]。从微生物的研究结果看,相较于碳酸盐和硫酸盐,磷酸盐可以加快铀的固定和转化,可见磷酸盐在铀的固定和转化中起着重要作用[15]。铀沉淀的不同形态(成簇聚集或孤立状)可能代表铀转化固定过程中的不同阶段,在细胞内这种针状样结构主要分布于囊泡内,呈现出典型的溶酶体或自噬囊泡的特性,细胞内铀沉淀的形成与溶酶体和自噬过程相关[16]。成骨细胞可以将铀转化为无毒性的形式,在细胞内和细胞外形成沉淀,细胞毒性与细胞内铀沉淀存在相关性[17]。可见铀沉淀的形成是细胞在铀暴露后的适应性反应,是细胞重要的解毒机制,但当高浓度铀暴露产生大量沉淀,超过细胞的解毒能力时,细胞活性就会出现持续损伤。
细胞周期包括G1、G2、S和M期,由于从DNA含量无法区分G2和M期,因此G2/M期通常合起来代表细胞分裂期。铀暴露后细胞周期的变化可以直接反映细胞的增殖情况变化,铀染毒后细胞均出现了G1期阻滞,S期细胞数也出现了下降,提示细胞生长和代谢过程受到了影响,细胞增值活动受到抑制。镉、汞、砷等重金属都会使细胞周期阻滞在G1期,同时S期细胞减少,但影响机制可能存在差异[18]。砷暴露后磷酸砷的形成抑制E2F1的活性,从而将细胞周期阻滞在G1期[19],汞暴露通过细胞周期B蛋白的积累诱导细胞出现G1期阻滞[20],铀对细胞周期影响的具体机制仍需要进一步研究。铀可以诱导细胞发生早期凋亡和少量坏死,随着铀浓度的增加,细胞凋亡和坏死率都明显增加。低浓度铀可以通过激活caspase-3、caspase-8和caspase-9诱导鼠肾小管上皮细胞发生凋亡,高浓度铀则会导致细胞坏死[21]。细胞坏死与细胞内产生铀沉淀引起溶酶体的裂解密切相关,其详细机制尚未明确。可见铀进入细胞后可以诱导细胞发生凋亡和坏死,并且这些过程与铀沉淀的形成相关。
目前对于铀毒性机制的认识主要集中于氧化损伤、基因蛋白损伤,炎性反应、代谢异常等导致的细胞损伤和细胞死亡,对于铀的化学毒性和毒性机制的认识仍不足[22-23]。细胞内富含磷酸盐的生物大分子(蛋白质、DNA、生物膜等)与铀酰离子有很强的化学亲和性,铀可能在细胞质、囊泡、线粒体和细胞核中积累并通过直接的交互作用或ROS的产生影响细胞器和生物大分子的正常生物学功能,这些毒性损伤反应是其生化作用过程的结果,但目前对铀酰离子体内生化作用的关键过程仍不清楚[24]。同时铀的细胞代谢过程如铀酰离子的细胞内吞、外排等过程尚未明确,细胞内铀酰离子的代谢终点仍不清楚。
本研究利用人肾近曲小管细胞(HK-2)经硝酸铀酰染毒,发现细胞呈现剂量依赖性损伤,细胞周期出现G1期阻滞,细胞出现凋亡和不同程度坏死,细胞生长和代谢过程受到了影响,细胞活性受到了抑制。同时细胞对低浓度铀具有一定的解毒作用,当铀暴露浓度超过了细胞的解毒能力时,细胞就会出现持续损伤。细胞内吞的铀含量在24 h内逐渐增加,同时铀的内吞量存在阈值,细胞表面结合的铀含量分数较低。本研究首次发现细胞内铀的外排非常迅速,1 h内40%以上的铀都会排出胞外,说明铀的内吞、外排过程都非常迅速,这与铀在体内的代谢动力学结果一致,体内摄入的铀90%会在24 h内随尿排出[25]。铀在细胞内和细胞外均会形成针样状沉淀,这是细胞将铀转化为无毒性形式的过程,是细胞在铀暴露后的适应性反应。
综上,本文对铀的细胞内吞、外排和细胞毒性效应进行了研究,以期从基础上认识铀的内吞、外排过程及对细胞活性的影响,更好地认识铀的化学毒性和毒性机制。
| [1] |
Katz S. The chemistry and toxicology of depleted uranium[J]. Toxics, 2014, 2(1): 50-78. DOI:10.3390/toxics2010050 |
| [2] |
Rump A, Eder S, Lamkowski A, et al. A quantitative comparison of the chemo- and radiotoxicity of uranium at different enrichment grades[J]. Toxicol Lett, 2019, 313: 159-168. DOI:10.1016/j.toxlet.2019.07.004 |
| [3] |
张旭霞, 暴一众, 王梦梦, 等. 螯合剂与金属硫蛋白对铀的竞争结合作用[J]. 中国辐射卫生, 2019, 28(1): 12-16. Zhang XX, Bao YZ, Wang MM, et al. Competitive combination with uranium(Ⅵ) between chelating agent and metallothionein[J]. Chin J Radiol Health, 2019, 28(1): 12-16. DOI:10.13491/j.issn.1004-714X.2019.01.004 |
| [4] |
Arzuaga X, Rieth SH, Bathija A, et al. Renal effects of exposure to natural and depleted uranium: a review of the epidemiologic and experimental data[J]. J Toxicol Environ Health B Crit Rev, 2010, 13(7/8): 527-545. DOI:10.1080/10937404.2010.509015 |
| [5] |
刘玉龙, 李明华, 孙晓亮, 等. 贫铀的毒性及解毒促排药物研究进展[J]. 解放军药学学报, 2014, 30(5): 454-458. Liu YL, Li MH, Sun XL, et al. Research progress on toxicity and detoxification drugs of depleted uranium[J]. Pharm J Chin PLA, 2014, 30(5): 454-458. DOI:10.3969/j.issn.1008-9926.2014.05.024 |
| [6] |
Asic A, Kurtovic-Kozaric A, Besic L, et al. Chemical toxicity and radioactivity of depleted uranium: The evidence from in vivo and in vitro studies
[J]. Environ Res, 2017, 156: 665-673. DOI:10.1016/j.envres.2017.04.032 |
| [7] |
Paredes E, Avazeri E, Malard V, et al. Impact of uranium uptake on isotopic fractionation and endogenous element homeostasis in human neuron-like cells[J]. Sci Rep, 2018, 8(1): 17163. DOI:10.1038/s41598-018-35413-4 |
| [8] |
黄微, 高鹏, 宫增艳. 电感耦合等离子体质谱法与液体激光荧光法分析水中铀的比较[J]. 中国辐射卫生, 2019, 28(5): 569-571. Huang W, Gao P, Gong ZY. Comparison of methods for analysis of Uranium in water by inductively coupled plasma mass spectrometry and liquid laser fluorescence[J]. Chin J Radiol Health, 2019, 28(5): 569-571. DOI:10.13491/j.issn.1004-714X.2019.05.025 |
| [9] |
Shen YH, Zheng XY, Wang XY, et al. The biomineralization process of uranium(VI) by Saccharomyces cerevisiae - transformation from amorphous U(VI) to crystalline chernikovite[J]. Appl Microbiol Biotechnol, 2018, 102(9): 4217-4229. DOI:10.1007/s00253-018-8918-4 |
| [10] |
Wang TS, Zheng XY, Wang XY, et al. Different biosorption mechanisms of Uranium(VI) by live and heat-killed Saccharomyces cerevisiae under environmentally relevant conditions[J]. J Environ Radioact, 2017, 167: 92-99. DOI:10.1016/j.jenvrad.2016.11.018 |
| [11] |
Guéguen Y, Suhard D, Poisson C, et al. Low-concentration uranium enters the HepG2 cell nucleus rapidly and induces cell stress response[J]. Toxicol Vitro, 2015, 30(1 pt b): 552-560. DOI:10.1016/j.tiv.2015.09.004 |
| [12] |
Rouas C, Bensoussan H, Suhard D, et al. Distribution of soluble uranium in the nuclear cell compartment at subtoxic concentrations[J]. Chem Res Toxicol, 2010, 23(12): 1883-1889. DOI:10.1021/tx100168c |
| [13] |
Liu F, Du KJ, Fang Z, et al. Chemical and biological insights into uranium-induced apoptosis of rat hepatic cell line[J]. Radiat Environ Biophys, 2015, 54(2): 207-216. DOI:10.1007/s00411-015-0588-3 |
| [14] |
Hurault L, Creff G, Hagège A, et al. Uranium effect on osteocytic cells in vitro
[J]. Toxicol Sci, 2019, 170(1): 199-209. DOI:10.1093/toxsci/kfz087 |
| [15] |
Li FB, Li XY, Cui P. Detoxification of U(VI) by Paecilomyces catenlannulatus investigated by batch, XANES and EXAFS techniques[J]. J Environ Radioact, 2018, 189: 24-30. DOI:10.1016/j.jenvrad.2018.03.005 |
| [16] |
Pierrefite-Carle V, Santucci-Darmanin S, Breuil V, et al. Effect of natural uranium on the UMR-106 osteoblastic cell line: impairment of the autophagic process as an underlying mechanism of uranium toxicity[J]. Arch Toxicol, 2017, 91(4): 1903-1914. DOI:10.1007/s00204-016-1833-5 |
| [17] |
Milgram S, Carrière M, Malaval L, et al. Cellular accumulation and distribution of uranium and lead in osteoblastic cells as a function of their speciation[J]. Toxicology, 2008, 252(1/2/3): 26-32. DOI:10.1016/j.tox.2008.07.054 |
| [18] |
Chen SH, Luo TW, Yu Q, et al. Isoorientin plays an important role in alleviating Cadmium-induced DNA damage and G0/G1 cell cycle arrest[J]. Ecotoxicol Environ Saf, 2020, 187: 109851. DOI:10.1016/j.ecoenv.2019.109851 |
| [19] |
Barrett AK, Rubin SM. Heavy metal in cancer: The cell cycle Jams with arsenic[J]. Cell Cycle, 2017, 16(18): 1641-1642. DOI:10.1080/15384101.2017.1360653 |
| [20] |
Kim MJ, Kim CH, An MJ, et al. Exposure to mercury induced early apoptotic signals in human placental BeWo cells through alteration of cell cycle regulation[J]. Mol Cell Toxicol, 2020, 16(4): 419-429. DOI:10.1007/s13273-020-00098-2 |
| [21] |
Thiébault C, Carrière M, Milgram S, et al. Uranium induces apoptosis and is genotoxic to normal rat kidney (NRK-52E) proximal cells[J]. Toxicol Sci, 2007, 98(2): 479-487. DOI:10.1093/toxsci/kfm130 |
| [22] |
Ma MH, Wang RX, Xu LN, et al. Emerging health risks and underlying toxicological mechanisms of uranium contamination: Lessons from the past two decades[J]. Environ Int, 2020, 145: 106107. DOI:10.1016/j.envint.2020.106107 |
| [23] |
Soltani M, Zarei MH, Salimi A, et al. Mitochondrial protective and antioxidant agents protect toxicity induced by depleted uranium in isolated human lymphocytes[J]. J Environ Radioact, 2019, 203: 112-116. DOI:10.1016/j.jenvrad.2019.03.009 |
| [24] |
Chatelain G, Bourgeois D, Ravaux J, et al. Incorporation of uranium into a biomimetic apatite: physicochemical and biological aspects[J]. J Biol Inorg Chem, 2015, 20(3): 497-507. DOI:10.1007/s00775-014-1231-5 |
| [25] |
Faa A, Gerosa C, Fanni D, et al. Depleted uranium and human health[J]. Curr Med Chem, 2018, 25(1): 49-64. DOI:10.2174/0929867324666170426102343 |




