2. 山东第一医科大学附属济南市中心医院肿瘤科,山东 济南 250013
2. Department of Oncology, Jinan Central Hospital , The Affiliated Hospital of Shandong First Medical University, Jinan 250013 China
放射治疗已成为治疗胸部肿瘤(肺癌、食管癌)常用手段之一[1-2]。目前,我国放疗技术取得很大进展,但放射性肺损伤的发生仍不可避免[3]。有研究表明,临床上大约20%的胸部肿瘤患者接受放射治疗后会出现明显症状的放射性肺损伤[4-5]。放射性肺损伤是多种效应细胞与多种细胞因子综合作用的结果,其病程可分为2部分:早期放射性肺炎和晚期放射性肺纤维化[6-7]。放射性肺炎通常在放疗后几个小时内发展,持续1至2个月,而放射性肺纤维化发生较晚,通常在2个月后,放射性肺纤维化的出现通常表明是不可逆的损害[6,8]。放射性肺损伤的发生严重限制了放疗可输送的最大剂量,降低了肿瘤的控制概率,并导致呼吸困难,生活质量降低。但目前放射性肺损伤的发病机制尚不清楚,缺乏有效的治疗手段。因此,深入了解放射性肺损伤发病机制已成为肿瘤放射领域亟待解决的难题之一。
冷诱导RNA结合蛋白(Cold induced RNA binding protein,CIRBP)属于冷休克蛋白家族的一种,由一个氨基末端共有序列RNA结合结构域和一个羧基末端富含甘氨酸的结构域组成,并作为RNA伴侣促进翻译。近年来有研究表明,CIRBP是一种损伤相关分子模式(DAMP),在一些疾病中(如肝损伤、肾损伤和结肠炎)表现出促炎因子的特性,可造成组织和器官不同程度的损伤[9]。CIRBP可能在早期放射性肺损伤中发挥重要作用,其表达及作用至今尚未见报道。本研究构建放射性肺损伤小鼠模型,分别在蛋白水平和mRNA水平检测CIRBP的表达,探讨了其在早期放射性肺损伤中的作用,为放射性肺损伤的发生机制及寻找防治靶点提供实验基础。
1 材料与方法 1.1 动物及分组C57BL/6 SPF级小鼠30只,雄性,8周龄,体质18~20 g,购自山东省济南朋悦实验动物有限公司。动物饲养于山东省医学科学院动物房,自然光照,室内温度20℃~29℃。按体重将30只小鼠分为对照组和模型组,每组各15只。对照组与模型组饲养条件相同。
1.2 模型制备模型组小鼠用10%水合氯醛(0.04 mL/kg)腹腔注射进行麻醉,待其麻醉后,将小鼠放置于照射台,采用6 MV的X射线进行单次胸部照射,照射剂量为20 Gy,照射位置为头部以下、剑突以上,剂量率为2 Gy/min(图1),照射5周;对照组不做任何处理。解剖所有小鼠。

|
图 1 X射线20 Gy单次胸部照射 Figure 1 Single chest X-ray irradiation with a dose of 20 Gy |
模型组小鼠在照射后5周,将所有小鼠进行解剖。首先将小鼠麻醉,摘除眼球放血,之后脱颈处死小鼠,迅速取出肺组织,经生理盐水漂洗,组织用10%的中性甲醛溶液固定肺组织。固定48 h后,取右肺中叶组织进行常规脱水、透明、浸蜡和包埋。将蜡块经4 μm的连续切片制成石蜡切片,石蜡切片经H&E染色观察肺组织病理形态变化。HE染色的具体步骤如下:首先将石蜡切片浸入二甲苯脱蜡,每缸40 min;然后切片依次经过梯度乙醇(100%-95%-90%-80%),每缸5 min,自来水冲洗;苏木素中浸染5 min,最终细胞核被染成蓝色,流水冲洗,用分化液分化切片,洗去过染的苏木素,由于苏木素在酸性条件下呈现红色离子状态,因此经过分化后,要经返蓝处理;返蓝后的切片浸入伊红溶液1 min染细胞浆,使得细胞浆被染成红色;最后切片经低浓度到高浓度的乙醇脱水、二甲苯透明和中性树胶封片即可。在普通光学显微镜下观察HE染色结果。
1.4 Masson染色将制好的石蜡切片脱蜡至水,用配制好的Weigert铁苏木素染色液染色6 min;然后用酸性乙醇分化液分化5 s,洗去多余的Weigert铁苏木素染色液,水洗,Masson蓝化液返蓝5 min,水洗;丽春红品红染色液染色6 min,用弱酸溶液洗1 min;之后磷钼酸溶液洗,这时在显微镜下控制,直到胶原纤维呈淡红色,纤维呈红色即可;接下来直接放入苯胺蓝染色液中染色2 min,弱酸溶液洗1 min;最后经无水乙醇脱水、二甲苯透明和中性树胶封片即可。光学显微镜下观察胶原纤维沉积情况,其结果通过Image J进行分析。
1.5 免疫组化检测肺组织中炎症因子IL-6和TNF-α表达将制好的石蜡切片经二甲苯脱蜡、高浓度-低浓度的乙醇脱水和自来水冲洗后,3%过氧化氢浸泡20 min以消除内源性的过氧化物酶;采用柠檬酸钠修复液进行抗原修复20 min,待其自然冷却后,采用驴血清封闭,37℃孵育30 min,甩干,紧接着滴加一抗,一抗采用IL-6(1∶100,#bs-0782R,Bioss,北京,中国)和TNF-α(1;100,#bs-10802R,Bioss,北京,中国),4℃过夜,待其恢复至室温,PBS洗3遍,每次5 min,然后滴加二抗(1∶200,#bs-0295D-HRP,Bioss,北京,中国),37℃孵育1 h,PBS洗3遍,每次5 min,DAB显色,低浓度到高浓度乙醇脱水,二甲苯透明,中性树胶封片。其结果H-Score通过软件QuantCenter 2.2得出。
1.6 RT-PCR检测肺组织中CIRBP的表达称取小鼠肺组织50 mg以提取RNA,trizol 法提取各组总RNA,检测RNA 的浓度和纯度,逆转录合成 cDNA,按照设计体系及条件进行实验,以β-肌动蛋白( β-actin) 为内参,得出Ct值。采用公式 2−ΔCt 法计算结果,分析CIRBP的表达,重复3次。CIRBP 引物序列上游:TCTCCGAAGTGGTGGTGGTA,下游:CATGGCGTCCTTAGCGTCAT。β-actin引物序列上游:GGCTGTATTCCCCTCCATCG,下游:CCAGTTGGTAACAATGCCATGT。
1.7 免疫荧光检测肺组织中CIRBP的表达将制好的石蜡切片经二甲苯脱蜡、高浓度-低浓度的乙醇脱水和自来水冲洗后,采用EDTA修复液进行抗原修复20 min,待其自然冷却后,采用山羊血清封闭,37℃孵育30 min,甩干,滴加一抗CIRBP(1∶100,#bs-0782R,Bioss,北京,中国),4℃过夜,待其恢复至室温,PBS洗3遍,每次5 min,然后避光滴加荧光二抗(1∶50,#ZF-0516,中杉金桥,北京,中国),37℃孵育1 h,PBS洗3遍,每次5 min,滴加DAPI封片。阳性细胞所占比例通过Image J进行分析。
1.8 Western blot检测肺组织中CIRBP的表达取适量肺组织,采用RIPA裂解液提取肺组织总蛋白,进行SDS-PAGE电泳,转膜至PVDF膜上。5%脱脂牛奶封闭后,加入一抗CIRBP(1∶100,#bs-0782R,Bioss,北京,中国),4℃过夜。室温下孵育二抗60 min,ECL液显影。
1.9 图像处理及统计学分析使用SPSS 25.0统计软件进行统计学分析。文中数据经正态性检验符合正态分布,采用
采用H&E染色方法分别对对照组和模型组小鼠肺组织进行染色,观察病理结构变化。结果表明,对照组小鼠肺组织病理组织结构相对正常,无肺组织毛细血管扩张充血,无炎细胞浸润,无肺泡间隔增厚。与对照组相比,模型组小鼠肺组织可见毛细血管扩张充血,炎细胞浸润,肺泡间隔增厚。见图2。

|
图 2 肺组织病理学形态变化(H&E染色 × 400) Figure 2 Pathological changes of lung tissue (hematoxylin-eosin staining, × 400) |
采用Masson染色观察肺组织中胶原纤维沉积情况。结果表明,蓝色为胶原纤维,与对照组相比,模型组小鼠肺组织可见少量蓝染的胶原纤维沉积,但差异无统计学意义(t = 1.758,P > 0.05)。见 图3。

|
图 3 Masson染色分析肺组织中胶原纤维沉积面积所占比例(× 400) Figure 3 Percentage of collagen deposition area in lung tissue by Masson staining analysis (× 400) |
采用免疫组织化学技术检测肺组织炎症因子IL-6和TNF-α表达水平。结果表明,棕黄色颗粒为阳性表达信号,IL-6和TNF-α主要表达于胞浆。与对照组相比,模型组小鼠肺组织中IL-6和TNF-α表达水平均明显升高,差异有统计学意义(187.22 ± 34.77 vs 129.41 ± 5.58,t = 3.179,P < 0.05; 187.02 ± 19.16 vs 137.52 ± 23.53,t = 5.069,P < 0.05)。见 图4。

|
图 4 免疫组化检测肺组织炎症因子IL-6和TNF-α表达结果(× 400) Figure 4 Expression of inflammatory factors IL-6 and TNF-α in lung tissue by immunohistochemistry (× 400) |
采用RT-PCR技术在mRNA水平检测CIRBP的表达变化。结果显示,与对照组相比,模型组小鼠肺组织中CIRBP mRNA明显升高(1.97 ± 0.39 vs 1 ± 0.08,t = 3.45,P < 0.05)。见 表1。
|
|
表 1 小鼠肺组织中CIRBP mRNA的表达水平 Table 1 CIRBP mRNA expression in lung tissue |
采用免疫荧光和Western blot技术检测肺组织中CIRBP蛋白的表达水平。荧光结果显示,CIRBP阳性呈现红色荧光信号。与对照组相比,模型组小鼠肺组织中CIRBP蛋白的表达明显升高(14.76 ± 1.61vs 9.32 ± 1.26,t = 3.751,P = 0.01)。Western blot结果显示,与对照组相比,模型组小鼠肺组织中CIRBP蛋白的表达明显升高(1.49 ± 0.14 vs 1.13 ± 0.17,t = 2.819,P = 0.03),与荧光结果一致。见图5。
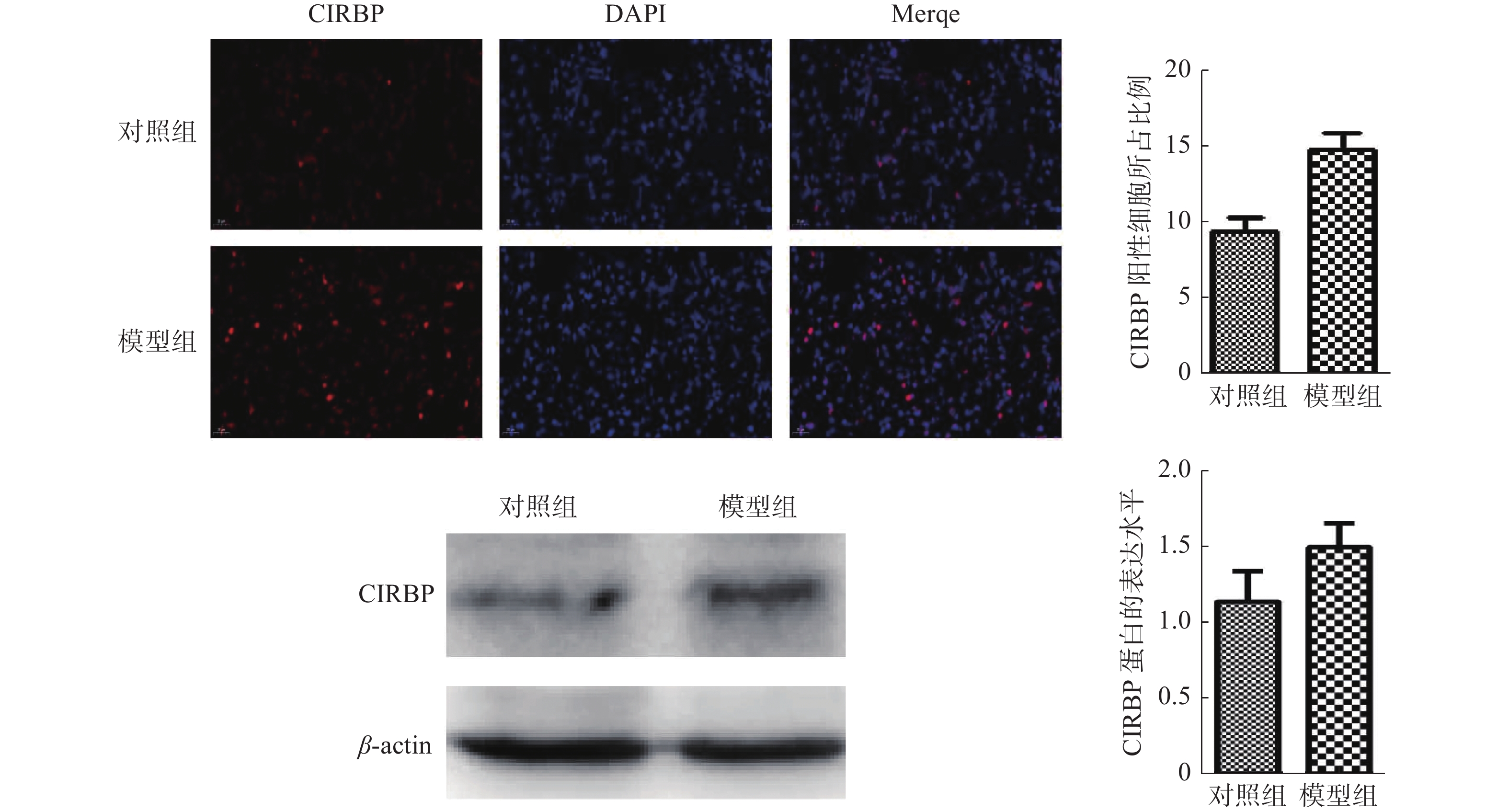
|
图 5 免疫荧光和western blotting技术检测肺组织中CIRBP蛋白的表达水平(× 400) Figure 5 CIRBP protein expression in lung tissue by immunofluorescence assay and Western blot (× 400) |
放射性肺损伤是多种效应细胞与多种细胞因子综合作用的结果,主要包括早期的放射性肺炎和晚期的放射性肺纤维化。它发生在20%左右的患者中,限制了可输送的最大剂量,降低了肿瘤的控制概率,并导致呼吸困难,生活质量受损,临床上仍缺乏有效的治疗手段。但目前放射性肺损伤的发病机制仍未阐明,因此,阐明放射性肺损伤发病机制进而采取有效的防治手段已成为肿瘤放射领域重中之重。CIRBP是哺乳动物中发现的第一种冷休克蛋白,具有促炎的特性,通过促进促炎细胞因子的形成及表达诱导组织细胞损伤,是一种损伤相关分子模式(DAMP)[10-15]。Cen等[16]利用CIRBP敲基因小鼠证明了CIRBP缺失可显著降低促炎因子、髓过氧化物酶和细胞凋亡水平,减轻炎症反应,导致损伤减轻。因此推测CIRBP可能在早期放射性肺损伤中发挥重要作用。
本研究结果表明,与对照组相比,照射模型组肺组织表现出典型放射性肺炎的病理变化,如结构破坏,毛细血管扩张充血,炎细胞浸润,少量胶原纤维沉积,与前期研究相符[17-22]。IL-6和TNF-α被认为是重要的炎症因子,在放射性肺损伤中发挥重要的作用[23-24]。随后,我们采用免疫组化方法检测肺组织中炎症因子IL-6和TNF-α的表达,发现两者表达均显著增加,且具有统计学意义。综上所述,放射性肺损伤模型构建成功。
为了进一步探究CIRBP在放射性肺损伤中的表达及作用,本研究通过免疫荧光技术、Western blot技术和PT-PCR技术初步分析其在蛋白水平和mRNA水平的表达变化。研究发现,与对照组相比,模型组CIRBP的表达水平明显升高,与之前类似研究结果相符[13-14]。因此我们推测在放射性肺损伤早期CIRBP表达增加,导致肺组织损伤引起炎症反应,并可进一步激活下游TLR4/NF-κB相关信号通路,并且又可以调控IL-6、TNF-α等促炎因子的表达,最终导致和加剧了炎症反应的发生,但其具体机制仍需要进一步研究。
综上所述,CIRBP在放射性肺损伤中的表达明显升高,可能是放射性肺损伤发生的重要促炎因子,因此靶向CIRBP有可能成为放射性肺损伤临床治疗的一种手段。
| [1] |
李鹏, 陈凡, 孙祥益, 等. 放射性心脏损伤动物模型相关实验研究进展[J]. 中国辐射卫生, 2020, 29(1): 93-97. Li P, Chen F, Sun XY, et al. Advances in experimental research on radiation-induced heart injury in animal models[J]. Chin J Radiol Health, 2020, 29(1): 93-97. DOI:10.13491/j.issn.1004-714X.2020.01.022 |
| [2] |
仪丽荣, 田梅, 朴春南, 等. 丙二醇对预防5.5 Gy 60Co γ射线全身照射小鼠辐射损伤的初步探讨
[J]. 中国辐射卫生, 2019, 28(1): 17-21. Yi LR, Tian M, Piao CN, et al. A preliminary discussion on preventive effects of 1, 2-propanediol against injury induced by 5.5 Gy 60Co γ ray in mice [J]. Chin J Radiol Health, 2019, 28(1): 17-21. DOI:10.13491/j.issn.1004-714X.2019.01.005 |
| [3] |
郭峰, 杜傲男, 拾景磊, 等. 食管癌伴糖尿病患者调强放疗后放射性肺炎发生的临床研究[J]. 中国辐射卫生, 2018, 27(6): 628-630. Guo F, Du AN, Shi JL, et al. Clinical study of radiation pneumonitis in patients with esophageal cancer and diabetes after intensity-modulated radiotherapy[J]. Chin J Radiol Health, 2018, 27(6): 628-630. DOI:10.13491/j.issn.1004-714X.2018.06.031 |
| [4] |
Giuranno L, Ient J, De Ruysscher D, et al. Radiation-induced lung injury (RILI)[J]. Front Oncol, 2019, 9: 877. DOI:10.3389/fonc.2019.00877 |
| [5] |
Hanania AN, Mainwaring W, Ghebre YT, et al. Radiation-induced lung injury: assessment and management[J]. Chest, 2019, 156(1): 150-162. DOI:10.1016/j.chest.2019.03.033 |
| [6] |
Huang YJ, Zhang WQ, Yu FR, et al. The cellular and molecular mechanism of radiation-induced lung injury[J]. Med Sci Monit, 2017, 23: 3446-3450. DOI:10.12659/msm.902353 |
| [7] |
Arroyo-Hernández M, Maldonado F, Lozano-Ruiz F, et al. Radiation-induced lung injury: current evidence[J]. BMC Pulm Med, 2021, 21(1): 9. DOI:10.1186/s12890-020-01376-4 |
| [8] |
Lu LN, Sun C, Su Q, et al. Radiation-induced lung injury: latest molecular developments, therapeutic approaches, and clinical guidance[J]. Clin Exp Med, 2019, 19(4): 417-426. DOI:10.1007/s10238-019-00571-w |
| [9] |
Aziz M, Brenner M, Wang P. Extracellular CIRP (eCIRP) and inflammation[J]. J Leukoc Biol, 2019, 106(1): 133-146. DOI:10.1002/JLB.3MIR1118-443R |
| [10] |
Xiao X, Zhang WT, Hua DP, et al. Cold-inducible RNA-binding protein (CIRBP) promotes porcine reproductive and respiratory syndrome virus (PRRSV)-induced inflammatory response[J]. Int Immunopharmacol, 2020, 86: 106728. DOI:10.1016/j.intimp.2020.106728 |
| [11] |
Lujan DA, Ochoa JL, Hartley RS. Cold-inducible RNA binding protein in cancer and inflammation[J]. Wiley Interdiscip Rev RNA, 2018, 9(2). DOI:10.1002/wrna.1462.
|
| [12] |
Chen LX, Ran DH, Xie WY, et al. Cold-inducible RNA-binding protein mediates cold air inducible airway mucin production through TLR4 /NF-κBsignaling pathway[J]. Int Immunopharmacol, 2016, 39: 48-56. DOI:10.1016/j.intimp.2016.07.007 |
| [13] |
刘和宇, 夏伟. 冷诱导RNA结合蛋白的生物学功能与信号通路[J]. 中国生物化学与分子生物学报, 2018, 34(7): 697-705. Liu HY, Xia W. Biological function and signal pathway of CIRBP[J]. Chin J Biochem Mol Biol, 2018, 34(7): 697-705. DOI:10.13865/j.cnki.cjbmb.2018.07.02 |
| [14] |
Khan MM, Yang WL, Brenner M, et al. Cold-inducible RNA-binding protein (CIRP) causes Sepsis-associated acute lung injury via induction of endoplasmic Reticulum stress
[J]. Sci Rep, 2017, 7: 41363. DOI:10.1038/srep41363 |
| [15] |
张永, 刘宇, 张建, 等. 深低温假死技术在创伤失血性休克中应用及对外周血冷诱导RNA结合蛋白表达影响[J]. 临床军医杂志, 2020, 48(12): 1391-1393. Zhang Y, Liu Y, Zhang J, et al. Application of deep hypothermia suspended death technique in traumatic hemorrhagic shock and its effect on the expression of cold induced RNA-binding protein in peripheral blood[J]. Clinical J Med Officer, 2020, 48(12): 1391-1393. DOI:10.16680/j.1671-3826.2020.12.01 |
| [16] |
Cen C, McGinn J, Aziz M, et al. Deficiency in cold-inducible RNA-binding protein attenuates acute respiratory distress syndrome induced by intestinal ischemia-reperfusion[J]. Surgery, 2017, 162(4): 917-927. DOI:10.1016/j.surg.2017.06.004 |
| [17] |
Wu X, Ji HY, Wang YL, et al. Melatonin alleviates radiation-induced lung injury via regulation of miR-30e/NLRP3 axis[J]. Oxid Med Cell Longev, 2019, 4087298. DOI:10.1155/2019/4087298 |
| [18] |
Jiang YF, You FM, Zhu J, et al. Cryptotanshinone ameliorates radiation-induced lung injury in rats[J]. Evid Based Complement Alternat Med, 2019(5), 1-14. DOI:10.1155/2019/1908416 |
| [19] |
Cao K, Lei X, Liu H, et al. Polydatin alleviated radiation-induced lung injury through activation of Sirt3 and inhibition of epithelial-mesenchymal transition[J]. J Cell Mol Med, 2017, 21(12): 3264-3276. DOI:10.1111/jcmm.13230 |
| [20] |
Lierova A, Kasparova J, Pejchal J, et al. Attenuation of radiation-induced lung injury by hyaluronic acid nanoparticles[J]. Front Pharmacol, 2020, 11: 1199. DOI:10.3389/fphar.2020.01199 |
| [21] |
Zanoni M, Cortesi M, Zamagni A, et al. The role of mesenchymal stem cells in radiation-induced lung fibrosis[J]. Int J Mol Sci, 2019, 20(16): E3876. DOI:10.3390/ijms20163876 |
| [22] |
胡蝶. TGF-β3通过上皮间质转化抑制放射性肺纤维化及其机制研究[D]. 广州: 广东药科大学, 2018. Hu D. The mechanisms of TGF-β3 ameliorating radiation-induced pulmonary fibrosis by epithelial-mesenchymal transition[D]. Guangzhou: Guangdong Pharmaceutical University, 2018. |
| [23] |
Li X, Zhuang XB, Qiao TK. Role of ferroptosis in the process of acute radiation-induced lung injury in mice[J]. Biochem Biophys Res Commun, 2019, 519(2): 240-245. DOI:10.1016/j.bbrc.2019.08.165 |
| [24] |
Yao QW, Wang XY, Li JC, et al. Ophiopogon japonicus inhibits radiation-induced pulmonary inflammation in mice
[J]. Ann Transl Med, 2019, 7(22): 622. DOI:10.21037/atm.2019.11.01 |




