2. 济宁市第一人民医院放射科,山东 济宁 272002
2. Department of Radiology, Jining NO.1 People’s Hospital,Jining 272002 China
目前,胃肠道间质瘤(gastrointestional stromal tumors,GISTs)被公认为一类呈多分化性的潜在恶性间叶源性肿瘤,术前诊断较为困难,其初步诊断主要依靠影像学检查,但确诊及危险度评估仍需依靠病理学和免疫组织化学CD117蛋白过度表达。2008年,国外学者Joensuu等[1]根据肿瘤大小、核分裂象、肿瘤原发部位及肿瘤是否破裂将其生物学行为分为极低危险、低度危险、中度危险到高度危险性4类。文献报道高危险组的GISTs引起的死亡率及复发率明显高于低度危险组,而且高危险组的远处转移亦多见[2]。本组资料旨在通过分析不同危险度GISTs的MSCT影像学表现,来进一步探讨CT征象对GISTs病变危险程度的评估价值。
1 材料与方法 1.1 一般资料回顾性分析我院2015年6月—2019年5月120例经手术病理证实的GISTs患者的临床病理及MSCT影像学资料,本组资料中男性占43.3%(52/120),女性占56.7%(68/120);年龄29~85岁,平均(58.93 ± 11.99)岁。临床表现腹痛、腹胀或腹部不适37例,出现反酸、嗳气、恶心、呕吐21例,呕血、黑便34例,查体偶然发现28例。
1.2 仪器与方法所有患者均进行腹部或腹盆部增强CT扫描,使用128或64排飞利浦螺旋CT扫描(Philips Brilliance)。扫描参数为:120 kV,300 mA,螺距1.0,扫描层厚、层距均为5 mm,矩阵512 × 512,并经后处理将图像转换为1 mm层厚。扫描时均采取仰卧位,扫描范围为自膈顶至盆底。检查前,空腹6~8 h,分次饮用800~1000 mL温开水,先行平扫,强化扫描时采用高压注射器经肘静脉团注100 ml碘海醇注射液,速率为2.5~3.0 mL/s。注射造影剂后25~30 s、60~70 s和120~180 s后分别扫描作为动脉期、静脉期和延迟期。
1.3 图像阅读与分析由2名高年资影像学医师采用盲法分别对图像进行观察,测量并记录每个病灶CT影像学特征。测量肿瘤的平扫和增强扫描CT值时,感兴趣区(region of interest,ROI)的勾画应选择病变内部的实性部分或除血管以外的明显强化区域。
1.4 病理及免疫组织学分析GISTs诊断及危险度分级参考2008年修改后的美国立卫生研究院(NIH)分类,将肿瘤分为极低危险组、低度危险组、中度危险组、高度危险组。由于极低危险性和低危险性GISTs有较好的预后,因此在本组资料中将两者合并为一组。
1.5 数据处理与分析采用SPSS 24.0软件进行统计分析。对不同危险度GISTs病变的各个MSCT影像学观察指标之间的比较进行单因素分析。对计数资料用例数n和百分比%表示,多组间比较采用卡方检验/Fisher精确检验。对计量资料采用均数 ± 标准差(
本组资料120例GISTs病例中发生在胃部占81.67%(98/120),小肠占15.83%(19/120),其他部位占2.50%(3/120)。不同危险度肿瘤的最大径分别为低度危险组(3.01 ± 0.96) cm,中度危险组(5.47 ± 1.64) cm,高度危险组(10.15 ± 3.41) cm。经手术病理证实:极低度和低度危险性55例,中度危险性28例,高度危险性37例。GISTs的CT影像特征及Ki-67增殖指数与病理危险程度分级的关系见表1,各期CT值及强化程度与病理危险程度分级的关系见表2。由表2可以看出,在各级危险度之间静脉期及延迟期CT值平均值均高于动脉期,通过配对样本t检验,极低和低级及中级危险度强化各期CT值之间两两对比有统计学差异(P < 0.001),而在高度危险度静脉期和延迟期及Vp和Dp的CT值之间两两对比无统计学差异( P = 0.361 > 0.05)。
|
|
表 1 GISTs的CT影像特征及Ki-67增殖指数与病理危险程度分级的关系 Table 1 CT features of GISTs and Ki-67 proliferation index in relation to pathological risk classification |
|
|
表 2 GISTs各期CT值及强化程度与病理危险程度分级的关系 Table 2 Relationship between CT value and enhancement degree of GISTs and pathological risk grade |
GISTs占所有胃肠道肿瘤的不到3%,其发病无明显性别差异,发病年龄主要集中在50~60岁。GISTs多发生于胃(60%~70%)及小肠(20%~30%),较少发生于食管、结肠以及直肠,偶有发生在胃肠道外的间质瘤,发生于胃肠道外的间质瘤主要指发生于网膜、肠系膜和腹膜的间质瘤[3-4]。本组资料中发生在大网膜及肠系膜1例,小网膜1例。有国外学者研究表明,非胃部间质瘤较胃部间质瘤风险度更高[5],与本组研究结果一致。胃肠道间质瘤的临床症状无特异性,主要与肿瘤的发生部位、大小、是否引起梗阻及肿瘤的良恶性有关。MSCT因其高分辨率、扫描速度快、后处理技术强大等特点成为GISTs诊断主要手段,特别是多期增强扫描,更能很好地显示肿块的形态大小、边缘及其与周围脏器之间的关系、密度、内部结构、强化方式以及有无肿瘤供血血管,可以更好的评价肿瘤血供特征,对肿瘤的诊断和鉴别诊断以及手术方式的选择有很多大的临床价值[6]。
Ki-67核蛋白是一种反映细胞分裂和增殖活力的标志物,可用于肿瘤良恶性的诊断、侵袭行为和判断预后。Ki-67的表达水平反映肿瘤细胞增殖活性,增殖性越强,则肿瘤危险度越高。本组研究结果与文献报道[7]一致。
在已有的评估体系中普遍认为肿瘤大小对GISTs的恶性程度区分有者重要价值,Zhang Qingwei等[8]研究表明GISTs肿瘤大小与Ki-67指数正相关,肿瘤越大,恶性程度越高,与本组资料研究结果一致。本组研究显示不同危险程度GISTs在病变的部位、形态、生长方式、囊变坏死及瘤周脂肪间隙方面均有统计学差异(P < 0.05),与国内学者 [9-11]研究结果一致。GISTs实质中出现钙化的机制尚无统一定论,大多数认为钙化不参与该肿瘤的危险度评分。
增强CT对于GISTs的诊断及危险度评估有重要价值,本组资料120例GISTs中有不均质强化79例,均匀强化41例,强化峰值期主要集中在延迟期(80%,96/120),研究结果显示病灶在CT增强扫描后动脉期呈轻度强化(图1B),静脉期呈中度强化(图1C),至延迟期仍然持续强化(图1D),呈现渐进性强化的特点。其中高度危险组静脉期与延迟期之间CT值无明显差异,可能是由于高危险度肿瘤体积较大,囊变、坏死较多,平均微小血管分布密度可能较低,因此导致强化进展不明显。国内任阿红等[12]研究认为所有GISTs病变在CT增强扫描后呈渐进性强化的趋势,但其增强扫描未进行延迟扫描,无法进一步评估该肿瘤延迟期的强化特点。国内陶咏[13]研究认为胃间质瘤三期增强扫描中动脉期及静脉期实质部分呈中度至重度明显强化,且静脉期强化程度明显超过动脉,至延迟期仍然持续明显强化,与本组研究结果一致。有国内外学者[14-15]研究认为小肠间质瘤多为明显不均匀强化且出现动脉期强化峰值,本研究资料中强化峰值期为动脉期有5例,其中4例为小肠间质瘤,1例为胃间质瘤。
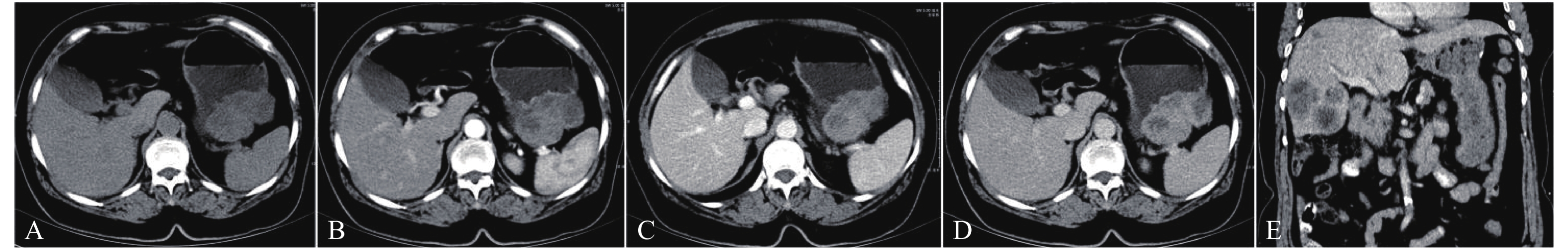
|
图 1 胃间质瘤MSCT影像图 Figure 1 MSCT imaging of gastric stromal tumors 注:患者,女性,63岁。呕血、黑便4天。A:平扫示胃体大弯侧见软组织肿块,约7.0 cm × 4.1 cm,实质部分CT值约34 Hu,形态不规则、边缘分叶,跨壁生长,其内可见囊变坏死,未见明显钙化灶;B~D:增强三期扫描实质部分呈渐进性不均匀明显强化,CT值分别约46 Hu、60 Hu、74 Hu,囊变坏死区不强化;E:复查可见肝脏及大网膜多发转移瘤。病理:高度危险性胃间质瘤,Ki-67增殖指数约15%。 |
本研究资料中病灶在增强扫描后瘤周或瘤内见供血血管穿行者占46%(55/120),穿行血管影多见于动脉期或静脉期,结果显示此种现象在不同危险度GISTs之间具有统计学差异(P < 0.001),与国内学者研究一致 [12],因此可作为提示肿瘤为恶性或潜在恶性的影像学表现。
GISTs转移一般常发生腹膜、网膜、肠系膜等浆膜组织的转移,肝转移也常见,淋巴结肿大及腹腔外转移很少见[16]。本组资料中共有6例发生转移,1例肝转移合并大网膜多发转移(图1E),3例肝转移,1例小肠系膜多发转移,1例肠系膜、盆腹腔腹膜及大网膜多发转移,均为高度危险性。
由于GISTs的多向分化性,最终的确诊主要依靠病理及免疫组织化学法,鉴别诊断如下:①胃平滑肌源性肿瘤,多见于贲门周围,形态扁长,多数呈渐进性轻度较均匀强化;②胃神经源性肿瘤,多表现为类圆形软组织肿块,形态多较规则,多数呈缓慢持续性轻度较均匀强化,周围可出现反应性淋巴结增大;③胃肠道上皮恶性肿瘤,病灶以黏膜破坏为主,多表现为胃肠管壁弥漫增厚、僵硬及龛影,易导致管腔环形狭窄及梗阻,局部淋巴结转移常见;④胃肠道淋巴瘤,多见于小肠,病变范围广,管壁呈环形增厚,管腔常呈“动脉瘤样扩张”,周围淋巴结肿大,肿瘤强化不如GISTs明显;⑤肠系膜淋巴瘤,肠系膜淋巴结受累常见,表现为多发圆形或类圆形软组织肿块,包绕肠系膜上动脉形成“夹心饼”样改变,增强后呈轻至中度强化;⑥当GISTs侵及邻近组织,与周围组织分界不清时,还需与相应部位其他肿瘤相互鉴别。
综上,通过观察GISTs的MSCT影像特征,分析GISTs的发生部位、肿瘤最大径、形态、生长方式、有无囊变坏死、瘤周脂肪间隙、强化方式、瘤周及瘤内血管、强化峰值所在期及有无转移方面可初步判定肿瘤危险度,对后期诊断与制定治疗方案及预后都有重要的参考价值。
| [1] |
Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J]. Hum Pathol, 2008, 39(10): 1411-1419. DOI:10.1016/j.humpath.2008.06.025 |
| [2] |
Ahmed I, Welch NT, Parsons SL. Gastrointestinal stromal tumours (GIST) - 17 years experience from Mid Trent Region (United Kingdom)[J]. Eur J Surg Oncol, 2008, 34(4): 445-449. DOI:10.1016/j.ejso.2007.01.006 |
| [3] |
汤浩, 丁海蛟. 胃食管反流病发病因素研究[J]. 临床军医杂志, 2020, 48(6): 746-747. Tang H, Ding HJ. Study on the pathogenesis of gastroesophageal reflux disease[J]. Clinical Journal of Medical Officers, 2020, 48(6): 746-747. DOI:10.16680/j.1671-3826.2020.06.42 |
| [4] |
Agaimy A, Wünsch PH, Dirnhofer S, et al. Microscopic gastrointestinal stromal tumors in esophageal and intestinal surgical resection specimens: a clinicopathologic, immunohistochemical, and molecular study of 19 lesions[J]. Am J Surg Pathol, 2008, 32(6): 867-873. DOI:10.1097/PAS.0b013e31815c0417 |
| [5] |
Hatipoğlu E. Extragastrointestinal stromal tumor (EGIST): a 16-year experience of 13 cases diagnosed at a single center[J]. Med Sci Monit, 2018, 24: 3301-3306. DOI:10.12659/MSM.907654 |
| [6] |
李光民, 储金秀, 杨文川. 应用多排螺旋CT诊断胃肠道间质瘤[J]. 中国辐射卫生, 2010, 19(2): 236-237. Li GM, Chu JX, Yang WC. Diagnosis of gastrointestinal stromal tumor by multi-slice spiral CT[J]. Chin J Radiol Health, 2010, 19(2): 236-237. DOI:10.13491/j.cnki.issn.1004-714x.2010.02.073 |
| [7] |
朱从波, 廖国庆, 赵丁民. Ki-67对胃肠道间质瘤预后的评估价值[J]. 临床与病理杂志, 2018, 38(8): 1632-1639. Zhu CB, Liao GQ, Zhao DM. Prognostic value of Ki-67 index in gastrointestinal stromal tumor[J]. Int J Pathol Clin Med, 2018, 38(8): 1632-1639. DOI:10.3978/j.issn.2095-6959.2018.08.007 |
| [8] |
Zhang QW, Gao YJ, Zhang RY, et al. Personalized CT-based radiomics nomogram preoperative predicting Ki-67 expression in gastrointestinal stromal tumors: a multicenter development and validation cohort[J]. Clin Transl Med, 2020, 9(1): 12. DOI:10.1186/s40169-020-0263-4 |
| [9] |
张殿彩, 李强, 杨力, 等. 影响1260例胃癌脉管癌栓形成的临床病理因素分析[J]. 中华消化外科杂志, 2017, 16(3): 269-274. Zhang DC, Li Q, Yang L, et al. Analysis of clinicopathologic factors affecting formation of lymphovascular invasion in 1 260 patients with gastric cancer[J]. Chin J Dig Surg, 2017, 16(3): 269-274. DOI:10.3760/cma.j.issn.1673-9752.2017.03.010 |
| [10] |
黄婧颖, 张渺娜, 王新立, 等. 胃肠道间质瘤的MSCT表现与病理危险程度分级的关系[J]. 中国中西医结合影像学杂志, 2019, 17(1): 44-47, 51. Huang JY, Zhang MN, Wang XL, et al. Relationship between MSCT findings and risk assessment of gastrointestinal stromal tumor[J]. Chin Imaging J Integr Tradit West Med, 2019, 17(1): 44-47, 51. DOI:10.3969/j.issn.1672-0512.2019.01.013 |
| [11] |
冯秋霞, 孙娜娜, 刘畅, 等. MSCT评估胃肠道间质瘤转移风险[J]. 中国医学影像技术, 2018, 34(12): 1830-1833. Feng QX, Sun NN, Liu C, et al. MSCT evaluation on metastastic risk of gastrointestinal stromal tumors[J]. Chin J Med Imaging Technol, 2018, 34(12): 1830-1833. DOI:10.13929/j.1003-3289.201803076 |
| [12] |
任阿红, 刘剑羽, 周延, 等. MSCT双期增强扫描对胃肠道间质瘤病变危险度的预测价值[J]. 中国医学影像学杂志, 2011, 19(3): 226-231. Ren AH, Liu JY, Zhou Y, et al. Predictive value of two-phase contrast enhanced MSCT in different risk of gastrointestinal stromal tumors[J]. Chin J Med Imaging, 2011, 19(3): 226-231. DOI:10.3969/j.issn.1005-5185.2011.03.017 |
| [13] |
陶咏. 128层螺旋CT三期增强扫描在胃间质瘤诊断中的应用价值研究[J]. 中国CT和MRI杂志, 2018, 16(10): 122-124, 136. Tao Y. Application value of spiral CT three phase enhanced scan in the diagnosis of gastric stromal tumors[J]. Chin J CT MRI, 2018, 16(10): 122-124, 136. DOI:10.3969/j.issn.1672-5131.2018.10.039 |
| [14] |
王明杰, 李旭丹, 陈淑艳, 等. 小肠间质瘤的MSCT诊断价值[J]. 中国辐射卫生, 2011, 20(4): 508-509. Wang MJ, Li XD, Chen SY, et al. MSCT diagnostic value of small intestinal stromal tumors[J]. Chin J Radiol Health, 2011, 20(4): 508-509. DOI:10.13491/j.cnki.issn.1004-714x.2011.04.069 |
| [15] |
魏生彩, 李万湖, 徐亮, 等. 原发性空回肠淋巴瘤及间质瘤CT表现与鉴别[J]. 中华肿瘤防治杂志, 2019, 26(8): 578-583. Wei SC, Li WH, Xu L, et al. CT findings and differentiation of primary jejunal or ileal stromal tumors and lymphoma[J]. Chin J Cancer Prev Treat, 2019, 26(8): 578-583. DOI:10.16073/j.cnki.cjcpt.2019.08.012 |
| [16] |
Hersh MR, Choi J, Garrett C, et al. Imaging gastrointestinal stromal tumors[J]. Cancer Control, 2005, 12(2): 111-115. DOI:10.1177/107327480501200206 |




