2. 歙县人民医院,安徽 黄山 245200;
3. 蚌埠医学院,安徽 蚌埠 233030
2. Shexian People's Hospital, Huangshan 245200 China;
3. Bengbu Medical College, Bengbu 233030 China
介入放射学(Interventional Radiology,IR)是在医学影像设备引导、定位、监控和记录下,经皮穿刺或通过人体固有孔道将特制的导管或器械插至病变部位,对各种疾病进行侵入性诊断或微创治疗操作的一系列技术的总称[1-4]。
介入手术中,介入医师以及其他工作人员通常靠近照射野,会受到来自病人的初级散射辐射,因此介入术中工作人员将受到高的辐射剂量。随着介入手术的快速发展,许多介入程序在放射科之外的临床科室推行,越来越多未经辐射防护与安全方面相关培训的临床医师成为“介入医师”[5]。这些介入医师中有很多人并不了解这些操作可能导致的辐射损伤,也不清楚减少其发生的防护措施。此次研究通过仿真人体模型实验以及蒙特卡洛模拟,对DSA术中辐射场空间分布进行了相关研究;此外针对不同术者位、使用不同铅当量防护用品后的剂量率进行了实验;旨在为介入工作人员如何进行防护提供依据。
此外介入放射学由于具有损伤小、效果显著的特性,近年来发展迅速。但针对患者的的辐射防护问题,关注甚少。由于介入手术需要在影像设备的引导下进行诊断治疗,且不同患者病情复杂程度不同,这将导致患者术中由于长时间的曝光接受较高的剂量,致使患者出现皮肤损伤或随机效应的风险增加[6-7]。本研究基于岛津PBU-60仿真体模对患者在某一介入程序中的入射及出射体表剂量进行实际测量,试图找出患者皮肤受照的最大剂量点。
1 材料与方法 1.1 介入设备荷兰飞利浦大平板血管造影系统(Digital Subtraction Angiography,DSA),型号为Philips AlluraXper FD20,具有自动曝光控制系统及自动亮度控制系统,管电压及管电流自动调节功能。设备可以记录包括透视时间、管电压(kV)、管电流(mA)、空气比释动能(AK)、空气比释动能面积乘积(KAP)、摄影次数、摄影帧数等数据。
1.2 仿真人体模型日本岛津医学影像仿真人体模型,型号为:KYOTO KAGAKU PBU-60全身模体,该仿真人体模型是X射线或CT用等身大体模,使用与人体具有同等X射线吸收率的软组织等效材料与骨骼等效材料,体型为:身高165 cm,体重50 kg。
1.3 蒙特卡洛软件MCNP(Monte Carlo N2 Particle Transport Code)是美国Los Alamos实验室应用理论物理部的Monte Carlo小组研制的用于计算复杂三维几何机构中的粒子输运的大型多功能蒙特卡洛程序[8-10]。它可用于计算中子、光子、中子-光子耦合以及光子-电子耦合的输运问题。
1.4 热释光剂量测量系统本次实验用探测器型号为GR-200A的热释光剂量计(LiF:Mg,Cu,P),尺寸:Ф = 4.5 mm,d = 0.8 mm,探测下限20 μGy,测量范围:10 μGy~10 Gy;退火炉:2005系列V型热释光精密退火炉;读出仪:Harshaw 3500。
1.5 X/γ剂量率仪AT1121型X、γ辐射剂量当量率仪,生产厂家:白俄ATOMTEX,由江苏省计量科学研究院进行了检定,并在检定有效期内,仪器检定证书编号:Y2020—0009438。0.025~10 MeV平衡帽,在此能量范围内可对DSA辐射场空间分布、不同站位不同防护用品后人员所受剂量率进行测量。
1.6 患者入射及出射体表剂量实验实验条件:PBU-60人体模型作为患者,每一剂量盒中均放置4片TLD,患者腹部TLD布点情况为入射体表10 × 4 × 5,出射体表3 × 4 × 5,见图1;DSA设备出束信息:主程序为Vascular + Abdomen,帧数为6 fps,透视79 kV + 2.1 mA,出束时间:5 min,SID = 90 cm,球管位于床下,影像接收器与床面距离30 cm。

|
图 1 患者入射及出射体表热释光剂量计布点图 Figure 1 Distribution of TLD on the body surface of patients |
依据AAPM TG-61、NCRP 168号报告及Perry B. Johnson等人的研究,估算患者皮肤吸收剂量[3, 11-12],进而推断患者皮肤损伤。
当有空气比释动能测量结果、刻度系数及半值层等信息时,应用式1)估算皮肤吸收剂量:
| $ {{{D}}_{{\rm{skin}}}} = Kerm{a_{air}} \times CF \times \frac{{{d_{refpo\operatorname{int} }}}}{{{d_{skin}}}} \times BF \times \left[ {{\mu _{en}}/\rho } \right]_{air}^{skin} \times {e^{ - \mu d}} $ | (1) |
式中:
Dskin—皮肤吸收剂量,单位为毫希沃特(mSv);
Kermaair—空气比释动能测量值,单位为毫戈瑞(mGy);
CF——转换因子;
d——距离;
BF——背散射系数;
本实验中,由于热释光剂量计贴紧模体皮肤表面进行测量,因此不考虑drefpoint/dskin、BF以及e−μd,则公式简化为:
| $ {{{D}}_{{\rm{skin}}}} = Kerm{a_{air}} \times CF \times \left[ {{\mu _{en}}/\rho } \right]_{air}^{skin} $ | (2) |
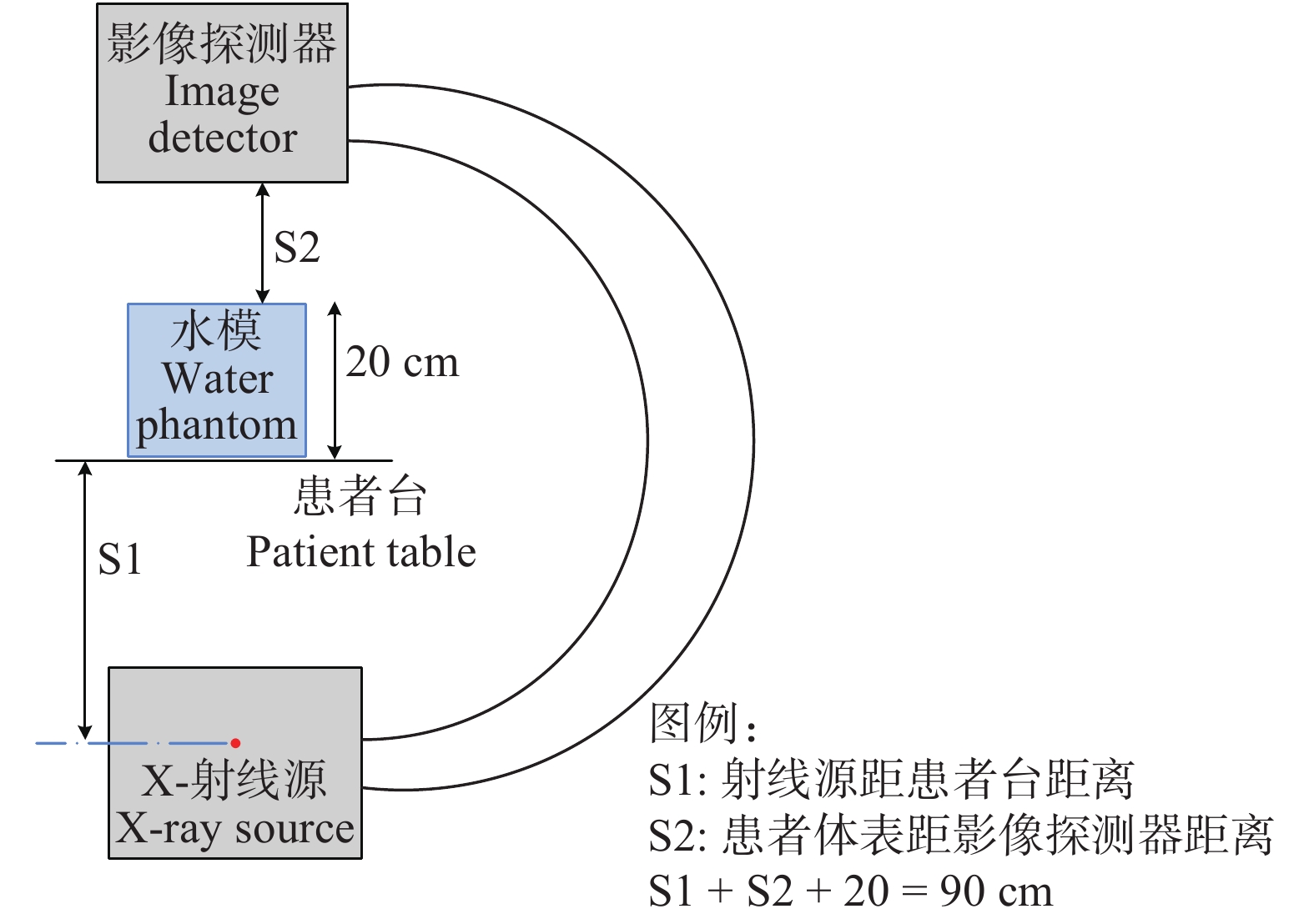
蒙卡模拟:利用蒙特卡洛软件MCNPX对DSA设备辐射空间分布情况进行模拟。源项为一点源,其能谱为管电压80 kV、3 mmAl滤过时的X射线能谱。几何条件:球管位于水模下方,照射方向为PA方向,水模尺寸为30 cm × 30 cm × 20 cm,水模置于治疗床上,球管距探测器距离为90 cm,床距探测器距离为30 cm。利用F6计数卡进行计数,计算粒子数为1×108。蒙卡模拟示意图见图2。
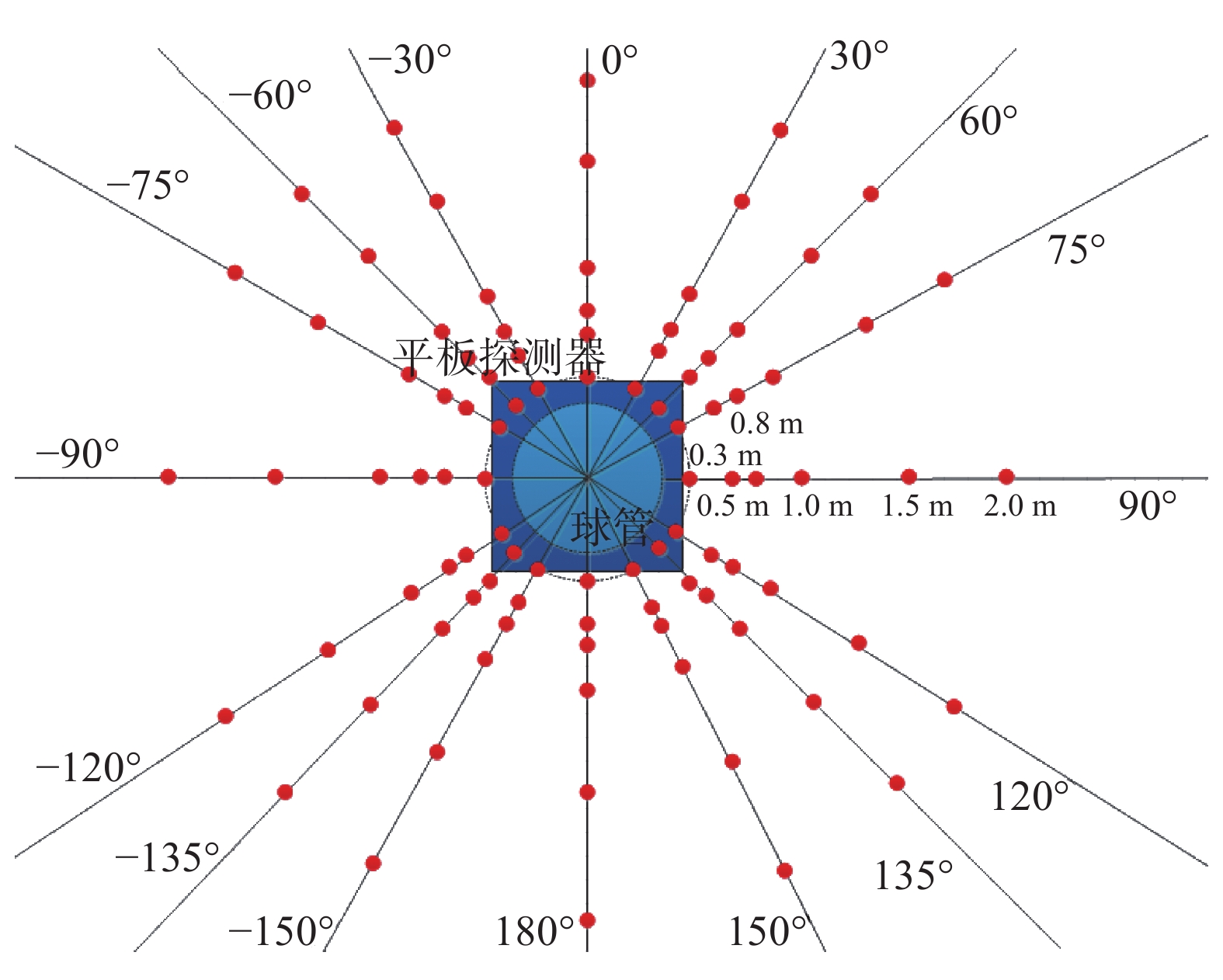
实验测量:使用X/γ剂量率仪对DSA设备开机状态下辐射空间分布情况进行实验测量,测量点位示意图见图3。设备出束条件:主程序Vascular + Abdomen,帧数6 fps,透视79 kV + 2.1 mA,SID = 90 cm,球管位于床下,影像接收器与床面距离30 cm。测量点位距离地面1 m,角度分布为:0°/30°/45°/60°/90°/120°/135°/150°/180°,测量半径为:30/50/80/100/150/200 cm。
|
图 2 DSA设备辐射场空间分布蒙卡模拟示意图 Figure 2 Schematic diagram of Monte Carlo simulation |
|
图 3 DSA辐射场空间分布蒙卡模拟以及实验布点示意图 Figure 3 Layout schematic diagram of Monte Carlo simulation and experiment |
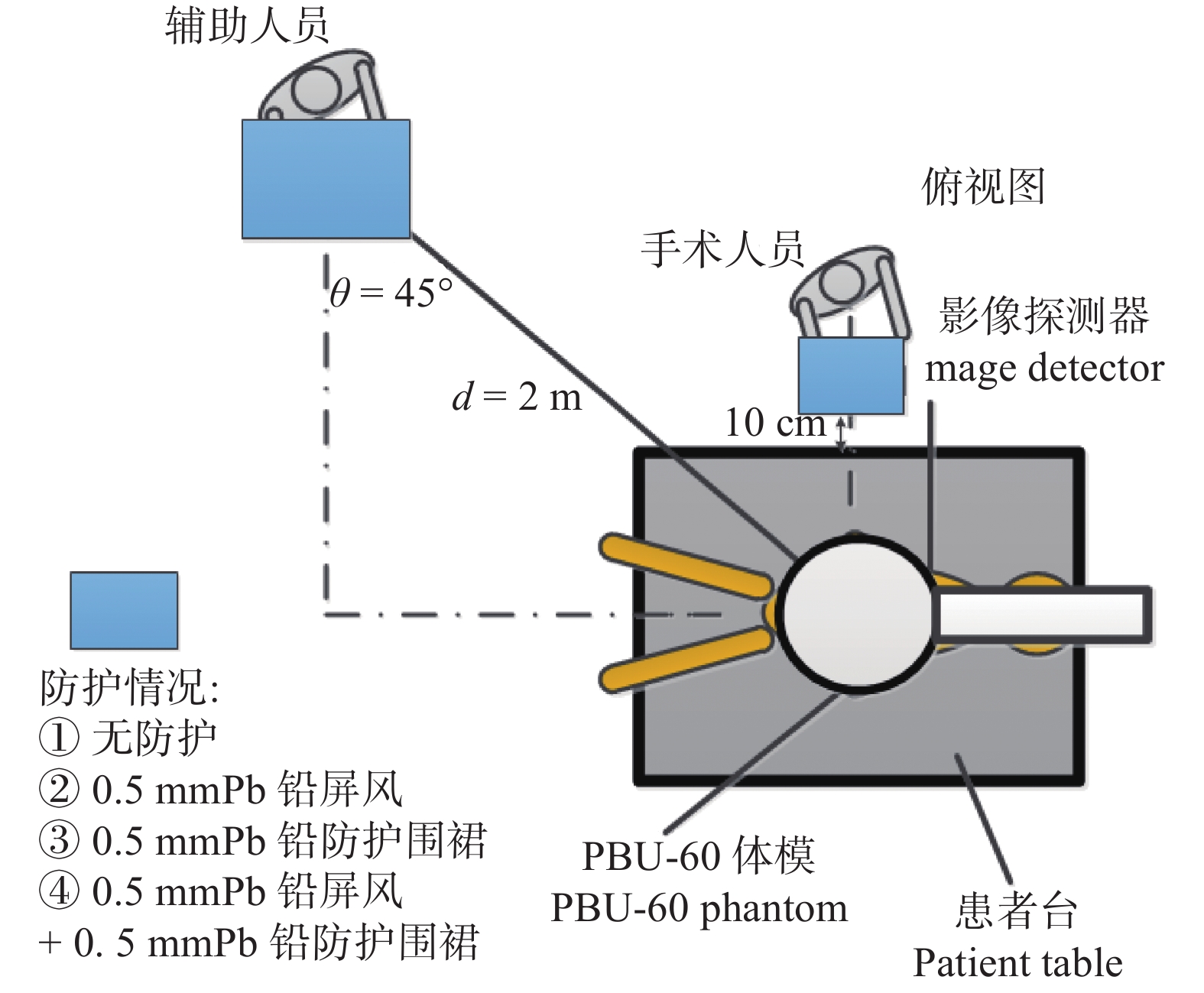
本次实验针对介入手术中手术医生以及其他辅助人员的辐射剂量学进行了相关研究。实验条件:主程序Vascular + Abdomen,帧数6 fps,透视79 kV + 2.1 mA,SID = 90 cm,球管位于床下,影像接收器与床面距离30 cm;测量点位:距离地面1 m,距床边10 cm及2 m处,防护情况:无防护,0.5 mmPb铅屏风,0.5 mmPb铅衣,0.5 mmPb铅屏风 + 0.5 mmPb铅衣。实验示意图见图4。
|
图 4 介入工作人员辐射剂量学研究示意图 Figure 4 Schematic diagram of radiation dosimetry study for intervention workers |
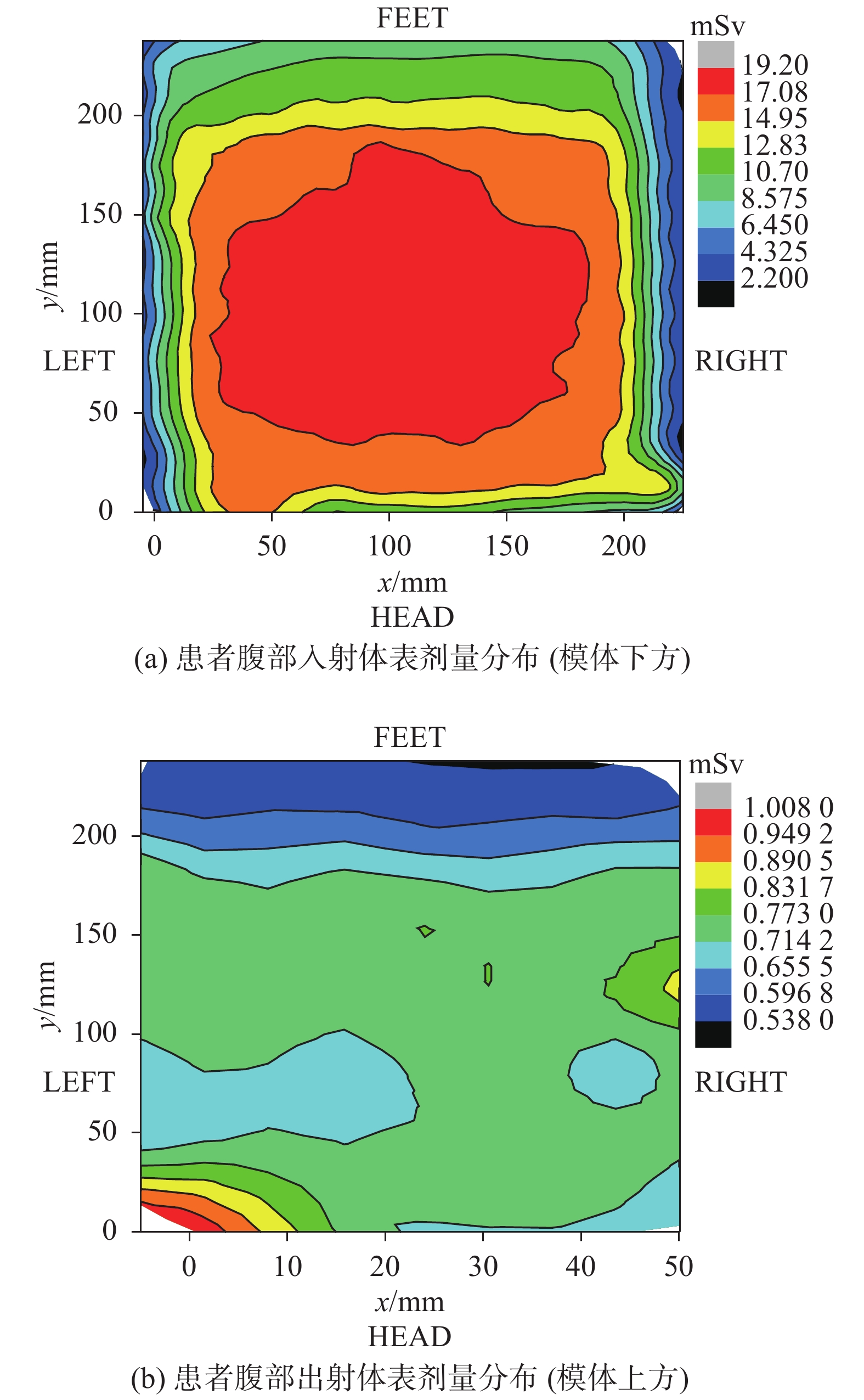
测量患者入射体表剂量的剂量盒布于人体模型腹部下方,出射剂量盒置于腹部上方,入射及出射剂量盒面积中心均与摄野中心对齐。患者腹部入射及出射体表剂量结果见图5。从图5可以看出腹部入射体表剂量呈同心方形分布,剂量分布情况大致为:以射野中心的7.5 cm半径范围内,剂量最大:17.08~19.2 mSv;随面积范围的扩大,剂量呈现对称性递减趋势;左-右方向趋势:在7.5~9.0 cm范围内,剂量降至14.95~17.08 mSv;更大面积范围则呈现出剂量以2 mSv/cm的速率减少;头-足方向则未呈现出对称的递减规律。腹部出射体表剂量计布点同样是以射野中心为中心分布,但并未呈现出较强的规律性,原因则可能为布点较少,另由于模体不同器官、不同组织的密度不同,导致对射线的组织吸收系数不同。由图5可以看出靠近胸腹部左上角处剂量最大,约为1.008 mSv,究其原因为靠近肺部,空腔较多,其余部位则主要为肌肉、骨头,因此靠近肺部的剂量吸收较其余部位少。
|
图 5 患者腹部入射及出射体表剂量分布图 Figure 5 Skin dose distribution results of abdominal incident(a)and outgoing(b) |
依据材料与方法中公式2)计算患者皮肤吸收剂量,依据Perry B. Johnson等[12]的研究,
DSA辐射场空间分布蒙卡模拟、实测结果与文献报道结果见图6。实测结果表明:PA方向照射时,DSA辐射场空间分布呈现出类似蝴蝶状分布,在治疗床两侧1 m、治疗床头方向50 cm范围内剂量率最高,在此范围外则呈现出每50 cm剂量率减半的递减趋势。实测结果与IEC 60601-2-43:2010 + A1:2017 + A2:2019文献[13]中报道的分布趋势基本相符。蒙卡模拟结果则与实测结果略有不同,呈现出类似菱形分布,在50 cm范围内剂量率最高,此范围外的规律则与实测结果基本相符。究其原因则可能为蒙卡模拟中使用了规则匀质的水模替代了人体模型,另在实际测量中设备本身的部件将造成额外的散射,导致两者结果略有不同,但趋势并无太大差异。因此使用蒙卡模拟的方法可以大致了解DSA辐射场空间分布情况。

|
图 6 DSA辐射场空间分布蒙卡模拟、实验测量及文献报道结果 Figure 6 Monte Carlo simulation,experimental measurement and literature results of the spatial distribution of DSA radiation field |
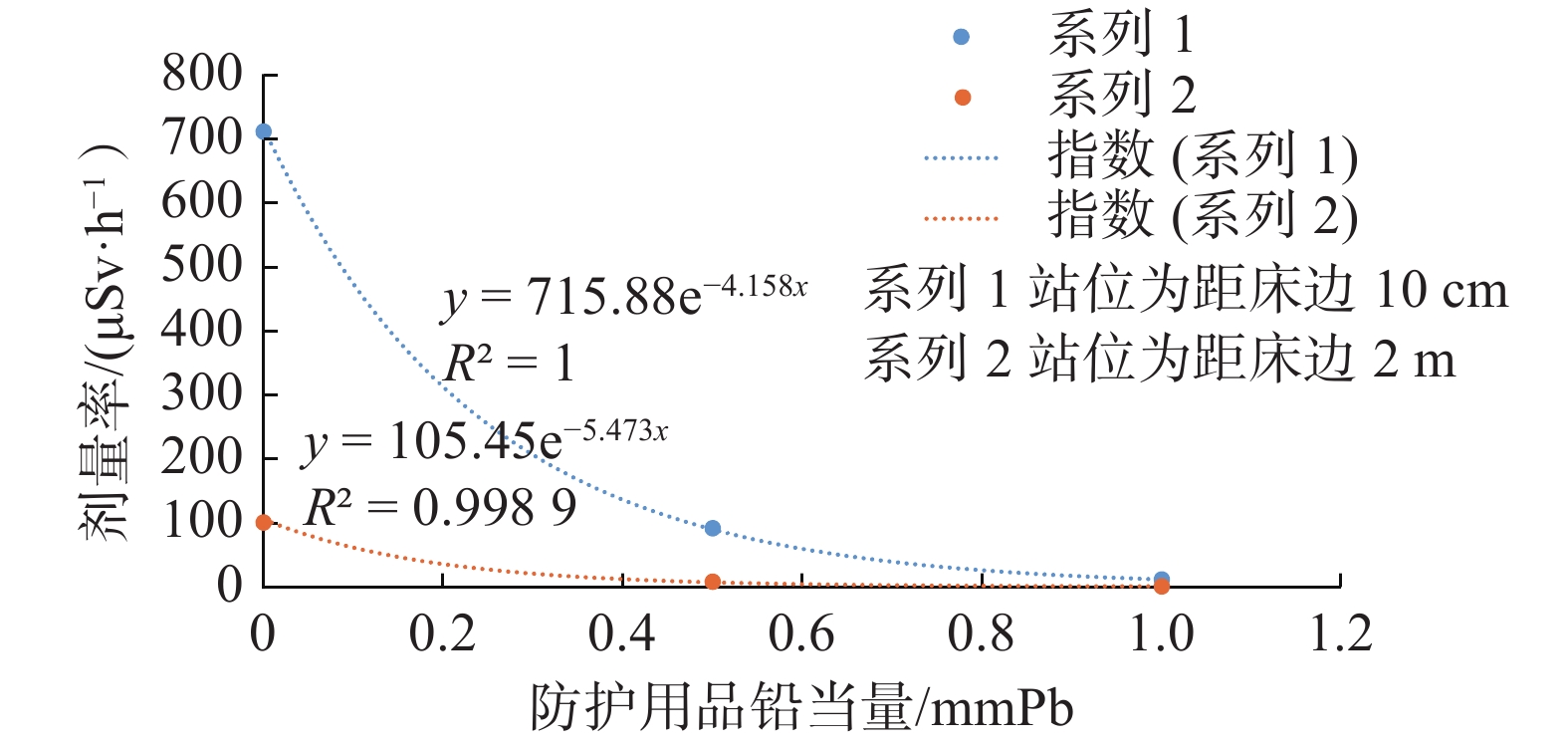
介入工作人员辐射剂量实验结果见表1。结果表明:手术医生位于第一术者位(距床边10 cm处),在完全无防护情况下,剂量率达710 μSv/h;辅助医生距床边2 m在无防护情况下,剂量率达100 μSv/h。手术医生与辅助医生在不同站位处其所受照射的剂量率随着防护用品铅当量的增加,剂量率近似呈现出指数衰减规律,见图7。2 m处站位的医生在铅屏风后并穿戴0.5 mmPb铅围裙,所受剂量率可降至0.42 μSv/h。
|
|
表 1 介入工作人员辐射剂量实验结果 Table 1 Experimental results of radiation dose of intervention workers |
|
图 7 不同站位医生不同防护用品防护效果 Figure 7 Protective effect of different protective conditions for doctors at different stations |
研究患者皮肤剂量的方法主要有直接测量法与间接估算法[1,14],直接测量法则有热释光剂量计测量法、慢感光胶片法以及电离室法,间接法则是由荧光透视时间、DAP以及蒙卡模拟法间接估算皮肤剂量。皮肤剂量峰值指的是在一台手术中授予患者皮肤某点的最高剂量,被作为评价确定性效应发生可能性的最佳指标。本文研究患者皮肤剂量所用的TLD法是目前国内使用较多皮肤峰值剂量估算法,但有一定误差[15]。
ICRP第85号报告[1]指出,若单次或短期内多次进行介入操作过程,当皮肤剂量达到2 Gy时,会引起皮肤红斑效应,当达到7 Gy则会引起永久性脱发,达到12 Gy时则会导致迟发性皮肤坏死。本研究表明,在某一腹部介入程序PA照射情况下,每5 min介入透视操作将会给患者最大带来18.62 mGy的皮肤受照剂量。介入手术则会因患者不同、手术部位不同以及病变程度不同导致手术复杂程度不同,每台手术透视时间将相差很大,因此患者所致受照剂量变化范围较大。当手术复杂程度高,透视时间过长的情况下,则有可能导致皮肤累积剂量达到2 Gy,此时患者则会出现红斑等症状。放射性皮肤损伤通常会在术后数周或数月才会出现症状[16],这种症状出现后往往不能及时被确诊为放射损伤,导致患者并不能得到充分治疗。因此,开展介入手术中患者皮肤剂量测量,对高剂量患者进行术后随访是非常必要的。
本研究针对某一腹部介入程序PA照射情况下,DSA设备机房内辐射场空间分布采用蒙卡及AT1121进行了模拟与实验测量。结果表明DSA设备的辐射场分布并非均匀分布,呈现出类似蝴蝶状分布,在治疗床两侧1 m、治疗床头方向50 cm范围内剂量率最高;离X射线球管中心越远,剂量率下降越多;2 m外剂量基本可以忽略。此外,剂量率分布不仅与距离有关,与角度亦呈现出一定的关系,在 ± 30°、± 60°、± 90°、± 135°附近剂量率较高。辐射场剂量率的分布可为介入手术人员的辐射防护提供一定依据,在条件允许的情况下,应尽量避开剂量率偏高的站位。−90°为术者位、−135°为助手位,但由于手术需要,必须加强术者位和助手位的辐射防护。
通过对不同站位医生使用不同铅当量防护用品防护效果的实验测量,表明医生应尽可能地在铅悬挂屏及吊帘后操作,其次,在进行介入手术时,介入工作人员必须穿戴较为齐备的防护用品,包括:铅防护围裙、铅围脖、铅眼镜等。在床边铅防护用品和个人防护用品的双重保护下,可显著降低介入人员的受照剂量。
| [1] |
Valentin J. Abstract: Avoidance of radiation injuries from medical interventional procedures, ICRP Publication 85[J]. Ann ICRP, 2000, 30(2): 7. DOI:10.1016/s0146-6453(01)00004-5 |
| [2] |
Cousins C, Miller DL, Bernardi MM et al. Radiological protection in cardiology[J]. ICRP, 2013, 42(1): 1-125. DOI:10.1016/j.icrp.2012.09.001 |
| [3] |
Mahesh M. Radiation dose management for fluoroscopically guided interventional medical procedures[J]. Med Phys, 2012, 39(9): 5789-5790. DOI:10.1118/1.4747450 |
| [4] |
Johnsto. Radiation protection and safety in medical uses of ionizing radiation[J]. Radiother Oncol, 2020, 152(1): S2. DOI:10.1016/S0167-8140(21)00035-9 |
| [5] |
Lopez PO, Dauer LT, Loose R, et al. Occupational Radiological Protection in Interventional Procedures[J]. ICRP, 2018, 47(2): 1-11. DOI:10.1177/0146645317750356 |
| [6] |
Mohammadi M, Danaee L, Alizadeh E. Reduction of radiation risk to interventional cardiologists and patients during angiography and coronary angioplasty[J]. J Tehran Heart Cent, 2017, 12(3): 101-106. |
| [7] |
Pantos I, Patatoukas G, Katritsis DG, et al. Patient radiation doses in interventional cardiology procedures[J]. Curr Cardiol Rev, 2009, 5(1): 1-11. DOI:10.2174/157340309787048059 |
| [8] |
王涛, 牛菲, 杨淑慧, 等. 通过剂量面积乘积估算内镜逆行胰胆管造影患者的有效剂量[J]. 中国辐射卫生, 2019, 28(4): 417-419. Wang T, Niu F, Yang SH, et al. Estimation of effective dose to patients undergoing endoscopic retrograde cholangiopancreatographyle (ERCP) from DAP measuring[J]. Chin J Radiol Health, 2019, 28(4): 417-419. DOI:10.13491/j.issn.1004-714x.2019.04.019 |
| [9] |
李聪, 刘威武. 介入手术医生受照剂量研究进展[J]. 中国辐射卫生, 2020, 29(6): 700-703, 707. Li C, Liu WW. Research progress of radiation dose for interventional surgeons[J]. Chin J Radiol Health, 2020, 29(6): 700-703, 707. DOI:10.13491/j.issn.1004-714X.2020.06.031 |
| [10] |
Bhar M, Mora S, Kadri O, et al. Monte Carlo study of patient and medical staff radiation exposures during interventional cardiology[J]. Phys Med, 2021, 82: 200-210. DOI:10.1016/j.ejmp.2021.01.065 |
| [11] |
Ma CM, Coffey CW, DeWerd LA, et al. AAPM protocol for 40-300 kV X-ray beam dosimetry in radiotherapy and radiobiology[J]. Med Phys, 2001, 28(6): 868-893. DOI:10.1118/1.1374247 |
| [12] |
Johnson PB, Borrego D, Balter S, et al. Skin dose mapping for fluoroscopically guided interventions[J]. Med Phys, 2011, 38(10): 5490-5499. DOI:10.1118/1.3633935 |
| [13] |
AENOR. Medical electrical equipment-Part 2-43: Particular requirements for the basic safety and essential performance of X-ray equipment for interventional procedures[R]. Spain: AENOR, 2018.
|
| [14] |
徐辉, 薛娴, 赵红枫, 等. 用胶片法对心脏介入程序中患者峰值皮肤剂量测量研究[J]. 中华放射医学与防护杂志, 2014, 34(4): 302-305. Xu H, Xue X, Zhao HF, et al. Peak skin dose measurements in two cardiac interventional procedures using radiochromic film[J]. Chin J Radiol Med Prot, 2014, 34(4): 302-305. DOI:10.3760/cma.j.issn.0254-5098.2014.04.017 |
| [15] |
白玫, 刘彬, 郑钧正. 心脏介入患者受照剂量研究[J]. 介入放射学杂志, 2007, 16(4): 222-225. Bai M, Liu B, Zheng JZ. Survey on patient dose in cardiac intervention[J]. J Interv Radiol, 2007, 16(4): 222-225. DOI:10.3969/j.issn.1008-794X.2007.04.003 |
| [16] |
Fujisawa H, Kushihashi T, Tanisaka M, et al. Skin injuries caused by fluoroscopically guided interventional procedures[J]. European Congress of Radiology, 2014. |



