2. 徐州医科大学徐州临床学院 放疗科,江苏 徐州 221000
2. Department of Radiotherapy, Xuzhou Medical College of Xuzhou Medical University, Xuzhou 221000 China
全球肺癌居新发病例及癌症死因第一位 ,尤其是局部晚期及晚期病人,5年生存率及生存质量极低。非小细胞肺癌占整个肺恶性肿瘤的75%~80%[1],调强放疗(Intensity Modulated Radiation Therapy,IMRT)因靶区具有良好的适形性和均匀度,能提高放射生物学效应,广泛应用于多种癌种的治疗[2-3]。目前其计划的实施常用基于剂量体积(Dose Volume,DV)函数优化方法,由于其优化参数与剂量体积直方图(Dose volume Histogram,DVH)曲线的感兴趣点不是一一对应,因而对靶区整体剂量分布调控较差;而剂量冷点落在靶区范围内可能是导致肿瘤复发的关键。1997年Niemierko等[4]提出等效均匀剂量概念(Equivalent Uniform Dose,EUD),其反映的是组织结构的功能,可表示肿瘤与剂量之间的非线性反应,并在1999年将公式推广到正常组织,即广义等效均匀剂量(Generalized Equivalent Uniform Dose,GEUD)。目前对基于等效均匀剂量优化方法的研究主要集中于颅脑肿瘤及腹部肿瘤[5-9],且研究重点主要针对危及器官(Organ At Risk,OAR),而对于胸部肿瘤,尤其是局部晚期肺癌的研究较少。本研究拟比较基于等效均匀剂量的生物函数优化及基于剂量体积的物理函数优化在Ⅲ期非小细胞肺癌调强放疗的剂量学差异。
1 材料与方法 1.1 研究对象随机抽取2018—2020年已行放疗的15例Ⅲ期非小细胞肺癌患者的定位CT图像及靶区勾画信息,根据第八版美国癌症联合会分期(American Joint Committee on Cancer,AJCC)所有患者均为ⅢA期~ⅢB期。其中ⅢA期4例,ⅢB期11例,年龄49~94岁,年龄中位数61岁。本次研究采用的是美国瓦里安公司生产的Eclipse13.5计划系统,使用设备电子直线加速器为Varian 23EX(VARIAN公司,美国)。涉及所有病例的靶区勾画及计划设计均由同一放疗医师及物理师制定,所有患者均完成了全程放疗。对这15例患者临床资料进行回顾性分析,每例患者重新设计4组放疗计划,按照靶区及危及器官分为:①DV + DV组(靶区、危及器官均采用物理函数优化;标记为A组);②DV-EUD + DV组(靶区采用物理函数优化并加入生物函数约束条件、危及器官采用物理函数优化;标记为B组);③EUD + EUD组(靶区、危及器官均采用生物函数优化;标记为C组);④EUD-DV + EUD组(靶区采用生物函数优化并加入物理函数约束条件、危及器官采用生物函数优化;标记为D组)。
1.2 入组及排除标准入组标准:病理诊断为非小细胞肺癌;依据第八版AJCC指南分期为ⅢA-ⅢB期;根据患者病情,需要行放射治疗;拒绝手术或不能手术。排除标准:因患者自身原因无法完成全程放疗;患者有严重合并症或难以控制的感染而不能接受放疗治疗。
1.3 计划设计 1.3.1 放疗靶区设计所有计划的靶区及危及器官按相同优化权重进行计划设计。考虑到Senth-ilkumarK等[6]及Chaikh A等[10]提出的计划系统参数可能对计划结果造成影响,本次所有计划均在Eclipse 13.5计划系统进行放疗方案的重新设计,该系统同时配备物理函数及生物函数,并且能够在任一种函数基础上加入另外一种约束条件。根据RTOG0617研究,15例患者60组放疗计划的处方剂量均为60 Gy/30F,每组计划要求靶区100%处方剂量包绕至少95%的计划靶区体积,所有患者均采取调强放疗。根据ICRU50及ICRU60号报告,肿瘤靶区(Gross Tumor Volume,GTV)为原发肿瘤(GTVp)及转移淋巴结(GTVnd)。临床靶区(Clinical Target Volume,CTV)在GTVp基础上前后、左右方向各外放6~8 mm,上下方向各外放3 cm,CTVnd在GTVnd基础上各方向外放6~8 mm(CTV勾画时不宜超过椎体、大血管等解剖屏障)。计划靶区(Planning Target Volume,PTV)在CTV基础上各方向均外放5 mm。双肺V20 ≤ 25%,肺平均剂量 ≤ 15 Gy;心脏平均剂量 ≤ 26 Gy,V30 ≤ 40%,V40 ≤ 30%;脊髓最大受照剂量(Dmax)≤ 45 Gy。
1.3.2 生物函数a值的选择理论上a取值范围为(−∞,﹢∞)。通常对于肿瘤组织而言,a取较大的负值,对于正常组织,a取正值。a > 1时,适用于“串联器官”(如心脏、脊髓等);a = 1时,适用于“并联”器官(如肺组织等)。需要注意的是不同组织对于a的取值不是通过公式直接推导获取,而是通过大量的实验数据整理获得,且不同设备的a取值也不全相等,另外即使是同一公司生产的设备,亦会因版本的不同给出不同的参考a值,综上,应根据实际临床工作需要选取不同的a值。本次研究采用的是美国瓦里安公司生产的Eclipse 13.5计划系统,根据使用手册,对于肿瘤靶区,a取较大的负值,参考范围为(−20,0);对于肺组织,a取值为1;对于心脏,a取值为3;对于脊髓,a取值为13。本次研究进行计划设计时,基本上参考使用Eclipse 13.5计划系统手册。
1.4 结果计算靶区方面(PTV)分别计算4组计划的2%体积的剂量(D2%),98%体积的剂量(D98%),中值剂量(D50%),最大剂量(Dmax),超过处方剂量105%的体积(D105%),均匀性指数(Homogeneity Index,HI)和适形性指数(Conformity Index,CI)。其中,对于HI,越接近“0”表明其均匀性越好,对于CI,越接近“1”表明其适形性越好。危及器官方面:肺平均剂量(Mean Lung Dose,MLD)、V5、V10、V20、V30,心脏V30,V40,Dmean,脊髓1%体积的剂量,并计算机器跳数(Monitor Unit,MU),其中MU数值越大表明计划相对越复杂,执行时间越长。HI计算公式:
采用SPSS 26.0软件进行单因素方差分析,并为直观展现数据结果,将部分数据结果绘制成柱状图,检验水准α = 0 .05。
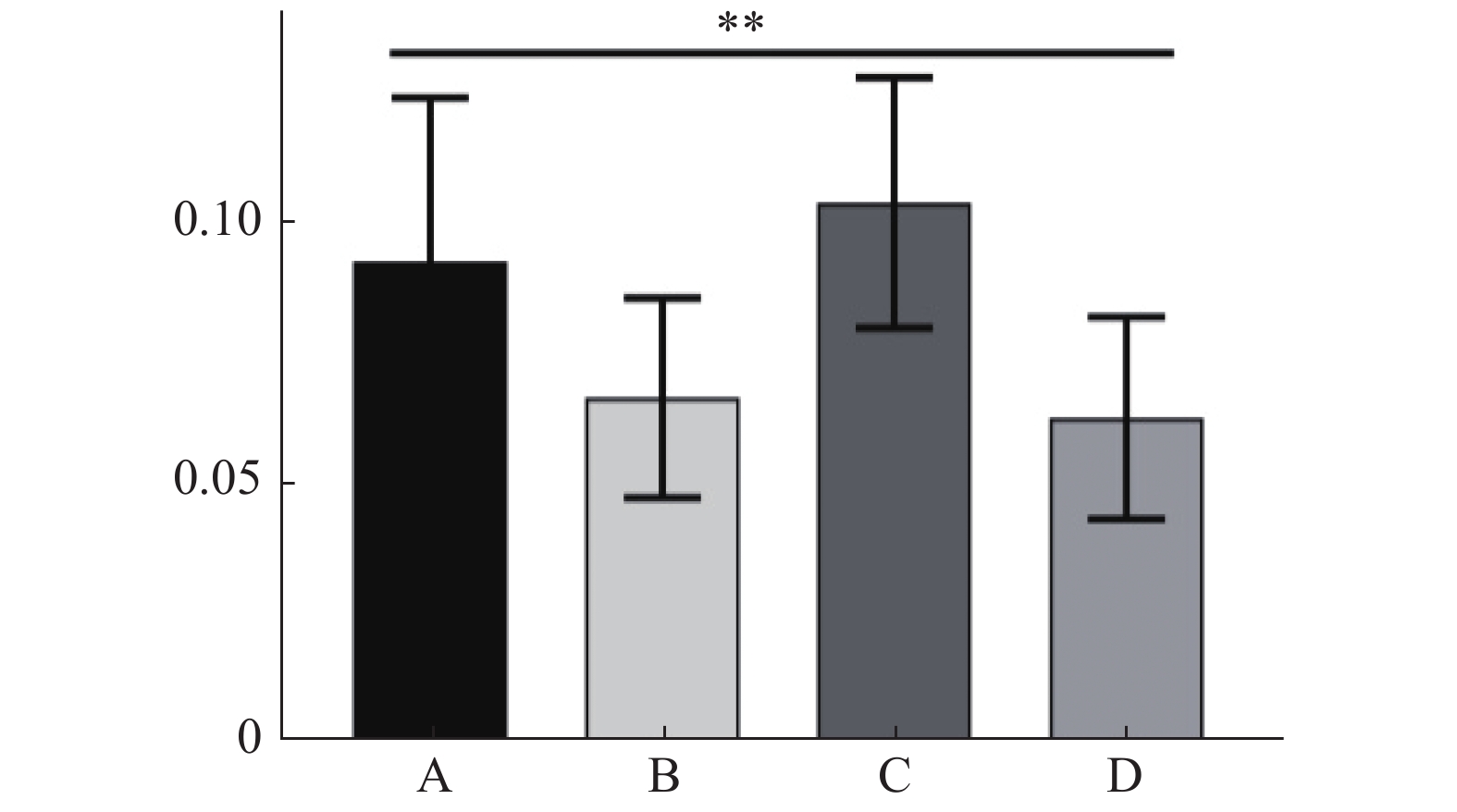
2 结 果 2.1 靶区方面如表1所示为PTV统计结果,B组与D组的D2%、D98%、D50%、V105%及Dmax相对最小,差异有统计学意义(P < 0.05),在满足治疗计划需求同时,能降低高剂量区体积比,为降低周围正常组织受量提供可能;C组在提高最低剂量及平均剂量的同时,使整体剂量大幅提高,尤其是最大剂量显著提升,使DVH曲线右移,出现难以调和的高剂量区域,无法满足实际临床治疗需要。均匀性指数( HI)统计结果如图1,B组及D组优于其他2组(P < 0.05),而B组与D组组间结果相近,差异无统计学意义( P > 0.05);适形性指数( CI)方面统计结果如图2,结果显示4组计划相近,差异无统计学意义(P > 0.05)。
|
|
表 1 15例III期非小细胞肺癌患者PTV剂量参数的4组计划比较(
|
|
图 1 15例Ⅲ期非小细胞肺癌患者均匀性指数(HI)的4组计划比较(
|

|
图 2 15例Ⅲ期非小细胞肺癌患者适形性指数(CI)的4组计划比较(
|
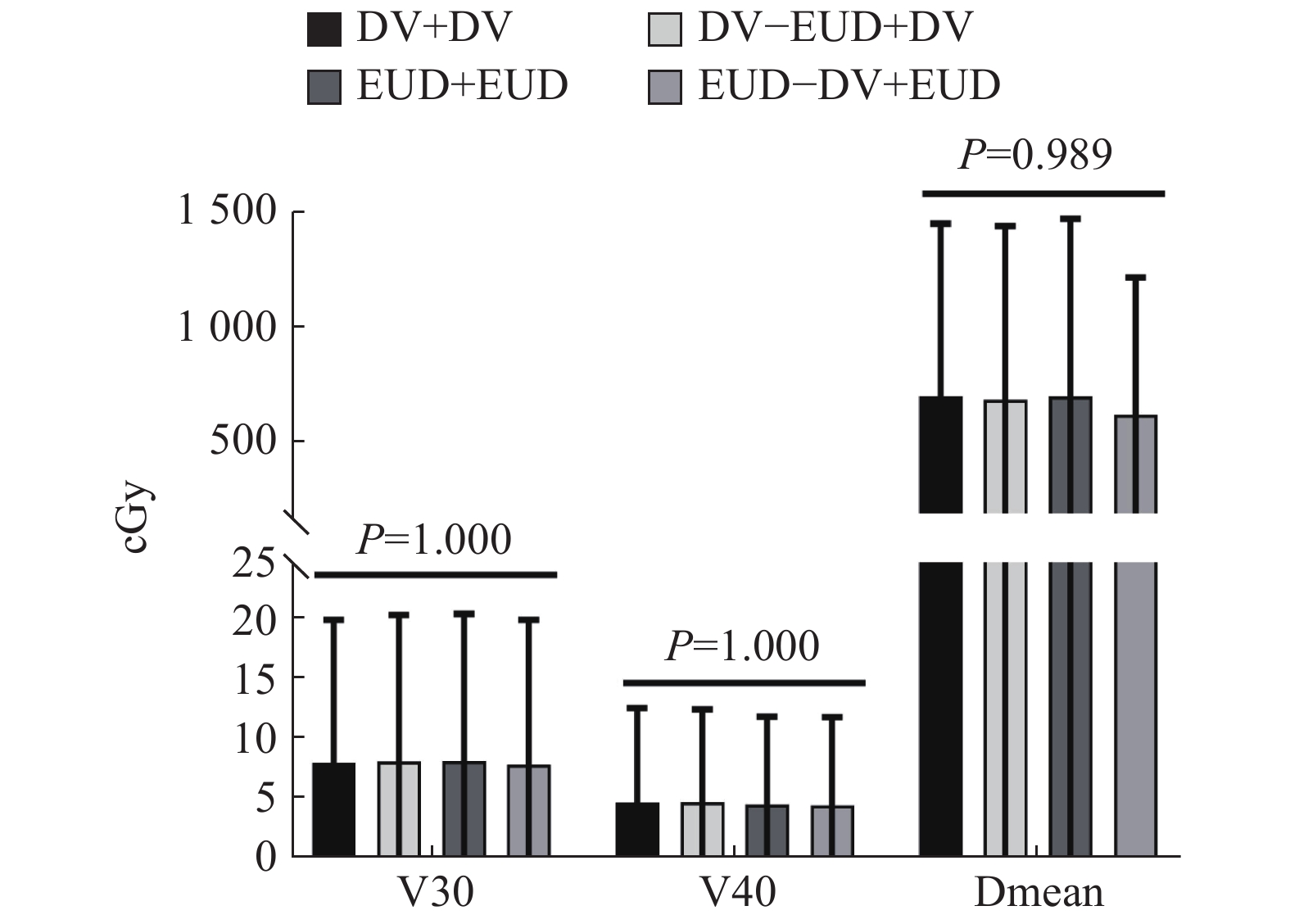
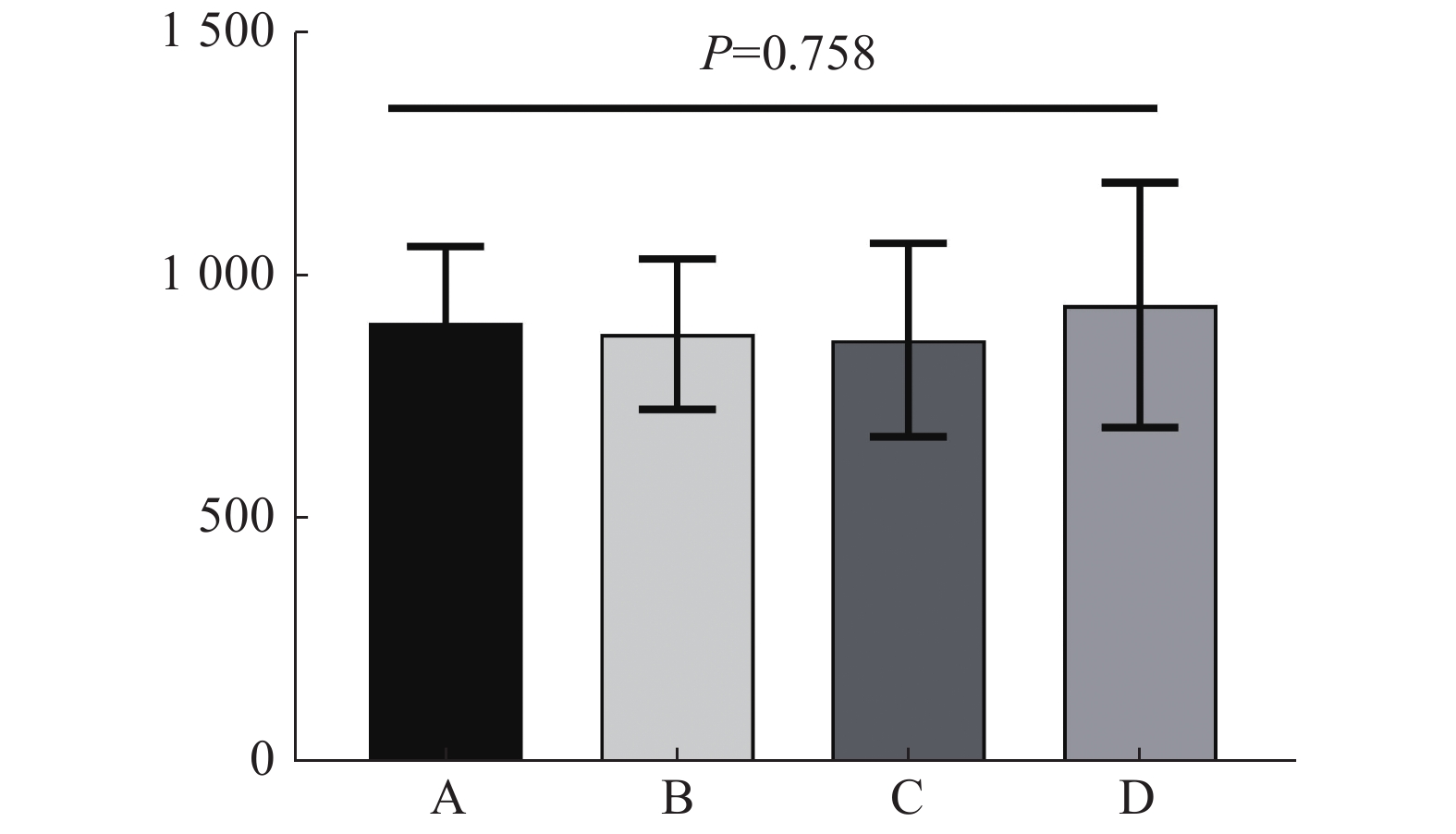
如图3肺组织受量结果,4组计划相近,差异无统计学意义(P > 0.05),但A组的正常肺组织受量略低于其他3组;如 图4为心脏受照剂量的统计结果,4组计划结果相近,差异无统计学意义(P > 0.05);如 图5为脊髓受量的统计结果,其中C组及D组明显优于其他2组,大幅降低脊髓受量,差异有统计学意义(P < 0.05);机器跳数方面(MU),4组相近,差异无统计学意义( P > 0.05),如 图6。

|
图 3 15例Ⅲ期非小细胞肺癌患者肺组织剂量参数的4组计划比较(
|
|
图 4 15例Ⅲ期非小细胞肺癌患者心脏剂量参数的4组计划比较(
|

|
图 5 15例Ⅲ期(ⅢA期、ⅢB期)非小细胞肺癌患者脊髓D1% 4组计划比较(
|
|
图 6 15例Ⅲ期(ⅢA期、ⅢB期)非小细胞肺癌患者MU 4组计划比较(
|
目前临床上对于肺癌放疗计划的制定多采用基于剂量体积优化的调强放疗,即通过给定的剂量体积约束条件制定治疗所需的放疗计划,此法因推广较早,制定的放疗计划基本能满足治疗需要,且易于临床医师的理解与使用,因此获得广泛应用并沿用至今,但其也存在一些问题:①剂量体积约束条件仅对应于剂量体积直方图上的某几点,但是靶区的剂量分布应视为一个整体,因此剂量体积优化函数必定无法整体调控剂量分布。②DV函数优化,假定解剖结构对于射线的反应为近似一元方程,即物理函数形式,但组织结构接受剂量并不均匀,即组织结构对于射线为非线性反应。③基于剂量体积优化的物理函数允许剂量冷点的存在,而剂量冷点落在靶区范围内可能是导致肿瘤复发的关键。④剂量体积约束条件多,迭代计算量大,计算机需要很长的时间进行优化,而且计算机会出现无解的情况,或者虽有解但无最优解的情况,当这种情况出现时,就需要计划的重新设计,耗费大量的时间与精力。在对基于剂量体积优化模式必然存在剂量分布不均的情况进行总结与分析后,Niemierko A等[4]于1997年提出等效均匀剂量的概念,其从放射生物学角度出发,反映肿瘤组织对于射线的非线性反应,相较于剂量体积的物理函数更符合实际情况。已有研究显示,EUD对于头颈部及腹部肿瘤在提高靶区均匀性及保护重要组织方面获得了阳性结果,尤其是对于腮腺、海马及膀胱等的保护尤为明显[11-16],其广义公式为:
| $EUD = {\Bigg(1/N\sum {D_i^a} \Bigg)^{1/a}}$ |
其中,N为感兴趣区(Volume Of Interest,VOI)的微元个数,Di是第i个体素的吸收剂量,a是解剖结构(包括肿瘤和正常组织)的特性参数。理论上a可以取任意值,通常对于肿瘤组织,a取较大的负值;a > 1时适用于“串联器官”(如心脏、脊髓等);a = 1时,适用于“并联”器官(如肺组织等)[17-20]。
本次研究入组的15例患者,每例患者均制定了4组计划,通过对4组计划不同剂量学指标进行统计分析,发现EUD − DV + EUD组及DV − EUD + DV组能获得较好的靶区均匀性,而有相关研究显示更好的靶区均匀性意味着更好的剂量分布及更好的治疗计划,从剂量学角度意味着更好的治疗方案[21]。另外需要注意的是,靶区单纯应用EUD优化后会使整个DVH图右移,使整体剂量提高,而肿瘤剂量热点落在靶区与正常组织重叠区域时,会对正常组织造成影响,因此在实际工作中,对于局部晚期非小细胞肺癌行放疗时,靶区可采用EUD及DV优化2者相结合的优化方式,以获得更优的肿瘤控制率。
基于EUD的生物函数也存在其局限性:①EUD的数学模型假设肿瘤组织由克隆癌细胞组成,且组织接受射线的杀伤基于泊松分布,但实际的实体肿瘤由于肿瘤异质性并不按照公式假设形式存在;②目前临床上对于a值的获取并非来自公式的推导及演算,而是来源于临床试验的结果[20]。最后,尽管基于等效均匀剂量的生物函数存在一定的不足,但据目前可获得的研究数据来看,较基于DV的物理函数仍有一定的优势,随着生物模型及数理基础的不断完善,以及放射生物学及放射物理学的不断发展,期待生物函数会获得越来越多的关注。
依上所述,对于局部晚期非小细胞肺癌在进行放疗计划制定时,从理论上靶区可采用生物函数与物理函数相结合的优化模式,以提高靶区的均匀性。生物函数的加入可以有效降低脊髓受照剂量,减少脊髓的放射性损伤。
| [1] |
陈波, 李晔雄. 肿瘤放射治疗学(五版)[M]. 北京: 中国协和医科大学出版社, 2018. Chen B, Li QX. Radiation oncology(5th ed)[M]. Beijing: China Union Medical College Press, 2018. |
| [2] |
张惠玲, 李鑫, 吴小良, 等. 分段弧和全弧旋转容积调强放疗治疗胸中段食管癌的剂量学比较[J]. 中国辐射卫生, 2020, 29(1): 81-84. Zhang HL, Li X, Wu XL, et al. Dosimetry comparison of partial-arc and full-arc volumetric modulated arc therapy for middle esophageal cancer[J]. Chin J Radiol Health, 2020, 29(1): 81-84. DOI:10.13491/j.issn.1004-714X.2020.01.019 |
| [3] |
刘茹佳, 陈颖, 钟志鹏, 等. 两种算法在非小细胞肺癌调强放疗中的剂量学比较[J]. 中国辐射卫生, 2019, 28(6): 705-708. Liu RJ, Chen Y, Zhong ZP, et al. Dosimetric comparison of two algorithms in intensity-modulated radiation therapy for NSCLC[J]. Chin J Radiol Health, 2019, 28(6): 705-708. DOI:10.13491/j.issn.1004-714x.2019.06.029 |
| [4] |
Niemierko A. Reporting and analyzing dose distributions: a concept of equivalent uniform dose[J]. Med Phys, 1997, 24(1): 103-110. DOI:10.1118/1.598063 |
| [5] |
De Marzi L, Feuvret L, Boulé T, et al. Use of gEUD for predicting ear and pituitary gland damage following proton and photon radiation therapy[J]. Br J Radiol, 2015, 88(1048): 20140413. DOI:10.1259/bjr.20140413 |
| [6] |
Senthilkumar K, Maria Das KJ, Balasubramanian K, et al. Estimation of the effects of normal tissue sparing using equivalent uniform dose-based optimization[J]. J Med Phys, 2016, 41(2): 123-128. DOI:10.4103/0971-6203.181631 |
| [7] |
Zhu J, Simon A, Haigron P, et al. The benefit of using bladder sub-volume equivalent uniform dose constraints in prostate intensity-modulated radiotherapy planning[J]. Onco Targets Ther, 2016, 9: 7537-7544. DOI:10.2147/OTT.S116508 |
| [8] |
Zhang HL, Cao YJ, Antone J, et al. A model-based method for assessment of salivary gland and planning target volume dosimetry in volumetric-modulated arc therapy planning on head-and-neck cancer[J]. J Med Phys, 2019, 44(3): 201-206. DOI:10.4103/jmp.JMP_19_19 |
| [9] |
Bodensohn R, Söhn M, Ganswindt U, et al. Hippocampal EUD in primarily irradiated glioblastoma patients[J]. Radiat Oncol, 2014, 9: 276. DOI:10.1186/s13014-014-0276-5 |
| [10] |
Senthilkumar K, Maria Das KJ. Comparison of biological-based and dose volume-based intensity-modulated radiotherapy plans generated using the same treatment planning system[J]. J Cancer Res Ther, 2019, 15(Supplement): S33-S38. DOI:10.4103/jcrt.JCRT_956_16 |
| [11] |
Chaikh A, Balosso J. The use of TCP based EUD to rank and compare lung radiotherapy plans: in-silico study to evaluate the correlation between TCP with physical quality indices[J]. Transl Lung Cancer Res, 2017, 6(3): 366-372. DOI:10.21037/tlcr.2017.04.07 |
| [12] |
冯斌, 郭栓栓, 姜仁伟, 等. 等效均匀剂量方法结合旋转容积调强技术在鼻咽癌放疗计划设计中的应用[J]. 广东医学, 2018, 39(3): 430-433. Feng B, Guo SS, Jiang RW, et al. Application of equivalent uniform dose method combined with rotary volumetric intensity modulated technique in radiotherapy planning for nasopharyngeal carcinoma[J]. Guangdong Med J, 2018, 39(3): 430-433. DOI:10.3969/j.issn.1001-9448.2018.03.028 |
| [13] |
Zuo YH, Yang Z, Zhou JL, et al. Application of equivalent uniform dose optimization based on the partitioning constraint of organs at risk in volume imRT for rectal cancer[J]. Chin J Med Phy, 2018, 35(1): 36-40. |
| [14] |
Zhou L, Jiang S, Yang ZY, et al. Application of equivalent uniform dose in the treatment of cervical cancer by intracavitary combined implantation[J]. Chin J Radiat Oncol, 2020, 29(07): 546-550. |
| [15] |
Shao Y, Zhang FL, Wang S, et al. Dosimetric study of four radiotherapy plan optimization methods in lung cancer mass segmentation radiotherapy[J]. Chin J Radiat Oncol, 2019, 28(003): 203-208. |
| [16] |
Xu ZH, Huang HX, Yang H, et al. Dosimetric characteristics of volume rotation intensity modulation in radiotherapy for locally advanced nasopharyngeal carcinoma[J]. ISTIC CSCD, 2020, 37(7): 863-866. |
| [17] |
Zuo YH, Yang Z, Zhou JL, et al. Comparison between fixed field and volumetric rotation intensity modulated radiotherapy for rectal cancer based on generalized equivalent uniform dose optimization[J]. Chin J Med Phy, 2018, 035(002): 171-175. |
| [18] |
Giantsoudi D, Baltas D, Karabis A, et al. A gEUD-based inverse planning technique for HDR prostate brachytherapy: feasibility study[J]. Med Phys, 2013, 40(4): 041704. DOI:10.1118/1.4793766 |
| [19] |
Niyazi M, Karin I, Söhn M, et al. Analysis of equivalent uniform dose (EUD) and conventional radiation treatment parameters after primary and re-irradiation of malignant glioma[J]. Radiat Oncol, 2013, 8: 287. DOI:10.1186/1748-717X-8-287 |
| [20] |
Wu QW, Mohan R, Niemierko A, et al. Optimization of intensity-modulated radiotherapy plans based on the equivalent uniform dose[J]. Int J Radiat Oncol Biol Phys, 2002, 52(1): 224-235. DOI:10.1016/s0360-3016(01)02585-8 |
| [21] |
邵琰, 王昊, 陈华, 等. 适形指数和均匀性指数的临床应用[J]. 中华放射医学与防护杂志, 2017, 37(9): 717-721. Shao Y, Wang H, Chen H, et al. Clinical applications of conformity index and homogeneity index[J]. Chin J Radiol Med Prot, 2017, 37(9): 717-721. DOI:10.3760/cma.j.issn.0254-5098.2017.09.016 |




