2. 空军军医大学军事预防医学系辐射防护医学教研室,陕西 西安 710032;
3. 山东第一医科大学放射学院,山东 泰安 271000
2. Department of Radiation Protection Medicine, Department of Military Preventive Medicine, Air Force Medical University, Xi’an 710032 China;
3. College of Radiology, Shandong First Medical University, Tai’an 271000 China
放射治疗是恶性肿瘤的主要治疗方法之一[1]。随着放疗技术的发展,肿瘤患者的预后得到明显改善,但放疗导致的并发症依然存在[2]。放射性脑损伤(Radiation-induced brain injury,RBI)是头颈部及颅内原发、继发肿瘤患者接受放射治疗后出现的严重并发症,可造成脑组织坏死、水肿、脱髓鞘,在临床上主要表现为认知和记忆损害等症状,目前缺乏有效的临床治疗手段。小胶质细胞是一种脑内固有免疫细胞[3],在中枢神经系统损伤及病情发展过程中发挥着不可忽视的作用。目前有关小胶质细胞极化的研究多集中在一些神经性疾病和颅脑损伤,而在放射性脑损伤中鲜见报道。因此,本研究以小鼠小胶质BV-2细胞为研究对象,探讨了10 Gy X射线对BV-2细胞极化的影响,以期为放射性脑损伤的防治提供新思路。
1 材料与方法 1.1 材料BV-2细胞购自美国ATCC公司,DMEM培养基购自Gibco公司,胎牛血清购自BI公司,PBS、0.25% EDTA-胰蛋白酶消化液购自Servicebio公司,高效RIPA组织/细胞快速裂解液、PMSF溶液、抗荧光衰减封片剂、5% BSA、即用型DAPI均购自北京索莱宝科技有限公司,TritonX-100购自美国MP公司,Penicillin-Streptomycin Solution试剂购自北京HyClone公司,细胞培养耗材购自Nest Biotechnology公司,BCA蛋白浓度试剂测定试剂盒购自上海碧云天生物技术有限公司,通用型抗体稀释液、无血清细胞冻存液均购自新赛美生物科技有限公司,iNOS购自英国abcam公司,CD86 Rabbit 单抗购自ABclonal公司、β-tubulin、CD206购自proteintech公司、Iba-1购自Gene Tex公司、Goat Anti-Rabbit、Goat Anti-Mouse和Coralite 488-conjugated Affinipure Goat Anti-Mouse IgG(H + L)购自西安壮志生物有限公司,ECL超敏发光液购自米鼠生物技术有限公司。
1.2 细胞分组及照射小鼠BV-2细胞用含10% 胎牛血清的DMEM高糖培养基[4],于37 ℃、5% CO2的培养箱内培养,当细胞处于对数生长期时用于实验。将BV-2细胞按4 × 106个/mL的密度接种于底面积为25 cm2的培养瓶,共30瓶;按1 × 105个/mL的密度接种于铺有20 mm圆形玻片的12孔板,共4板。后随机将其分为假照射组(Sham)和10 Gy照射组,培养24 h后,后者采用X射线单次照射,剂量为1.28 Gy/min,照射时间7 min 49 s,Sham组采取与10 Gy照射组相同的处理方法,但照射时X射线仪器关闭。
1.3 X射线对小胶质细胞活化的影响 1.3.1 细胞活化率的检测在X射线照射后1、3、6、24、48 h于光学显微镜下计数照射组活化的BV-2细胞数,每组计数10个不同视野,约1000个细胞,活化率 = (活化细胞数/细胞总数) × 100%。
1.3.2 苏木素-伊红(HE)染色在X射线照后6 h取出12孔板中的圆形玻片,PBS轻洗3次 × 3 min,95%乙醇固定20 min,PBS轻洗,苏木素染液染色1~2 min,自来水洗涤,1%盐酸酒精溶液分色2~3 s,自来水轻洗,伊红染液染色2~3 min,自来水轻洗,晾干细胞爬片后,中性树胶封片,于光学显微镜下拍照。
1.3.3 免疫荧光染色(Immunofluorescence staining,IF)在X射线照后6 h取出12孔板中的圆形玻片,PBS轻洗3次 × 3 min,4%多聚甲醛室温固定15 min,PBS轻洗,0.3% TritonX-100破膜5 min,PBS轻洗,加入小鼠抗小鼠Iba-1抗体(1∶200)4 ℃孵育过夜,次日PBS洗3次后,加入FITC标记的山羊抗小鼠二抗,避光湿盒中室温孵育90 min,PBS洗3次,加入DAPI溶液(即用型)室温染色5 min,PBS轻洗,抗荧光衰减封片剂封片,于激光显微镜下拍照。−20 ℃避光保存备用。
1.4 X射线对小胶质细胞极化的影响 1.4.1 酶联免疫吸附试验(ELISA)检测在照射后1、3、6、24、48 h收集细胞上清液,按ELISA试剂盒的操作要求检测BV-2细胞上清中M1型(TNF-α、IL-1β)和M2型标记物(TGF-β1)细胞因子水平。
1.4.2 蛋白免疫印迹试验(Western blotting)检测在照射后1、3、6、24、48 h收集细胞,用RIPA∶PMSF = 100∶1提取蛋白,BCA法进行蛋白定量。上样至10% SDS-PAGE凝胶中进行电泳分离,以湿转法至PVDF膜,5% 脱脂奶粉室温封闭2 h,TBST轻洗PVDF膜,分别按如下稀释比加入一抗:兔抗小鼠CD86抗体(1∶500)、兔抗小鼠iNOS抗体(1∶400)、小鼠抗小鼠CD206抗体(1∶2 000)、兔抗小鼠β-tubulin抗体(1∶4000),4 ℃摇床孵育过夜后,TBST洗膜4次 × 5 min,加入相应种属源二抗(1∶5000)室温于摇床上孵育2 h,TBST洗膜4次 × 5 min,滴加ECL发光液后于发光仪上发光拍照。蛋白表达条带用Quantity one软件进行灰度分析。
1.5 统计学处理采用SPSS 20.0进行数据分析,数据符合正态分布,采用单样本t检验和单因素方差分析比较差异性,数据不满足正态性及方差齐性时采用秩和检验,
光学显微镜下观察10 Gy X射线照射后细胞形态,发现X射线照射后1 h,部分小胶质细胞出现胞体变大,突起变粗变短,呈“阿米巴”样改变,提示X射线照射后BV-2发生了活化。每组随机观察并分析1000个细胞,计数形态改变的小胶质细胞所占百分比,结果显示,与Sham组相比,BV-2细胞的活化于照射后1 h即开始增加(t = 1.934,P > 0.05),6 h达到高峰( t = 5.859,P < 0.001),48 h开始恢复( t = 3.988,P < 0.01),差异有统计学意义(见 图1)。
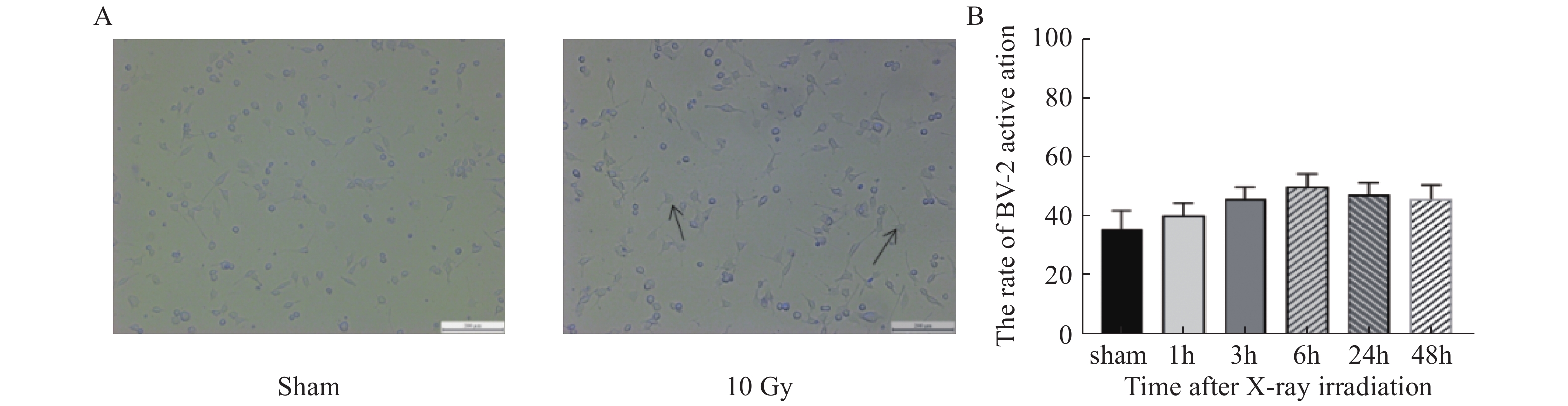
|
图 1 10 Gy X射线照后对BV-2细胞活化的影响 Figure 1 Effect of 10 Gy X-ray irradiation on activation of BV-2 cells 注:A:10 Gy X射线照后6 h光镜下细胞形态,标尺 = 200 μm,(箭头所示为BV-2活化细胞)B:BV-2活化率;bP < 0.01,cP < 0.001 vs假照射组。 |
HE染色结果显示,Sham组BV-2细胞胞体较小,细胞多为圆形或梭形,突起细长,10 Gy照射后6 h部分细胞胞体变大,突起变粗短,呈“阿米巴”状(见图2),提示10 Gy照射可诱导小胶质细胞活化。
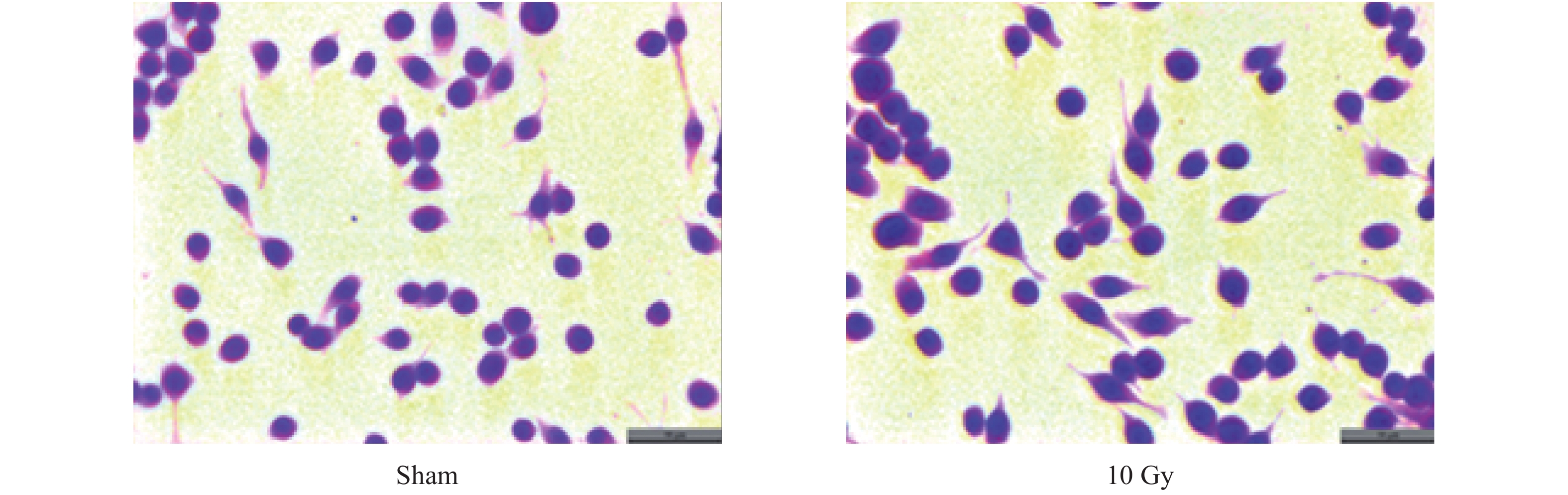
|
图 2 10 Gy X射线照后6 h HE染色结果(标尺 = 50 μm) Figure 2 Cells stained with HE at 6 h after 10 Gy X-ray irradiation (Scale bar = 50 μm) |
Iba-1是BV-2细胞的标志物,对经10 Gy X射线照射后6 h的BV-2细胞进行Iba-1荧光染色,结果显示,静息态小胶质细胞多为圆形或梭形,突起细长,激活后突起变粗短,呈“阿米巴”状(图3)。
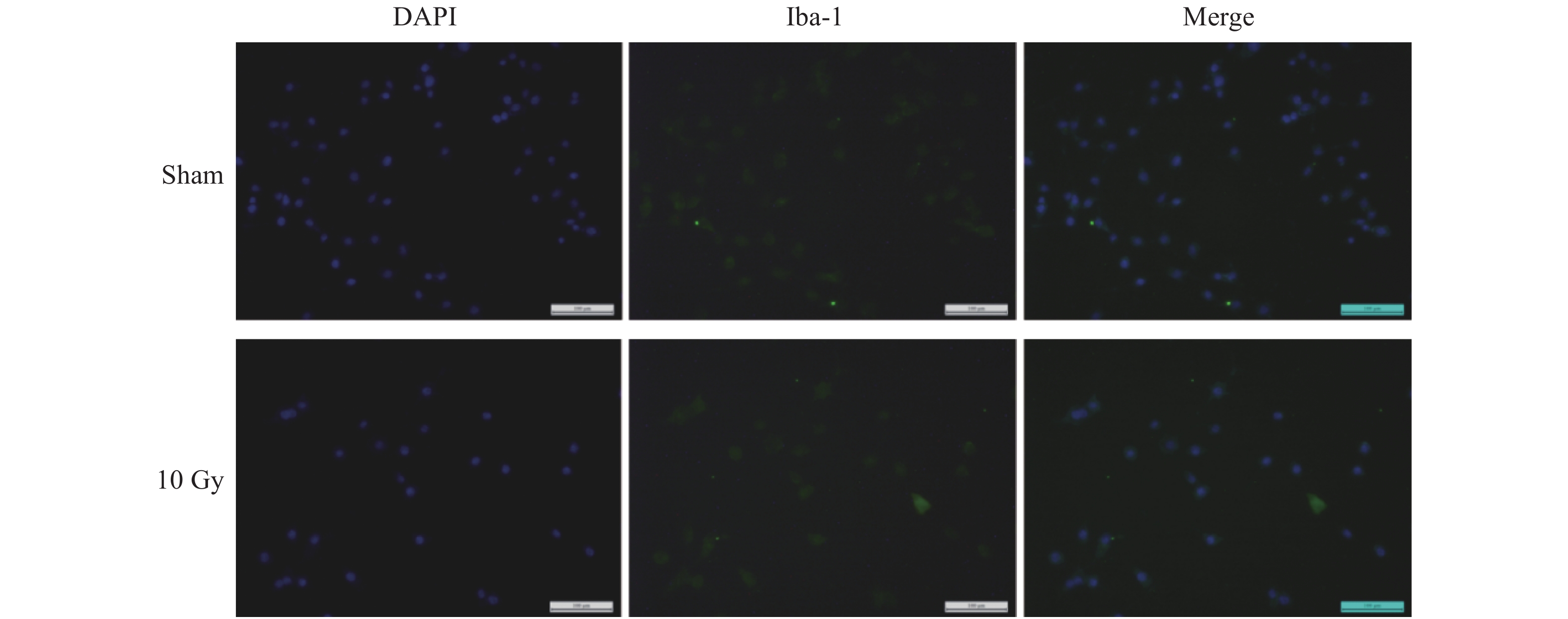
|
图 3 10 Gy X射线照后6 h免疫荧光染色结果(Iba-1,绿色;DAPI,蓝色)(标尺 = 100 μm) Figure 3 Immunofluorencestaining of Iba-1(green)and DAPI(blue)at 6 h after 10 Gy X-ray irradiation(Scale bar = 100 μm) |
ELISA结果显示,与Sham组相比,小胶质细胞M1型极化标志物TNF-α水平在10 GyX射线照射后出现增高-恢复-再增高的变化特点,随后在照射后1、6 h和48 h差异有统计学意义(图4A,t = 4.443,P < 0.01;t = 4.133,P < 0.01;t = 5.14,P < 0.001);与Sham组相比,IL-1β水平于照后3~6 h出现一过性降低,随后在照后24 h开始增高( t = 4.209,P < 0.01),至照后48 h达到高峰( t = 14.356,P < 0.001),差异有统计学意义( 图4B)。小胶质细胞M2型极化标志物TGF-β1水平在照射后24 h开始持续增高(t = 6.38,P < 0.001),与Sham组相比,差异有统计学意义( 图4C)。上述结果提示,10 Gy X射线照射可致BV-2细胞极化为M1和M2型,在照射后48 h效应最明显。
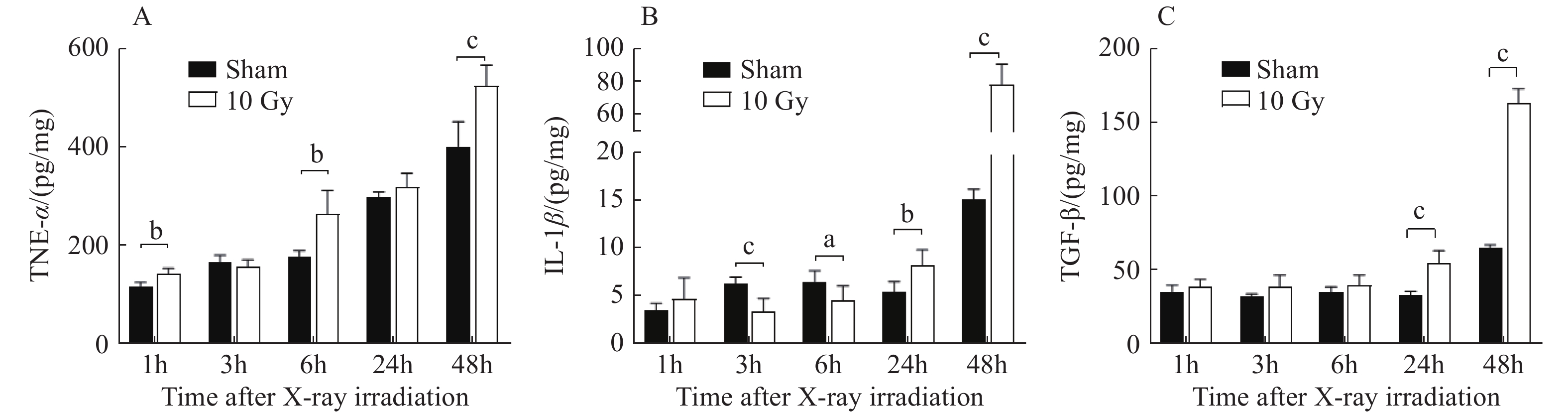
|
图 4 10 Gy X射线照后BV-2细胞极化相关标志物水平的变化 Figure 4 Detection of polarization-related markers in BV-2 cells after 10 GyX-ray irradiation 注:A:TNF-α水平的定量分析B:IL-1β水平的定量分析 C:TGF-β1水平的定量分析;aP < 0.05,bP < 0.01,cP < 0.001 vs假照射组。 |
Westen blotting结果显示,与Sham相比,照射组细胞M1型相关蛋白iNOS水平于照射后1 h即明显增加(t = 9.732,P < 0.001),在照后48 h达到高峰( t = 12.27,P < 0.001),差异有统计学意义( 图5B),CD86蛋白水平在照射后48 h内无明显变化(图5C,t = 1.281,P > 0.05)。与Sham组相比,M2型相关蛋白CD206在照射后出现先降低后升高交替波动性变化( t = 5.711,P < 0.01;t = 2.706,P < 0.05;t = 27.94,P < 0.001;t = 16.45,P < 0.001),差异有统计学意义( 图5D)。上述结果提示,X射线可致BV-2细胞激活,并可同时极化为M1、M2型。
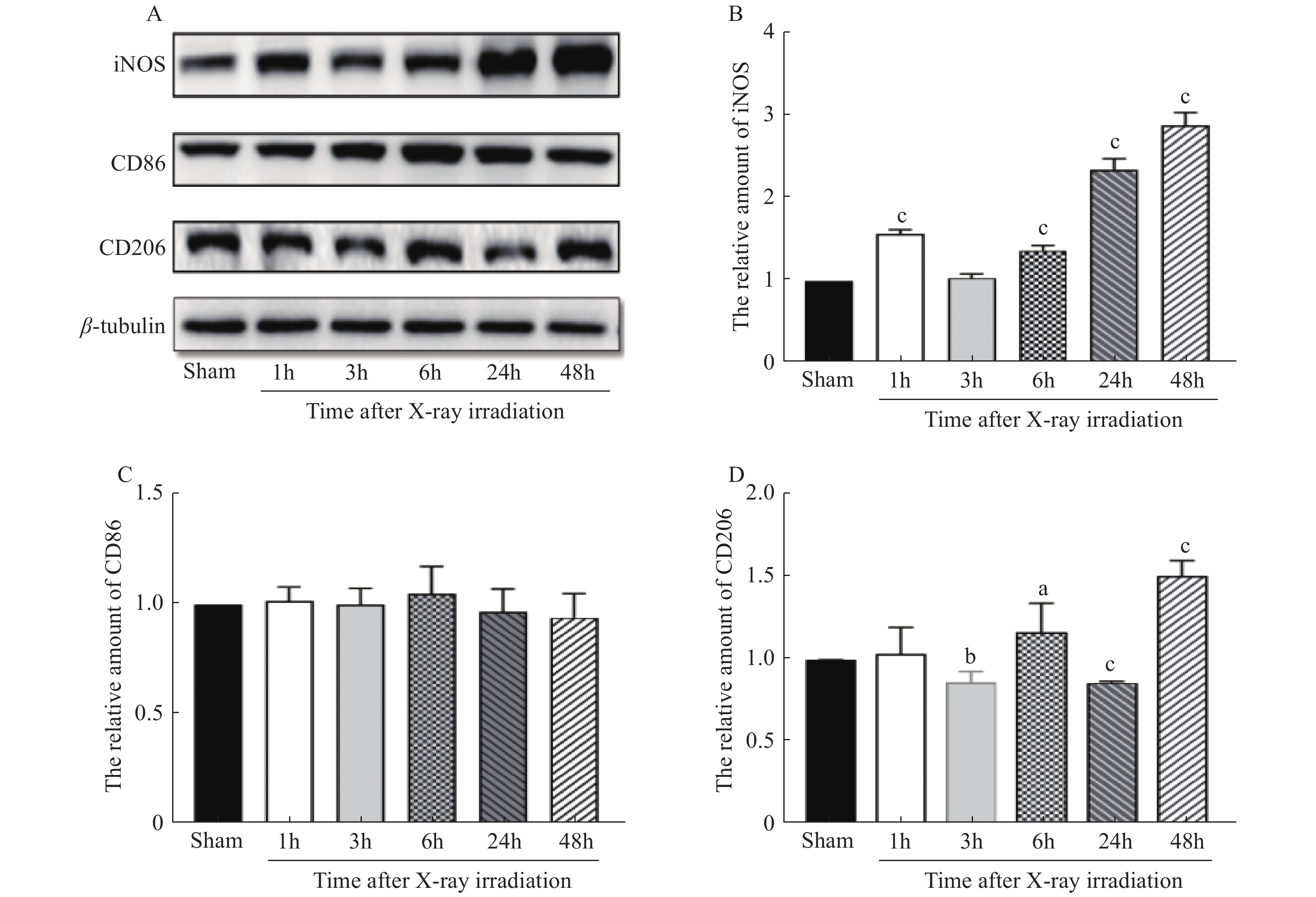
|
图 5 10 Gy X射线照后BV-2细胞极化相关蛋白水平的变化 Figure 5 Detection of polarization related proteins in BV-2 cells after 10 Gy X-ray irradiation 注:A:蛋白杂交结果图B:iNOS蛋白水平定量分析C:CD86蛋白水平定量分析 C:CD206蛋白水平定量分析;aP < 0.05,bP < 0.01,cP < 0.001 vs假照射组。 |
小胶质细胞是中枢神经系统中固有的免疫细胞[5]。生理情况下,大部分小胶质细胞处于静息态,形态上主要表现为胞体较小、突起细长,在维持中枢神经系统稳态中发挥重要作用。当机体受到外界刺激时,小胶质细胞可从静息态转化为激活态,此时,细胞胞体增大、突起变粗、变短,呈阿米巴样,激活后的小胶质细胞可表现为M1型和M2型2种极化状态,发挥细胞毒性和修复作用[6-7]。
已有研究表明,射线可导致离体培养的小胶质细胞激活。Xue[8]等采用137Cs辐射器以总吸收剂量16 Gy射线照射BV-2细胞,照后30 min即可在光镜下观察到细胞胞体变大、突起变粗短,呈典型的“激活态”。卢奎等[9]采取10 Gy β射线照射BV-2细胞,24 h后行免疫荧光染色,发现细胞形态呈“阿米巴”样改变。本研究选择10 Gy X射线照射BV-2细胞,然后在相差显微镜下观察了照射后不同时间BV-2细胞形态变化,发现照射后3 h小胶质细胞由胞体较小,突起细长的“静息态”变为胞体较大,突起粗短的“激活态”。HE染色结果和Iba-1免疫荧光染色结果也证实了这个变化。上述结果提示,10 Gy X射线可诱导BV-2细胞激活,该结果与上述报道一致。
既往研究认为,活化的小胶质细胞可以极化为经典激活表型M1和替代激活表型M2[10-11],这2种不同的表型代表了小胶质细胞2种不同的生理功能:M1型小胶质细胞通过分泌iNOS、CD86、IL-1β、IL-6和TNF-α等促炎因子及CXCL9、CCL2等趋化因子[12]介导神经炎症,对细胞及组织产生毒副作用[13]。与M1表型相反,M2型小胶质细胞通过释放神经营养因子,如TGF-β、Arg-1、CD206、和IL-10[14]等抗炎因子抑制免疫应答、促进伤口愈合和组织修复[15-16]。同时,小胶质细胞不同表型之间可以发生转换,通过调节小胶质细胞M1/M2极化状态的平衡,可以减轻或避免神经炎症的发生,进而保护神经系统。体外实验表明,通过脂多糖(LPS)或干扰素γ(IFN-γ)可诱导静息态的小胶质细胞向M1型极化,也可通过IL-4或IL-10诱导小胶质细胞向M2型极化[17]。
关于射线诱导小胶质细胞极化类型和炎症因子释放规律的报道,目前尚无一致结论。Dong[18]等检测了小胶质细胞经16 Gy X射线(2.0 Gy/min)照射后,M1型极化相关炎性因子的水平,结果显示,TNF-α和IL-1β水平分别在照射后6 h和3 h达到高峰。高喜璨等[19]则发现,小胶质细胞经10 Gy X射线(2.0 Gy/min)照射后,BV-2细胞TNF-α和IL-1β蛋白水平分别在照射后3 h和6 h达到高峰。Peng等[20]用10 Gy β射线(3.0 Gy/min)照射BV-2细胞,发现其炎症因子(M1型)释放高峰期为照射后24~48 h。
在本实验中,我们用ELISA法检测了经10 Gy(1.28 Gy/min)X射线照射后BV-2细胞培养上清中M1型相关炎性因子(TNF-α和IL-1β)和M2型抑炎因子(TGF-β1)水平的变化。结果显示,X射线照射后,TNF-α、IL-1β及TGF-β1水平在照后48 h均明显增高。其中,照射组TNF-α水平较Sham组增高约1.3倍,IL-1β水平照射组较Sham组增高约5.2倍,TGF-β1水平照射组较Sham组增高约2.5倍。表明照射后48 h BV-2细胞可能同时极化为M1和M2型,且以M1型极化为主。为验证该结果,我们采用Western Blot方法检测BV-2细胞中M1型相关蛋白iNOS、CD86和M2型蛋白CD206等的表达情况。结果发现,与Sham组相比,CD86蛋白含量在照射后48 h内无明显变化,iNOS和CD206蛋白含量在照射后48 h增高最明显,其中照射组iNOS含量较Sham组增高了约2.7倍,CD206含量增高了约1.5倍。提示,10 Gy X线照射后48 h,BV-2细胞主要极化为M1型。与本实验的ELISA检测结果一致。
综上,在本实验条件下,10 Gy X射线照射可致BV-2细胞活化,其极化类型随照后时间的不同而变化,在照后48 h主要极化为M1型。关于射线诱导BV-2细胞极化的信号通路有待进一步研究。
| [1] |
杨思琦, 姚颐, 宋启斌, 等. DNA损伤修复与肿瘤的放射敏感性[J]. 中国辐射卫生, 2020, 29(4): 442-445. Yang SQ, Yao Y, Song QB, et al. DNA damage repair and radiosensitivity of tumor[J]. Chin J Radiol Health, 2020, 29(4): 442-445. DOI:10.13491/j.issn.1004-714X.2020.04.030 |
| [2] |
李梅, 刘梦雅, 王新钢, 等. NHEJ通路相关基因在电离辐射所致脑损伤中的表达情况研究[J]. 中国辐射卫生, 2019, 28(3): 223-227. Li M, Liu MY, Wang XG, et al. Research of expression of NHEJ pathway related genes in brain injury induced by ionizing radiation[J]. Chin J Radiol Health, 2019, 28(3): 223-227. DOI:10.13491/j.issn.1004-714x.2019.03.001 |
| [3] |
Deng XL, Feng L, Wang ZX, et al. The Runx1/Notch1 signaling pathway participates in M1/M2 microglia polarization in a mouse model of temporal lobe epilepsy and in BV-2 cells[J]. Neurochem Res, 2020, 45(9): 2204-2216. DOI:10.1007/s11064-020-03082-3 |
| [4] |
Yao Y, Fu KY. Serum-deprivation leads to activation-like changes in primary microglia and BV-2 cells but not astrocytes[J]. Biomed Rep, 2020, 13(5): 51. DOI:10.3892/br.2020.1358 |
| [5] |
Masuda T, Sankowski R, Staszewski O, et al. Microglia heterogeneity in the single-cell era[J]. Cell Rep, 2020, 30(5): 1271-1281. DOI:10.1016/j.celrep.2020.01.010 |
| [6] |
Wolf SA, Boddeke HWGM, Kettenmann H. Microglia in physiology and disease[J]. Annu Rev Physiol, 2017, 79: 619-643. DOI:10.1146/annurev-physiol-022516-034406 |
| [7] |
Fumagalli S, Perego C, Pischiutta F, et al. The ischemic environment drives microglia and macrophage function[J]. Front Neurol, 2015, 6: 81. DOI:10.3389/fneur.2015.00081 |
| [8] |
Xue J, Dong JH, Huang GD, et al. NF-κB signaling modulates radiation-induced microglial activation[J]. Oncol Rep, 2014, 31(6): 2555-2560. DOI:10.3892/or.2014.3144 |
| [9] |
卢奎, 张成, 吴文军, 等. CORM-3介导小胶质细胞ICAM-1抑制放射性脑损伤炎症反应[J]. 中华临床医师杂志(电子版), 2015, 9(4): 602-606. Lu K, Zhang C, Wu WJ, et al. The effects of CORM-3 on inflammation of radiation brain injury mediated by ICAM-1 expression of microglia[J]. Chin J Clin Electron Ed, 2015, 9(4): 602-606. DOI:10.3877/cma.j.issn.1674-0785.2015.04.020 |
| [10] |
梅亚波, 张万巧, 陈冲, 等. 人脐带间充质干细胞对脂多糖活化的小胶质细胞BV-2表型的影响[J]. 中华细胞与干细胞杂志(电子版), 2020, 10(4): 213-218. Mei YB, Zhang WQ, Chen C, et al. Effects of human umbilical cord tissue-derived mesenchymal stem cell on the phenotype of BV-2 cells activated by lipopolysaccharidein vitro[J]. Chin J Cell Stem Cell, 2020, 10(4): 213-218. DOI:10.3877/cma.j.issn.2095-1221.2020.04.003 |
| [11] |
Kim RE, Shin CY, Han SH, et al. Astaxanthin suppresses PM2.5-induced neuroinflammation by regulating Akt phosphorylation in BV-2 microglial cells
[J]. Int J Mol Sci, 2020, 21(19): 7227. DOI:10.3390/ijms21197227 |
| [12] |
Przanowski P, Mondal SS, Cabaj A, et al. Open chromatin landscape of rat microglia upon proinvasive or inflammatory polarization[J]. Glia, 2019, 67(12): 2312-2328. DOI:10.1002/glia.23686 |
| [13] |
Xiong XY, Liu L, Yang QW. Functions and mechanisms of microglia/macrophages in neuroinflammation and neurogenesis after stroke[J]. Prog Neurobiol, 2016, 142: 23-44. DOI:10.1016/j.pneurobio.2016.05.001 |
| [14] |
Chen MR, Chen QL, Tao T. Tanshinone IIA promotes M2 microglia by ERβ/IL-10 pathway and attenuates neuronal loss in mouse TBI model[J]. Neuropsychiatr Dis Treat, 2020, 16: 3239-3250. DOI:10.2147/NDT.S265478 |
| [15] |
Kanazawa M, Miura M, Toriyabe M, et al. Microglia preconditioned by oxygen-glucose deprivation promote functional recovery in ischemic rats[J]. Sci Rep, 2017, 7: 42582. DOI:10.1038/srep42582 |
| [16] |
Ramirez AI, de Hoz R, Salobrar-Garcia E, et al. The role of microglia in retinal neurodegeneration: Alzheimer's disease, parkinson, and Glaucoma
[J]. Front Aging Neurosci, 2017, 9: 214. DOI:10.3389/fnagi.2017.00214 |
| [17] |
Zhao R, Ying MF, Gu SL, et al. Cysteinyl leukotriene receptor 2 is involved in inflammation and neuronal damage by mediating microglia M1/M2 polarization through NF-κB pathway[J]. Neuroscience, 2019, 422: 99-118. DOI:10.1016/j.neuroscience.2019.10.048 |
| [18] |
Dong XR, Luo M, Huang GD, et al. Relationship between irradiation-induced neuro-inflammatory environments and impaired cognitive function in the developing brain of mice[J]. Int J Radiat Biol, 2015, 91(3): 224-239. DOI:10.3109/09553002.2014.988895 |
| [19] |
高喜璨. PIDD在放射性脑损伤中对小胶质细胞激活的调节作用及机制研究[D]. 武汉: 华中科技大学, 2016. Gao XC. PIDD Regulates Microglia Activation and itis Mechanism in Radiation-induced Brain Injury[D]. Wuhan: Huazhong University of Science and Technology, 2016. |
| [20] |
Peng Y, Lu K, Li ZC, et al. Blockade of Kv1.3 channels ameliorates radiation-induced brain injury[J]. Neuro Oncol, 2014, 16(4): 528-539. DOI:10.1093/neuonc/not221 |




