蛋白质组学(Proteomics)为后基因组学一部分,最早由MarcWikins和其他学者提出[1]。蛋白质组(Proteome)是在活细胞、组织或生物体中发现的完整蛋白质集合,它代表基因转录、翻译和通过翻译后蛋白质修饰(Post-translational protein modification,PTM)进行蛋白质合成的最终结果[2]。蛋白质组学是对蛋白质在时间和空间中的表达、结构和功能的大规模研究[3]。蛋白质组学方法能较大范围的筛选出不同生理病理状态下蛋白质表达的差异,在各种肿瘤候选生物标志物的应用中比较广泛。
辐射诱导的蛋白质组学研究比较少,加上大多属于探索阶段,由于蛋白质组学本身的复杂性,目前辐射蛋白质组学研究结果可稳定重复的不多,仍需更系统的研究来探索。
1 基于质谱技术的蛋白质组学的研究方法 1.1 质谱技术的原理质谱技术原理是使样品分子离子化后,根据不同离子间的分子量与电荷数比值(m/z)的差异分离并确定分子量。软电离技术(如基质辅助激光解吸电离(Matrix assisted laser desorption-ionization,MALDI)和电喷雾电离(Electrospray ionization,ESI)[4, 5])的发现使得质谱技术进一步发展,大大方便了生物样品中蛋白质和肽的鉴定。基质辅助激光解吸电离质谱仪(MALDI-MS)可与飞行时间(Time of flight,TOF)分析仪联用,即基质辅助激光解吸电离飞行时间质谱仪(MALDI-TOF-MS)。该仪器通过混合生物样品和基质材料后吸收紫外激光束实现生物样品的离子化。当紫外激光射到基质,引起表面物质的解离,然后将带有单电荷的分析物离子转移至气相,最后由TOF分析仪测量每个通过的气态离子在真空管中的飞行时间来推导分析物的质量[4]。电喷雾电离(ESI)则是在溶质介质中用2000~5000 V的电压将样品电离,形成高度带电液滴,最终蒸发使离子进入质谱仪[5]。
1.2 蛋白质组学的定量质谱分析策略定量蛋白组分析是现在蛋白质组学研究领域常规的研究手段。基于质谱的定量蛋白质鉴定方法包括2种:其一是对完整蛋白质进行检测,也被称为“自上而下”法;另一种方法是识别蛋白质裂解产物,也被称为“自下而上”法或鸟枪法(Shotgun method)。
“自上而下”法对样品无需酶处理,是将完整的蛋白质电离后进行LC/MS检测,可以检测蛋白质型、蛋白质同工型和翻译后修饰(PTM)的特征。MALDI-TOF-MS能够应用于研究蛋白质的翻译后修饰和蛋白质之间的相互关系,所以在“自上而下”的蛋白质组学和蛋白质翻译后修饰的研究中应用广泛,但是由于气态下蛋白质分馏、电离和裂解的困难性导致top-down法仍不太成熟。
“自下而上”法是将样品用化学试剂或者酶消化后变成肽段,继而用串联质谱(MS/MS)分析,随后用生物信息学工具识别肽段并与串联质谱相匹配,进而识别样品中的蛋白质及肽段。此法所需样品量少,灵敏度高,在寻找生物标志物的过程中仍是首选[3]。
1.3 蛋白质组学的质谱定量分析技术鉴于“自上而下”蛋白质组学技术应用的局限性,目前生物样品中的蛋白质鉴定首选方法是“自下而上”法。“自下而上”法主要涉及蛋白质的消化、分离、电离、质谱定量、生物信息学分析、生物标志物的确认及验证。
1.3.1 蛋白质的分离蛋白质组学研究需要对蛋白质沉淀和复溶,所以蛋白质的分离尤为重要。一般可用电泳法、气相法或液相法分离蛋白质。近二十多年来,二维十二烷基硫酸钠聚丙烯酰胺凝胶电泳(2-dimensionalSodium dodecyl sulfatepolyacrylamide gel electrophoresis,2D-SDS-PAGE)和二维差异凝胶电泳(Two-dimensional difference gel electrophoresis,2D-DIGE)是蛋白分离的主要方法。随着色谱质谱技术的发展,蛋白质和肽的分离技术也有了很大的进步。目前来看,传统的基于双向电泳的2D-SDS-PAGE和2D-DIGE蛋白质分离技术正在逐渐被基于纳米级液相色谱-串联质谱(Liquid chromatography/tandem mass spectrometry,NanoLC-MS/MS)的液质联用肽段分离技术取代。
1.3.2 蛋白质的定量蛋白质在被分离后经电离再进行质谱定量,在现在常用的蛋白质质谱定量方法主要包括2大类:一是无标记法;另一种则是蛋白质和肽标记法。无标记定量法(如光谱计数和提取离子色谱)样品处理简单、相对便宜,而且有更好的动态范围,可以定量大量样品。
标记定量则需对样品进行化学标记或代谢物标记。化学标记手段如同位素编码亲和标记(Isotope-coded affinity tags,ICAT)是标记蛋白质中的半胱氨酸残基,此法能简化样品的复杂性,有利于低丰度蛋白的定量分析,缺点是蛋白质序列的覆盖率低;同位素相对和绝对定量标记(Isobaric tag for relative absolute quantitation,iTRAQ)和串联质谱标记(Tandem mass tags,TMT)采用多个(2~10)稳定同位素标签,特异性标记多肽的氨基基团进行串联质谱分析,能够同时比较多达10种不同样本中蛋白质的相对含量,可用于研究不同病理条件下或者不同发育阶段的生物样品中蛋白质表达水平的差异。
而常见的代谢物标记方法是在细胞培养时采用稳定同位素来标记氨基酸(Stable isotope labeling by amino acids in cell culture,SILAC),即采用碳的重同位素(13C)或者氮的重同位素(15N)标记氨基酸并用于细胞培养,然后用这些被标记的氨基酸通过翻译进入蛋白质序列。细胞培养5~6代后其所有蛋白质均被同位素标记上,经处理因素刺激后,等量混合各类型蛋白质,然后经SDS-PAGE分离和质谱分析,比较一级质谱图中同位素峰型的面积大小进行相对定量,同时用二级质谱图对肽段进行序列测定从而鉴定蛋白质[3]。
1.3.3 蛋白质组学的生物信息学分析生物样品中的蛋白质被质谱处理后会产生大量待分析处理的数据,需要精密的处理软件和数据库才能完成蛋白质的搜索和鉴定,所以生物信息学分析是必不可少的。常用的肽段识别软件有Sequest、X!Tandem、MyriMatch、Andromeda、Mascot[6],Mascot是一个广泛使用的商业搜索引擎,而MyriMatch的算法分辨能力优于Sequest和X!Tandem。识别肽段后需进行肽谱匹配搜库检索,Uniprot、Global Proteome Machine Database(GPMDB)、PRIDE databaseand PeptideAtlas是常用的数据库,Uniprot包含Swiss-Prot、TrEMBL和PIR-PSD三大数据库的数据,是信息最丰富的蛋白质数据库;GPMDB可以通过蛋白、基因名称或者motif加上种属即可获得有关蛋白的质谱鉴定数据,包括肽段序列、翻译后修饰等;PRIDE数据库整合了NCBIpeptidome数据,为蛋白质组学基本数据源起到了非常基础和有力的支撑作用;PeptideAtlas则在肾脏和血浆相关蛋白质组学中有非常高的可信度。在此基础上对识别的蛋白质进行功能分析,为后续蛋白分析提供生物信息学基础,GO富集分析(Gene ontology)、KEGG富集分析(Kyoto Encyclopedia of Genes and Genomes)及蛋白质交互网络分析(如STRING、Cytoscape)是目前常用的蛋白质分析手段。
1.4 候选生物标志物的验证生物标志物的发现与验证是连接蛋白质组学和临床诊断的重要桥梁。生物标志物(Biomarker)是指用于表征患者体内异常状态存在的客观测量的分子物质。可以是特定疾病相关的基因(如单核苷酸多态性)、蛋白质(如前列腺特异性抗原)或代谢物(如葡萄糖、胆固醇等)[7]。辐射响应基因生物标志物是现在研究热点,陈慧峰等[8]发现不同剂量电离辐射均可诱导DNA损伤修复相关的应答基因hOGG1、MGMT、PPP2R1A和PPP2R2D的转录水平改变。侯殿俊等[9]通过实时定量PCR技术检测不同剂量照射引起人外周血miRNA-150表达,发现照射后外周血中miR-150差异表达与辐射损伤有关,可成为预测辐射损伤的潜在生物标志物。
目前常用的生物标志物的验证方法有ELISA(Enzyme-linked immunosorbent assay)、免疫印迹、免疫组化、蛋白阵列等[10]。此外还有基于质谱的靶向方法即蛋白质和肽段的定量质谱,包括选择性反应监测技术(Selected reaction monitoring,SRM)和多重反应监测技术(Multiple-reactionmonitoring,MRM)[11]。SRM灵敏度高、通量高,是候选生物标志物验证的常用方法,Schaf等[12]利用SRM定量分析胶质母细胞瘤患者肿瘤组织中的甲基转移酶(MGMT)蛋白和表皮生长因子受体(EGFR)蛋白,发现MGMT蛋白表达与启动子甲基化状态显著相关,此外EGFR蛋白表达与EGFR扩增之间在统计学上具有显着相关性。Van Steenoven等[13]使用ELISA和SRM分析路易小体(DLB)痴呆患者脑脊液中的神经分泌蛋白(VGF),发现DLB痴呆患者脑脊液中VGF蛋白表达高于对照组。Di Meo等[14]研究肾上皮细胞瘤患者、进行性和非进行性透明细胞早期肾细胞癌(RCC)患者和健康对照者的尿液,使用SDM鉴定9种在透明细胞RCC-SRM中显示出明显升高表达的内源肽,其中3种(NVINGGSHAGNKLAMQEF,VNVDEVGGEALGRL和VVAGVANALAHKYH)在透明细胞RCC-SRM中表达明显高于肾上皮细胞瘤。
2 蛋白质组学技术在辐射领域的应用 2.1 国内外进展何清等[15]采用5 Gy的60Coγ射线照射小鼠,构建小鼠电离辐照损伤模型,并提取实验组和对照组小鼠的脾脏组织,利用iTRAQ联合LC-MS /MS技术,筛选出核糖体信号通路上的36个上调蛋白和1个下调蛋白,涉及核糖体蛋白、60S核糖体蛋白、40S核糖体蛋白等多个亚基蛋白,这些蛋白主要参与蛋白质的翻译及核糖体的结构组成等生物过程,证明脾脏组织中蛋白质合成障碍是电离辐照损伤的重要机制。罗芳芳等[16]对小鼠进行5 Gy的60Coγ射线照射,取小鼠睾丸进行蛋白质组学的质谱对比分析,发现13个富集于氧化磷酸化信号通路的蛋白表达均下调,该通路涉及ATP合成酶、细胞色素、NADH脱氢酶这3类蛋白的多个亚基,它们主要参与线粒体呼吸链复合物I装配、线粒体电子传递、ATP生物合成等生物过程,这表示电离辐射会通过导致ATP合成障碍引起辐射损伤。
此外,王治东及其团队[17]利用蛋白质组学的双向电泳和蛋白质氨基酸序列分析技术研究了8 Gy60Co γ射线照射后24 h小鼠血清蛋白质的变化,并用蛋白质印迹(Western blot)方法进行验证,结果显示经8 Gy60 Co γ射线照射后24 h小鼠血清中结合珠蛋白的α亚单位显著增加。陈伟等[18]用60Co γ射线以0.1、0.5、1 Gy剂量照射小鼠,处死后进行血清样本的MALDI-TOF-MS/MS分析,发现照射组和对照组有7个差异表达蛋白质,包括载脂蛋白C-Ⅲ、β珠蛋白、腮腺分泌蛋白、α-2巨球蛋白前体、Clqc蛋白和丛生蛋白6个上调蛋白以及转甲状腺蛋白晶体结构H链1个下调蛋白,提示辐照引起小鼠血清蛋白质的表达变化。
在WebofScience(WoS)搜索“proteomics&radiation”1995—2020年主题词得到共计661条结果,以下是近年来收录辐射相关蛋白质组学研究前十名领域(图1)。
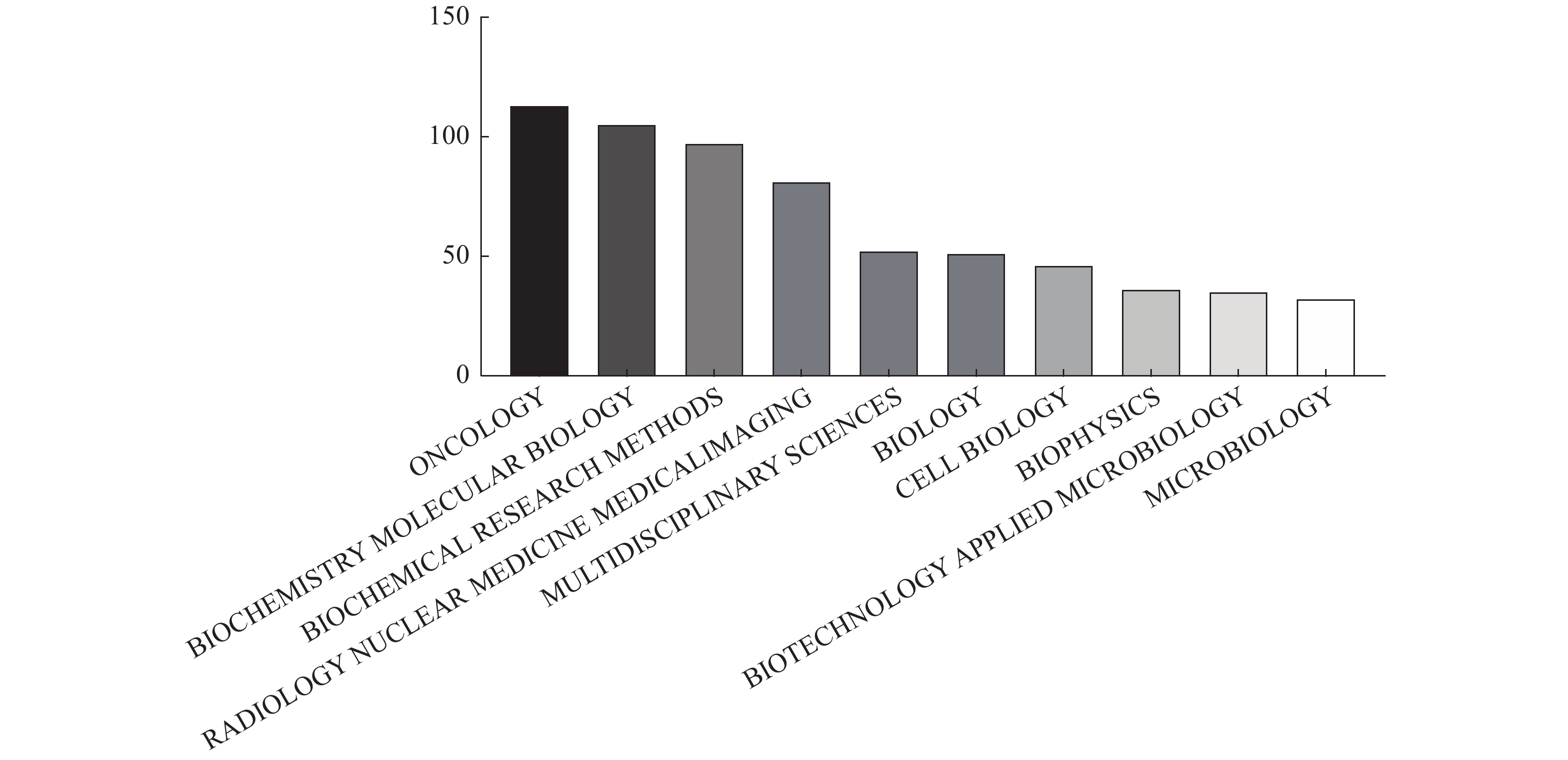
|
图 1 辐射相关蛋白质组学研究领域 Figure 1 Radiation-related proteomics research field |
使用CiteSpace[19]导入WoS数据并进行可视化分析,得到关键词共现可视化图谱及聚类可视化图谱(图2、图3)。
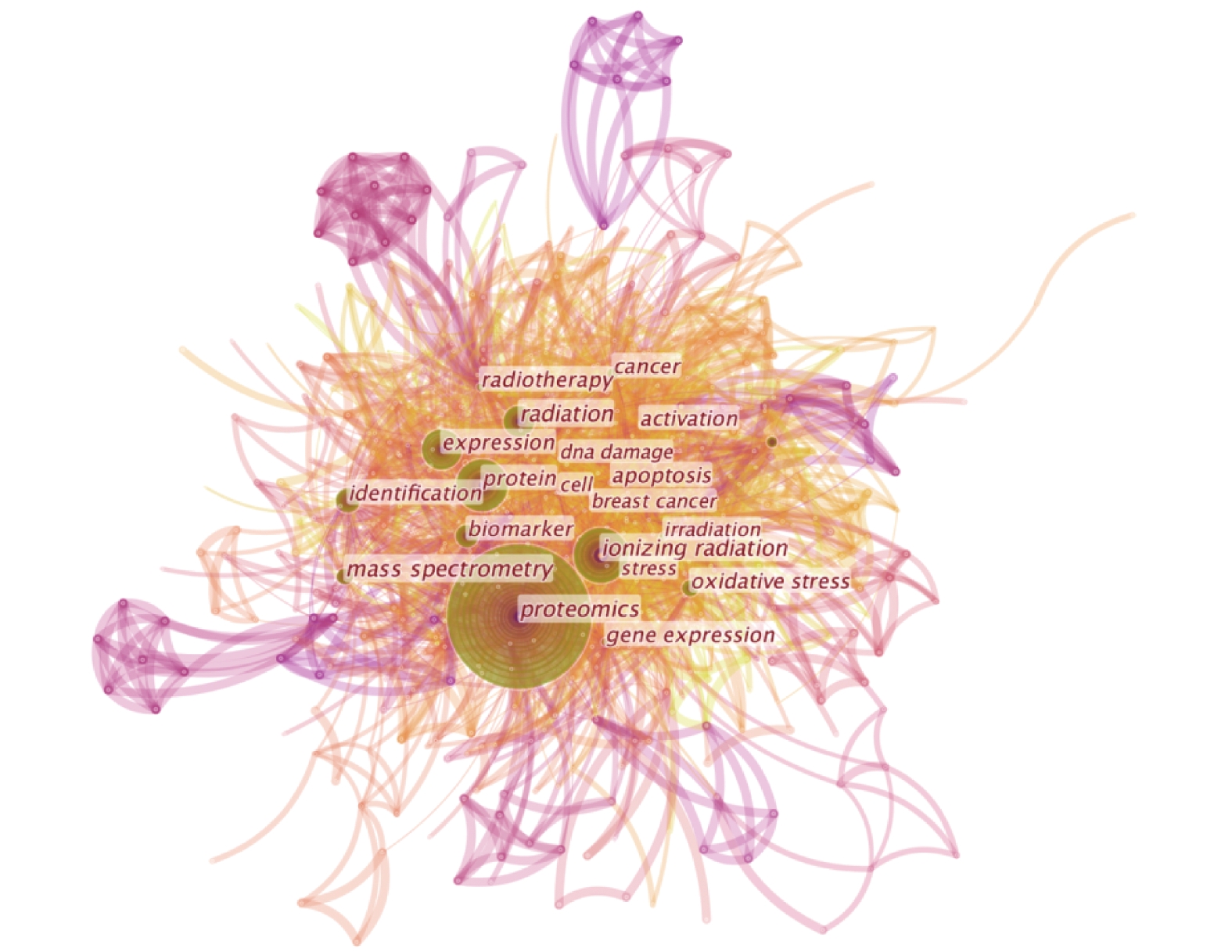
|
图 2 关键词共现可视化图谱 Figure 2 Keywords co-occurrence visualization map |

|
图 3 聚类可视化图谱 Figure 3 Cluster visualization map |
从图2可以看出,辐射领域的蛋白质组学主要关键词包括蛋白质组学(Proteomics)、电离辐射(Ionizingradiation)、放射疗法(Radiotherapy)、癌症(Cancer)、质谱(Massspectrometry)、生物标志物(Biomarker)、基因表达(Geneexpression)、氧化应激(Oxidativestress)、凋亡(Apoptosis)和DNA损伤(DNAdamage)等。图三聚类得出了光合作用(Photosynthesis)、旁效应(Bystandereffect)、紫外线照射(UVirradiation)、肺癌(Lungcancer)、蛋白质合成(Proteinsynthesis)、DNA损伤(DNAdamage)和转录组学(Transcriptomics)等研究热点。可视化图谱展现了现阶段辐射领域的蛋白质组学的研究方向和热点,为后续探索提供了思路和方向。
2.2 细胞蛋白质组学在辐射领域的研究Pluder[20]等用人内皮细胞系EA.hy926暴露于低剂量60Co γ射线(200 mGy),然后用2D-DIGE和MALDI-TOF/TOF-MS/MS进行分析,结果显示,低剂量辐射暴露后主要影响Ran和RhoA途径通路,Ran通路[21]参与核质运输、有丝分裂中期纺锤体的组装、分裂后期核膜的重建等生命活动,RhoA通路[22]是VEGF信号通路的下游信号通路,主要参与形成新的毛细血管;此外还会影响脂肪酸代谢和应激反应。采用同样的细胞系,Sriharshan等[23]则发现2.5 Gy的60Co γ射线急性照射后,第4和24 h糖酵解、氧化磷酸化、Rho介导的细胞运动和非同源末端连接等生物过程发生了重大改变:参与代谢活性(应激反应和细胞凋亡等)的蛋白质在4 h内发生变化,而与细胞信号转导和转录活性相对应的蛋白质在24 h后受到影响。
2.3 组织蛋白质组学在辐射领域的研究为了鉴定辐射影响的组织特异性标志物,Lim等[24]使用2-DE分析了1 Gy照射后不同小鼠组织(包括脑、肺、脾和肠)中蛋白质表达的变化,结果发现转醛缩酶1(TA1)和磷酸甘油酸激酶1(PGK1)这2种蛋白分别是脑和肠辐射的组织特异性蛋白标志物。Barjaktarovic等[25]使用X射线(0.2/2 Gy)局部照射小鼠心脏,其代谢图谱和功能分析证明小鼠心脏线粒体发生变化,其氧化磷酸化渐进性增强,并且对心脏的能量代谢产生了长期损害。Azimzadeh等[26]研究高剂量局部辐照(X射线,8/16 Gy)对小鼠心脏的影响,发现参与脂质代谢和氧化磷酸化的蛋白质发生了显著变化,后续的通路分析发现辐照对过氧化物酶体增殖物激活的受体α(PPARα,一种转录调节因子)有抑制作用,在能量代谢和线粒体呼吸链中起作用的PPARα目标蛋白的表达明显减少,该研究强调了PPARα作为电离辐射的新型靶标的可能性。Bowden等[27]对经过新辅助放化疗的直肠癌患者组织进行质谱分析,发现放射敏感患者的酸性神经酰胺酶(AC)表达低于放射不敏感患者,提示将AC作为一种新型的潜在生物标志物和治疗靶标。
2.4 其他蛋白质组学在辐射领域的研究不同的组织和器官在辐射后会出现蛋白质表达水平及其翻译后修饰状态的改变,因此,我们还可以运用生物体液(如尿液、血液、血清等)的蛋白质图谱寻找辐射相关的蛋白质生物标志物。Chaze[28]团队用γ射线(20、40、80 Gy)局部照射小鼠,发现14 d后血清蛋白质中IL-1β、IL-6、and TNF-α表达增加,其翻译后修饰比如蛋白质的糖基化状态亦发生改变。Byrum等[29]人使用60Co γ射线(6.7和7.4 Gy)全身照射非人类灵长类动物,分析照后12 h血浆,发现一组具有剂量依赖效应的蛋白质,另外发现10种血浆与尿液共同表达的蛋白质,比如血管紧张素原前蛋白、血清淀粉样蛋白A、C反应蛋白等[14]。Sun等[30]发现γ射线照射后大鼠血浆中α-2巨球蛋白(A2m)、嗜铬粒蛋白A(CHGA)、谷胱甘肽过氧化物酶3(GPX3)3种蛋白质有较好的剂量-效应曲线,有望作为辐射生物标志物。Kimi等[31]研究比较乳腺癌患者、头颈癌患者的血浆,发现血浆中血小板生成素蛋白(THPO)和基质相互作用分子(STIM1)蛋白质水平在放射敏感患者和不辐射患者中有显著差异,不论是乳腺癌还是头颈癌,辐射不敏感的患者体内THPO以及STIM1蛋白水平明显高于辐射敏感的患者,提示这2种蛋白可作为放射敏感性标志物的可能性。Yi等[32]在暴露于100和250 μGy/ h剂量率的小鼠外周血中鉴定出18种蛋白质,变化最显著的是上调的甘氨酸N-甲基转移酶(GNMT)、核磷脂(NPM)和下调的谷胱甘肽S-转移酶A3(GSTA3)。Jérôme等[33]发现腺苷酸激酶2蛋白(AK2)在乳腺纤维化患者的离体T淋巴细胞经过8 Gy的照射后表达显著上升,该蛋白与氧化应激相关,提示AK2作为放疗后晚期正常组织中放射毒性的生物标志物的可能性。
3 蛋白质组学在辐射剂量学领域的应用前景随着质谱技术的进步和生物信息学领域的同步飞跃,基于质谱的蛋白质组学在辐射领域的应用越来越广泛,其快速、高通量的特点可以帮助寻找敏感性或者特异性的生物标志物,用于辐射生物剂量计的相关研究。目前分子生物学方法如基因组学、蛋白质组学、代谢组学等[34]在辐射领域发挥着越来越重要的作用。本文总结了近年来基于质谱技术的蛋白质组学的发展及其在辐射领域的应用,显示了蛋白质组学在辐射领域应用前景的广阔性。但是蛋白质组学的动态范围大,对仪器和技术人员水平要求较高,造价也相对高昂,这无疑限制了其应用性。传统的分析方法无法解决蛋白质与小分子相互作用的问题(如代谢产物或者蛋白质的翻译后修饰),但化学家通过点击化学(Clickchemistry)[35]这种生物正交反应来最大限度弥补这一问题,使得我们可以用质谱法更深入、更精确地研究生物样本的生化状态及其对小分子的干扰。
新技术应用于辐射领域内有关辐射敏感性生物标志物的发现和验证是十分必须的,蛋白质组学运用于辐射敏感性生物标志物的筛选及探讨是未来辐射生物剂量计相关研究的一大趋势所在。文献报道,ORM2、HP、FDXR、BAX、DDB2、ACTN1、Flt3L、PTX3、AMY1A和MCP1等蛋白[36–39]有望作为人类辐射生物剂量测定的候选物,显示出蛋白质组学用于辐射敏感性生物标志物的筛选以及辐射生物剂量计应用的可能性。随着技术的发展,人们开始考虑组合的蛋白质生物标志物应用于辐照后的剂量估算的可行性,Sproull等[40]将不同蛋白质进行组合多元分析并使用线性判别分析来判定蛋白质预测照射剂量的准确性,发现小鼠全身照射后1 d,Flt3L的单一模型预测准确性为81%;照射后2 d,Flt3L+PTX3+FGB蛋白组合模型的剂量预测准确性达到100%;照射后3 d,Flt3L+PTX3蛋白组合模型的剂量预测准确性达到93.3%。这项研究表明辐射响应生物标志物蛋白的组合分析能有效预测辐射的暴露,比单一生物标志物蛋白的准确性更高,这无疑为蛋白质组学在辐射剂量领域打开了更广阔的前景。
| [1] |
Wasinger VC, Cordwell SJ, Cerpa-Poljak A, et al. Progress with gene-product mapping of the Mollicutes: Mycoplasma genitalium
[J]. Electrophoresis, 1995, 16(7): 1090-1094. DOI:10.1002/elps.11501601185 |
| [2] |
Tsiatsiani L, Heck AJ. Proteomics beyond trypsin[J]. Febs J, 2015, 282(14): 2612-2626. DOI:10.1111/febs.13287 |
| [3] |
ISSAQ H J, VEENSTRA T D. Proteomic and metabolomic approaches to biomarker discovery[M]. Acdemic Press, 2016. DOI: https://doi.org/10.1016/C2018-0-03967-5.
|
| [4] |
KARAS M, BACHMANN D, BAHR U, et al. Matrix-assisted ultraviolet laser desorption of non-volatile compounds[J/OL]. Int J Mass Spectrom,1987, 78: 53–68. http://www.sciencedirect.com/science/article/pii/0168117687870416. DOI: https://doi.org/10.1016/0168-1176(87)87041-6.
|
| [5] |
FENN J B, MANN M, MENG C K, et al. Electrospray ionization for mass spectrometry of large biomolecules[J/OL]. Science, 1989, 246(4926): 64–71. http://science.sciencemag.org/content/246/4926/64.abstract. DOI: 10.1126/science.2675315.
|
| [6] |
Jedinak A, Loughlin KR, Moses MA. Approaches to the discovery of non-invasive urinary biomarkers of prostate cancer[J]. Oncotarget, 2018, 9(65): 32534-32550. DOI:10.18632/oncotarget.25946 |
| [7] |
S M J. Better biomarkers for the diagnostics labyrinth[J]. Genome Technol, 2004, 15: 24-33. |
| [8] |
陈慧峰, 谭斯文, 闫雪华, 等. 不同剂量电离辐射对人外周血淋巴细胞DNA损伤修复相关基因转录水平的影响[J]. 中国辐射卫生, 2020, 29(1): 7-12. Chen HF, Tan SW, Yan XH, et al. Effects of different dose ionizing radiation on the transcriptional level of DNA damage repair related genes in human peripheral blood lymphocytes[J]. Chin J Radiol Heal, 2020, 29(1): 7-12. DOI:10.13491/j.issn.1004-714X.2020.01.002 |
| [9] |
侯殿俊, 马娅, 李洁清, 等. 电离辐射诱发人外周血miRNA-150表达水平的改变及意义[J]. 中国辐射卫生, 2019, 28(6): 606-608, 613. Hou DJ, Ma Y, Li JQ, et al. Ionizing radiation induced miRNA-150 changes in peripheral blood[J]. Chin J Radiol Heal, 2019, 28(6): 606-608, 613. DOI:10.13491/j.issn.1004-714x.2019.06.002 |
| [10] |
Yang J, Roy R, Jedinak A, et al. Mining the human proteome: biomarker discovery for human cancer and metastases[J]. Cancer J, 2015, 21(4): 327-336. DOI:10.1097/PPO.0000000000000139 |
| [11] |
Jerebtsova M, Nekhai S. Quantitative mass spectrometry of urinary biomarkers[J]. J Integr OMICS, 2014, 4(2): 69-78. DOI:10.5584/jiomics.v4i2.177 |
| [12] |
Schaff LR, Yan D, Thyparambil S, et al. Characterization of MGMT and EGFR protein expression in glioblastoma and association with survival[J]. J Neurooncol, 2020, 146(1): 163-170. DOI:10.1007/s11060-019-03358-x |
| [13] |
van Steenoven I, Noli B, Cocco C, et al. VGF peptides in cerebrospinal fluid of patients with dementia with lewy bodies[J]. Int J Mol Sci, 2019, 20(19). DOI:10.3390/ijms20194674 |
| [14] |
di Meo A, Batruch I, Brown MD, et al. Identification of prognostic biomarkers in the urinary peptidome of the small renal mass[J]. Am J Pathol, 2019, 189(12): 2366-2376. DOI:10.1016/j.ajpath.2019.08.015 |
| [15] |
何清, 李敏, 唐文诚, 等. 电离辐照损伤对小鼠脾脏组织核糖体信号通路的影响[J]. 中国药理学通报, 2019, 35(9): 1244-1250. He Q, Li M, Tang WC, et al. Effects of ionizing irradiation on ribosome signaling pathway in spleen tissues of mice[J]. Chin Pharmacol Bull, 2019, 35(9): 1244-1250. DOI:10.3969/j.issn.1001-1978.2019.09.012 |
| [16] |
罗芳芳, 李敏, 易辉燕, 等. 电离辐照损伤对小鼠睾丸组织氧化磷酸化信号通路的影响[J]. 中国药理学通报, 2019, 35(4): 483-488. Luo FF, Li M, Yi HY, et al. Effects of ionizing radiation injury on oxidative phosphorylation signaling pathway in testicular tissues of mice[J]. Chin Pharmacol Bull, 2019, 35(4): 483-488. DOI:10.3969/j.issn.1001-1978.2019.04.008 |
| [17] |
王治东, 陈肖华, 董波, 等. 急性放射损伤小鼠血清蛋白质组分析[J]. 辐射研究与辐射工艺学报, 2005, 23(1): 53-56. Wang ZD, Chen XH, Dong B, et al. Analysis of proteomic changes of the serum of irradiated mice[J]. J Radiat Res Radiat Process, 2005, 23(1): 53-56. DOI:10.3969/j.issn.1000-3436.2005.01.012 |
| [18] |
陈伟, 何颖, 沈先荣, 等. 低剂量辐射对小鼠血清蛋白差异表达的影响[J]. 辐射研究与辐射工艺学报, 2014, 32(1): 22-26. Chen W, He Y, Shen XR, et al. Effects of low dose radiation on differential expression of serum protein in mice[J]. J Radiat Res Radiat Process, 2014, 32(1): 22-26. DOI:CNKI:SUN:FYFG.0.2014-01-004 |
| [19] |
Chen C, Song M. Visualizing a field of research: a methodology of systematic scientometric reviews[J]. PLoS One, 2019, 14(10): e0223994. DOI:10.1371/journal.pone.0223994 |
| [20] |
Pluder F, Barjaktarovic Z, Azimzadeh O, et al. Low-dose irradiation causes rapid alterations to the proteome of the human endothelial cell line EA. hy926[J]. Radiat Environ Biophys, 2011, 50(1): 155-166. DOI:10.1007/s00411-010-0342-9 |
| [21] |
Lui K, Huang Y. RanGTPase: a key regulator of nucleocytoplasmic trafficking[J]. Mol Cell Pharmacol, 2009, 1(3): 148-156. DOI:10.4255/mcpharmacol.09.19 |
| [22] |
Boureux A, Vignal E, Faure S, et al. Evolution of the rho family of ras-like GTPases in eukaryotes[J]. Mol Biol Evol, 2007, 24(1): 203-216. DOI:10.1093/molbev/msl145 |
| [23] |
SRIHARSHAN A, BOLDT K, SARIOGLU H, et al. Proteomic analysis by SILAC and 2D-DIGE reveals radiation-induced endothelial response: Four key pathways[J/OL]. J Proteom, 2012, 75(8): 2319-2330. http://www.sciencedirect.com/science/article/pii/S1874391912000905. DOI: https://doi.org/10.1016/j.jprot.2012.02.009.
|
| [24] |
Lim YB, Pyun BJ, Lee HJ, et al. Proteomic identification of radiation response markers in mouse intestine and brain[J]. Proteomics, 2011, 11(7): 1254-1263. DOI:10.1002/pmic.201000332 |
| [25] |
Barjaktarovic Z, Anastasov N, Azimzadeh O, et al. Integrative proteomic and microRNA analysis of primary human coronary artery endothelial cells exposed to low-dose gamma radiation[J]. Radiat Environ Biophys, 2013, 52(1): 87-98. DOI:10.1007/s00411-012-0439-4 |
| [26] |
Azimzadeh O, Sievert W, Sarioglu H, et al. PPAR alpha: a novel radiation target in locally exposed Mus musculus heart revealed by quantitative proteomics
[J]. J Proteome Res, 2013, 12(6): 2700-2714. DOI:10.1021/pr400071g |
| [27] |
Bowden DL, Sutton PA, Wall MA, et al. Proteomic profiling of rectal cancer reveals acid ceramidase is implicated in radiation response[J]. J Proteom, 2018, 179: 53-60. DOI:10.1016/j.jprot.2018.02.030 |
| [28] |
Chaze T, Slomianny MC, Milliat F, et al. Alteration of the serum N-glycome of mice locally exposed to high doses of ionizing radiation[J]. Mol Cell Proteom, 2013, 12(2): 283-301. DOI:10.1074/mcp.M111.014639 |
| [29] |
Byrum SD, Burdine MS, Orr L, et al. Time-and radiation-dose dependent changes in the plasma proteome after total body irradiation of non-human Primates: Implications for biomarker selection[J]. PLoS One, 2017, 12(3): e0174771. DOI:10.1371/journal.pone.0174771 |
| [30] |
Sun JL, Li S, Lu X, et al. Identification of the differentially expressed protein biomarkers in rat blood plasma in response to gamma irradiation[J]. Int J Radiat Biol, 2020, 96(6): 748-758. DOI:10.1080/09553002.2020.1739775 |
| [31] |
Drobin K, Marczyk M, Halle M, et al. Molecular profiling for predictors of radiosensitivity in patients with breast or head-and-neck cancer[J]. Cancers, 2020, 12(3): 753. DOI:10.3390/cancers12030753 |
| [32] |
Yi L, Mu HX, Hu N, et al. Differential expression of NPM, GSTA3, and GNMT in mouse liver following long-term in vivo irradiation by means of uranium tailings
[J]. Biosci Rep, 2018, 38(5): BSR20180536. DOI:10.1042/BSR20180536 |
| [33] |
Lacombe J, Brengues M, Mangé A, et al. Quantitative proteomic analysis reveals AK2 as potential biomarker for late normal tissue radiotoxicity[J]. Radiat Oncol, 2019, 14(1): 142. DOI:10.1186/s13014-019-1351-8 |
| [34] |
蔡恬静, 刘青杰. 放射生物剂量学研究的新进展[J]. 国际放射医学核医学杂志, 2015(4): 316-323. Cai TJ, Liu QJ. Progress on the radiation biodosimetry study[J]. Int J Radiat Med Nucl Med, 2015(4): 316-323. DOI:10.3760/cma.j.issn.1673-4114.2015.04.010 |
| [35] |
Parker CG, Pratt MR. Click chemistry in proteomic investigations[J]. Cell, 2020, 180(4): 605-632. DOI:10.1016/j.cell.2020.01.025 |
| [36] |
Huang J, Wang Q, Hu Y, et al. Proteomic profiling for serum biomarkers in mice exposed to ionizing radiation[J]. Dose Response, 2019, 17(4): 1559325819894794. DOI:10.1177/1559325819894794 |
| [37] |
Lee Y, Pujol Canadell M, Shuryak I, et al. Candidate protein markers for radiation biodosimetry in the hematopoietically humanized mouse model[J]. Sci Rep, 2018, 8(1): 13557. DOI:10.1038/s41598-018-31740-8 |
| [38] |
Sproull M, Shankavaram U, Camphausen K. Comparison of proteomic biodosimetry biomarkers across five different murine strains[J]. Radiat Res, 2019, 192(6): 640-648. DOI:10.1667/RR15442.1 |
| [39] |
Wathen LK, Eder PS, Horwith G, et al. Using biodosimetry to enhance the public health response to a nuclear incident[J]. Int J Radiat Biol, 2020, 1-4. DOI:10.1080/09553002.2020.1820605 |
| [40] |
Sproull M, Kramp T, Tandle A, et al. Multivariate analysis of radiation responsive proteins to predict radiation exposure in total-body irradiation and partial-body irradiation models[J]. Radiat Res, 2017, 187(2): 251-258. DOI:10.1667/RR14558.1 |




