2. 山东省济宁市第一人民医院放射科
2. Department of Radiology, Jining No.1 People’s Hospital
舌是人体内较为重要的运动感觉器官,舌部病变常会使得颌面部功能残缺,严重者甚至可能危及生命,因此,及时发现病灶,明确病变性质,评价淋巴结转移情况等,对临床治疗和预后具有重要意义[1]。3.0 T磁共振成像具有多参数、多平面扫描且无创伤性等优点,可为临床提供有价值的信息。本研究回顾性分析65例舌鳞状细胞癌患者的磁共振影像资料,探讨3.0T磁共振在舌癌诊断中的应用价值。
1 材料与方法 1.1 临床资料收集2012年以来济宁市第一人民医院行3.0T磁共振检查并经手术病理确诊的舌鳞状细胞癌患者共65例,男性50例,女性15例;年龄36~87岁,平均年龄62.7岁,其中有淋巴结转移38例,无淋巴结转移27例。65例鳞状细胞癌中,高分化鳞癌35例,中分化鳞癌24例,低分化鳞癌6例。参照UICC及AJCC分期标准[2- 3]进行分期,T1期11例,T2期11例,T3期15例,T4期28例,将(T1期+T2期)22例列为早期组,(T3期+T4期)43例列为晚期组。
1.2 MRI检查方法采用Siemens Trio 3.0T超高场磁共振成像仪,所有患者均行常规MRI平扫及DWI扫描,55例患者行动态增强扫描,应用头颈部专用多通道线圈。扫描参数:T1WI(TR/TE:700 ms/24 ms),T2WI(TR/TE:3310 ms/35 ms),T2WI脂肪抑制序列(TR/TE:3500 ms/80 ms);SE-EPI序列(TR/TE:4250 ms/95 ms),扩散敏感因子b值为0 s/mm2及1000 s/mm2,视野(FOV)24 cm × 24 cm,层厚3 mm,激励次数1,共采集24个实相,无间歇扫描。对比剂使用钆喷酸葡胺,剂量0.1 mmol/kg,以2 mL/s的流率用高压注射器快速团注。行T1WI横轴位、冠状位及矢状位扫描。
1.3 图像分析及测量由三位从事头颈部影像诊断的放射科医师对图像进行独立分析,所得数据取平均值,分别测量并记录肿瘤的部位、长径、短径、厚度、与舌中线的关系、周围组织浸润和淋巴结转移情况。根据DWI数据自动生成表观扩散系数图,对肿瘤实质部分选择3个感兴趣区(region of interest, ROI),选择ROI参考T1WI增强图像,避开囊变坏死区,测量肿瘤的ADC值,取平均值;65例舌癌患者中有55例行动态增强扫描,将原始数据传至Siemens工作站,应用软件分析,获得时间-信号强度曲线,参考Kianmoto等[4]提出的颌面部肿瘤分型,将TIC分为Ⅰ型(速升平台型)、Ⅱ型(速升流出型)、Ⅲ型(上升型,无明确峰值出现,曲线持续上升)。
1.4 统计学方法采用SPSS20.0进行统计分析,ADC值用均数加减标准差(
65例舌鳞状细胞癌患者中局限于舌体左侧25例,局限于舌体右侧25例,发生于舌体且累及舌根5例,发生于舌体且累及舌尖6例,舌根部4例;65例中19例越过舌中线,38例患者发生颈部淋巴结转移,22例有周围组织侵犯,其中侵犯舌下腺11例,侵犯颌下腺3例,侵犯扁桃体2例,侵犯牙槽骨3例,侵犯口咽侧壁1例,侵犯口底2例。
2.2 肿瘤大小与淋巴结转移65例舌癌患者病变长径均值(28.2 ± 11.7)mm、短径均值(17.7 ± 9.4)mm、厚度均值(26.8 ± 11.9)mm。两组之间参数如下(表1和表2)。
|
|
表 1 转移组与无转移组各径线比较 Table 1 The diameters of the metastatic and non-metastatic group were compared(Unit:millimeter) |
|
|
表 2 转移组与无转移组跨中线生长情况 Table 2 Transmidline growth in the metastatic and non-metastatic groups(Unit:number) |
舌癌主要影像表现为发生于舌的不规则肿块,T1WI呈等或稍低信号,与周围组织有时难以区分,T2WI及T2WI抑脂序列常呈高信号,增强扫描肿瘤呈明显均匀或不均匀强化;病变向周围组织侵犯时,受累组织也可见强化,见图1和图2。本组65例舌癌患者中,35例T1WI序列呈等信号,30例呈稍低信号;T2WI序列均为高信号,其中33例信号不均匀;DWI均呈高信号,其中38例发生颈部淋巴结转移,转移组的肿瘤ADC均值为(0.990 ± 0.148) × 10−3 mm2/s,27例无淋巴结转移的肿瘤ADC值为(1.086 ± 0.114) × 10−3 mm2/s,两者差异有统计学意义(P=0.007)。55例行动态增强扫描的患者,增强扫描的病变区域信号明显高于周围正常组织,说明舌癌血供丰富。其中有26例均匀强化,27例不均匀强化,2例环形强化;TIC曲线Ⅰ型42例,Ⅱ型13例。

|
图 1 舌体右侧高分化鳞状细胞癌患者MRI图像 Figure 1 MRI images of a patient with highly differentiated squamous cell carcinoma of the right side of the tongue |
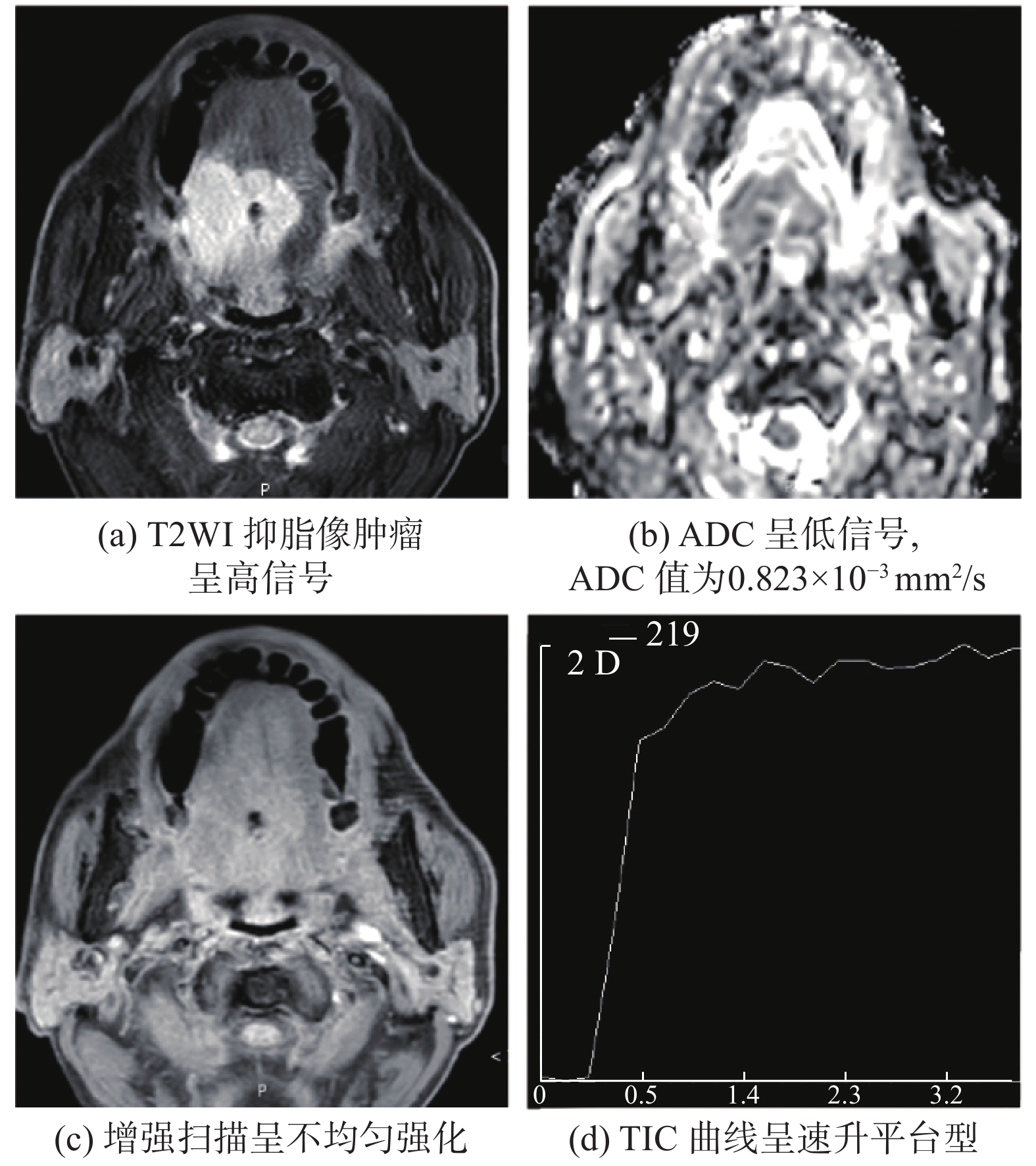
|
图 2 舌体-舌根部中分化鳞状细胞癌患者MRI图像 Figure 2 MRI images of a patient with differentiated squamous cell carcinoma of the tongue |
三位医师测得ADC值的ICC值为0.765,P < 0.001,说明可重复性良好。
65例鳞状细胞癌中,T1期11例,T2期11例,T3期15例,T4期28例,早期组(T1期+T2期)22例 ADC值为(1.090 ± 0.113) × 10−3 mm2/s,晚期组(T3期+T4期)43例ADC值为(1.001 ± 0.147) × 10−3 mm2/s,两者比较,差异有统计学意义(P=0.015)。
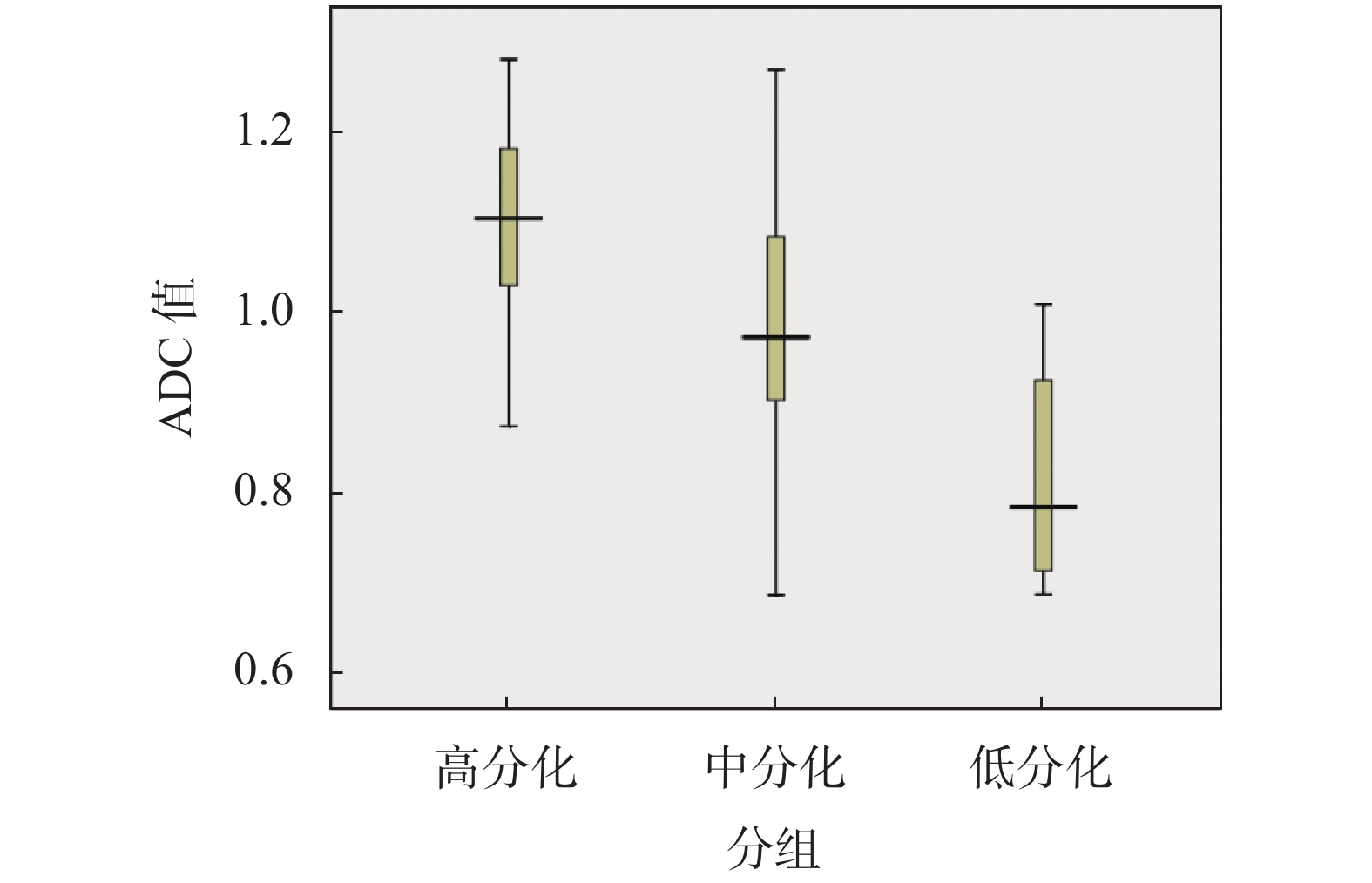
35例为高分化鳞癌,24例为中分化鳞癌,6例为低分鳞癌,三者ADC值分别为(1.101 ± 0.101) × 10−3 mm2/s、(0.992 ± 0.139) × 10−3 mm2/s、(0.819 ± 0.125) × 10−3 mm2/s,单因素方差分析(F=29.12,P < 0.05),组间差异有统计学意义,见 图3。
以ADC值为诊断指标进行ROC分析,低分化舌鳞癌的临界点为0.928 × 10−3 mm2/s,曲线下面积为0.907,其敏感度及特异度分别为81.4%和83.3%;高分化舌鳞癌的临界点为1.011 × 10−3 mm2/s,曲线下面积为0.784,其敏感度和特异度分别为85.7%和63.3%。
|
图 3 高分化、中分化及低分化舌鳞状细胞癌ADC值箱图 Figure 3 ADC value box of highly, moderately and poorly differentiated squamous cell carcinoma of tongue |
舌主要分为舌体部和舌根部,以倒“V”字型沟为分界,前2/3为舌体,后1/3为舌根。文献表明[5-6],大约3/4的舌癌好发于舌前2/3的舌体部,且舌中部1/3两侧缘为最常见,约占舌癌的70%,本组65例舌癌患者中有50例(76.92%)发生于舌体,与文献报道的比例接近。多数学者研究表明[7-8],舌癌淋巴结转移的风险随着肿瘤体积的增大而增加,以31.08 mm为长径阈值,预测淋巴结转移的特异度和敏感度分别为81.3%和83.3%;Okura[9]等认为,舌癌厚度大于9 mm,需选择性进行颈部淋巴结清扫。本研究中对65例舌癌的长、短径及厚度取最大截面分别测量,发现淋巴结转移组的各径线均较无淋巴结转移组大,差异有统计学意义;并且本研究测得转移组肿瘤长径均值为31.7 mm,厚度均值30.8 mm,与文献报道相符。当肿瘤体积较大时,常跨越中线。本研究结果显示,约84.2%跨中线生长的肿瘤发生淋巴结转移及周围组织侵犯,表明肿瘤一旦跨越中线生长,淋巴结转移及周围组织侵犯的风险也会随之增大(χ2=7.330,P=0.012),原因可能是舌中隔为致密胶原纤维组织,一旦被突破,则失去了对肿瘤的限制作用[10]。也有报道表明[11],发生于舌腹的肿瘤,可通过舌腹黏膜下向两侧侵犯,也较容易发生淋巴结转移,而发生于舌背者目前尚无明确定论,仍需进一步研究证实。
磁共振动态增强扫描可以通过TIC曲线反应病变组织内部血液灌注、微循环及血管通透性的情况。恶性肿瘤内部增殖速度快,血管分化程度高,血流灌注丰富,TIC早期即快速上升,在短时间达到峰值;良性病变组织内部血流灌注少,TIC缓慢上升,因此TIC分型对鉴别头颈部病变的良恶性具有一定的参考价值。李淑健等[12]认为,良性病变的TIC类型主要为缓慢上升型(79%),舌恶性肿瘤的TIC主要为速升平台型(91%),少数为缓升平台型,与良性病变TIC类型有一定重叠,可能是肿瘤内部存在较大范围的坏死,肿瘤内部血流灌注减少,导致达峰时间延长。本组研究中,舌鳞癌的TIC多呈速升平台型或速升流出型,与其研究结果一致。对于良性病变的TIC类型,仍需搜集大量相关病例进行研究。
手术治疗是舌癌的主要治疗方式,早期舌癌预后明显好于晚期舌癌。因此,术前影像诊断有助于确定病变范围,对制定治疗方案和预后评估具有重要意义。DWI可以从分子水平上早期检测组织内部病理生理学的改变,ADC值可以定量评估肿瘤内部组织的弥散受限情况。恶性肿瘤因细胞增殖异常旺盛,细胞密度高,核质比增加,细胞膜通透性减弱,使得水分子扩散受限,ADC值降低。Wang等[13]研究发现,良恶性病变ADC值存在较明显差异,头颈部良性病变的ADC值明显高于恶性病变。本组研究中,早期舌癌组的ADC值高于晚期舌癌组的ADC值,差异有统计学意义,说明舌癌的ADC值会随着病变的发展而降低,与多数学者研究一致。
近年来研究表明,恶性肿瘤的病理分级与ADC值存在一定规律,肿瘤的分化程度越低,其病变组织的ADC值就越低[14-16]。Kato H等[17]认为,头颈部高、中、低分化鳞状细胞癌ADC值逐渐减低,且低分化鳞癌与淋巴瘤相近,差异有统计学意义;牟东景等[18]发现,不同病理分级的宫颈鳞癌ADC值有统计学差异,以0.78 × 10−3 mm2/s诊断低分化宫颈鳞癌的敏感度和特异度分别为84.2%和86.3%。目前将ADC值用于预测舌鳞状细胞癌病理分级的研究少有报道,本组研究结果显示,高分化组、中分化组和低分化组ADC值呈逐渐减低的趋势,组间差异有统计学意义,以0.928 × 10−3 mm2/s为诊断低分化舌鳞癌的临界点,其敏感度及特异度分别为81.4%和83.3%;以1.011 × 10−3 mm2/s为诊断高分化舌鳞癌的临界点,敏感度和特异度则分别为85.7%和63.3%。当测得ADC值 < 0.928 × 10 −3 mm2/s时舌鳞癌病理分级为低分化可能性较大,提示患者预后可能较差;当ADC值 > 1.011 × 10 −3 mm2/s时,舌鳞癌为高分化可能性较大,提示患者可能预后良好。
本研究不足之处在于低分化舌鳞癌的病例数目较少;并且ADC值所测层面与病理切片并非一一对应,可能存在误差,所以用ADC值预测病理分级的临界值仍需大样本研究。
综上所述,磁共振多参数成像在对舌部肿瘤的诊断,分期、病理分级以及预测淋巴结转移等方面具有重要价值,对临床的治疗及预后评估提供了重要的参考信息。
| [1] |
Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012, 62(1): 10-29. DOI:10.3322/caac.20138 |
| [2] |
Sano D, Yabuki K, Arai Y, et al. The applicability of new TNM classification for humanpapilloma virus-related oropharyngeal cancer in the 8th edition of the AJCC/UICC TNM staging system in Japan: a single-centre study[J]. Auris Nasus Larynx, 2018, 45(3): 558-565. DOI:10.1016/j.anl.2017.07.010 |
| [3] |
Lydiatt W M, Patel S G, O'Sullivan B, et al. Head and Neck cancers-major changes in the American Joint Committee on cancer eighth edition cancer staging manual[J]. CA Cancer J Clin, 2017, 67(2): 122-137. DOI:10.3322/caac.21389 |
| [4] |
Kitamoto E, Chikui T, Kawano S, et al. The application of dynamic contrast-enhanced MRI and diffusion-weighted MRI in patients with maxillofacial tumors[J]. Acad Radiol, 2015, 22(2): 210-216. DOI:10.1016/j.acra.2014.08.016 |
| [5] |
Park J O, Jung S L, Joo Y H, et al. Diagnostic accuracy of magnetic resonance imaging (MRI) in the assessment of tumor invasion depth in oral/oropharyngeal cancer[J]. Oral Oncol, 2011, 47(5): 381-386. DOI:10.1016/j.oraloncology.2011.03.012 |
| [6] |
张永侠, 刘明波, 黄辉, 等. 124例舌根鳞状细胞癌临床总结及预后分析[J]. 临床耳鼻咽喉头颈外科杂志, 2017(24): 1867-1872. |
| [7] |
郭炜, 罗德红, 李琳, 等. 多参数MRI预测舌癌颈部淋巴结转移的价值[J]. 中华放射学杂志, 2016, 50(5): 353-356. DOI:10.3760/cma.j.issn.1005-1201.2016.05.008 |
| [8] |
Mücke T, Mitchell D A, Ritschl L M, et al. Influence of tumor volume on survival in patients with oral squamous cell carcinoma[J]. J Cancer Res Clin Oncol, 2015, 141(6): 1007-1011. DOI:10.1007/s00432-014-1881-2 |
| [9] |
Okura M, Iida S, Aikawa T, et al. Tumor thickness and paralingual distance of coronal MR imaging predicts cervical node metastases in oral tongue carcinoma[J]. AJNR Am J Neuroradiol, 2008, 29(1): 45-50. DOI:10.3174/ajnr.A0749 |
| [10] |
冉慕光, 王承光, 陈圣欢. 舌癌影像解剖特点及MRI征象分析[J]. 临床放射学杂志, 2016, 35(7): 1023-1026. |
| [11] |
刘夏诚, 谢文扬, 邓芳成, 等. 舌中隔对染色法定位舌引流淋巴结的影响[J]. 中国口腔颌面外科杂志, 2006, 4(1): 44-48. DOI:10.3969/j.issn.1672-3244.2006.01.011 |
| [12] |
李淑健, 程敬亮, 张勇, 等. DWI及动态增强MRI鉴别诊断舌良恶性病变[J]. 中国医学影像技术, 2014, 30(8): 1179-1182. |
| [13] |
Wang J, Takashima S, Takayama F, et al. Head and neck lesions: characterization with diffusion-weighted Echo-planar MR imaging
[J]. Radiology, 2001, 220(3): 621-630. DOI:10.1148/radiol.2202010063 |
| [14] |
Razek A A. Diffusion-weighted magnetic resonance imaging of head and neck[J]. J Comput Assist Tomogr, 2010, 34(6): 808-815. DOI:10.1097/RCT.0b013e3181f01796 |
| [15] |
徐慧慧, 冯长明, 霍英杰, 等. 大肠管状腺癌磁共振扩散加权成像ADC值与肿瘤分化程度的相关性[J]. 中国辐射卫生, 2018, 27(3): 285-288. |
| [16] |
石丽莉, 余红. 扩散加权成像在子宫内膜样腺癌侵犯肌层、宫颈中的应用研究[J]. 中国辐射卫生, 2015, 24(3): 301-302. |
| [17] |
Kato H, Kanematsu M, Tanaka O, et al. Head and neck squamous cell carcinoma: usefulness of diffusion-weighted MR imaging in the prediction of a neoadjuvant therapeutic effect[J]. Eur Radiol, 2009, 19(1): 103-109. DOI:10.1007/s00330-008-1108-5 |
| [18] |
牟东景, 樊斌. 3.0 T MR扩散加权成像评估宫颈鳞癌病理分级的应用价值[J]. 临床放射学杂志, 2018, 37(7): 1159-1162. |




