2. 山东第一医科大学附属肿瘤医院(山东省肿瘤防治研究院、山东省肿瘤医院)
2. Shandong Cancer Hospital and Institute, Shandong First Medical University & Shandong Academy of Medical Sciences
放射治疗(放疗)在脑肿瘤综合治疗中作用日趋重要,经放疗完全缓解的患者可获长期生存[1-2]。然而,放射性脑损伤已成为影响患者整体疗效及生活质量的主要障碍,放射性脑损伤的精确预测及早期诊断至关重要[3-4]。传统基于剂量—体积指标进行放射性脑损伤预测时,因未考虑放疗过程中脑组织随放射剂量的动态变化,往往存在预测精度不高、应用受限的困境。
从放射生物学分析,脑白质随着放射剂量累积必然会有一系列的生物学效应。然而,常规的宏观大体影像无法早期展现这种效应,对脑白质损伤的早期预测及动态追踪存在严重盲目性及滞后性。新兴的影像组学技术通过定量分析医学影像的深层信息,可以揭示肿瘤或正常组织在诊疗过程中的动态演变规律,在动态追踪放疗反应中应用潜力巨大[5]。因此,本研究应用影像组学的方法,研究脑白质MR影像组学特征在放疗前后的变化,分析影像组学特征变化与放射剂量累加的关系,旨在为脑白质放射性损伤的早期预测及动态监测提供参考方法。
1 材料与方法 1.1 病例资料选取2018年9月—2020年7月在山东省肿瘤医院接受放射治疗的脑肿瘤患者70例。其中接受全脑放疗患者28例,局部放疗患者42例;男性38例,女性32例,年龄9~79岁。肿瘤类型包括:脑胶质瘤术后放疗患者40例,脑淋巴瘤患者2例,脑转移瘤28例。
1.2 CT模拟定位所有患者均采用热塑膜固定体位,采用Philips Brilliance Big Bore CT(飞利浦公司、荷兰)进行定位扫描,获得模拟定位CT图像,扫描层厚3 mm,层间距3 mm。
1.3 MR模拟定位CT模拟定位完成后,采用相同体位及固定方式使用GE Discovery 750w 3.0T MR(通用电气公司,美国)进行扫描,获得模拟定位MR图像,MR定位序列为:(1)3D T1WI平扫(定义为T1平扫);(2)3D T1WI增强扫描(定义为 T1增强),增强扫描时造影剂注射速率2 ml/s,注射造影剂3 min后开始扫描,扫描层厚均为1 mm,层间隔均为0 mm。将T1增强与T1平扫进行剪影获得T1剪影,如图1所示。
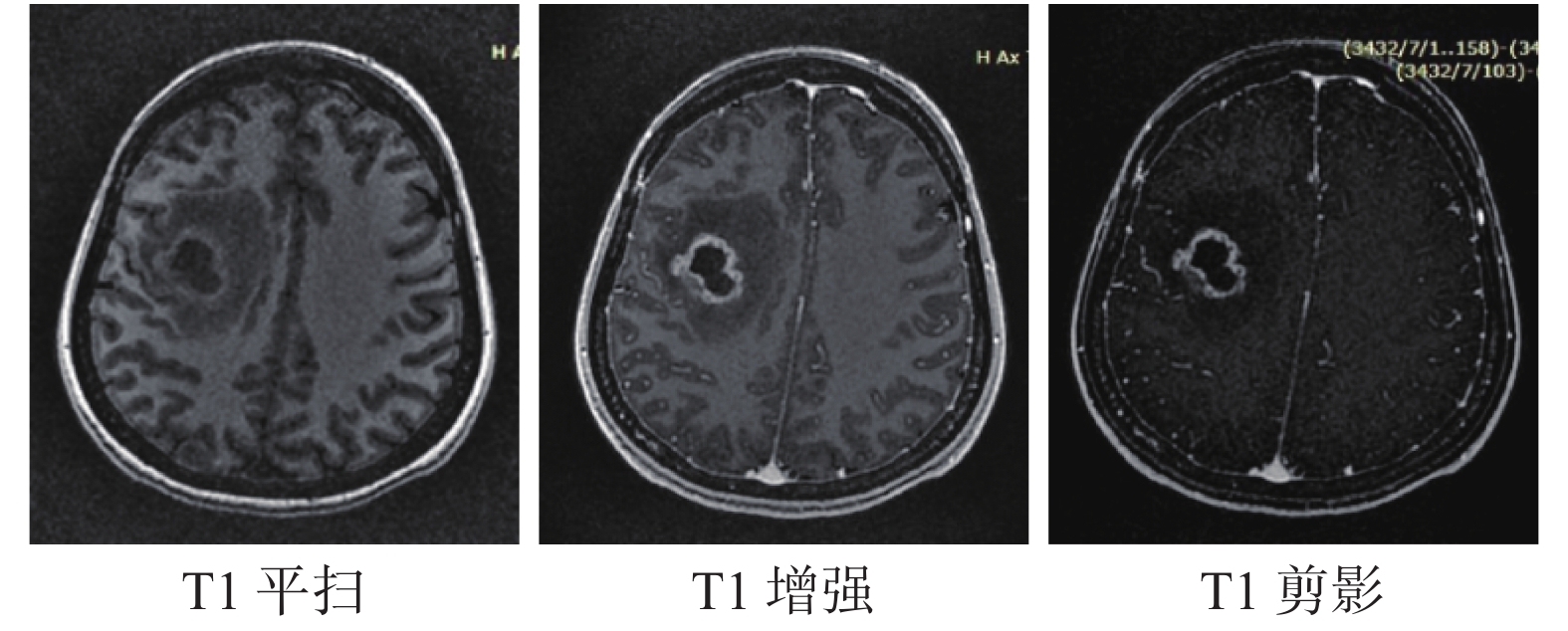
|
图 1 一例患者T1平扫、T1增强、T1剪影示意图 |
将模拟定位CT及MR图像传输至Varian Eclipse (version 15.5,美国)计划系统,由放疗医师在CT与MR的配准图像上勾画大体肿瘤靶区和危及器官,然后进行计划设计,局部放疗患者计划设计为多野的IMRT计划(处方剂量40~60 Gy),全脑放疗患者设计3D-CRT的两野对穿照射(处方剂量20~30 Gy)。
1.5 剂量梯度ROI的选择接受局部放疗的患者在放疗40~50 Gy后、接受全脑放疗的患者在放疗23~30 Gy后,再次获取MR图像。
在Varian Eclipse计划系统上,根据患者实际照射剂量,分别获得0~5 Gy、5~10 Gy、10~15 Gy、15~20 Gy、20~30 Gy、30~40 Gy及 > 40 Gy七个梯度的剂量线分布图。将不同梯度的剂量分布图及定位CT、MR图像导入MIM Maestro (version 6.8.8,美国)软件,在融合剂量线内,分别在 T1平扫、T1增强、T1剪影MR图像上勾画脑白质区域为感兴趣区域(regions of interest,ROI),为保证感兴趣区位置的一致性,所有序列MR图像都经过刚性配准处理,局部脑放疗患者单个ROI体积 ≥ 0.1 cm 3,全脑放疗患者单个ROI体积 ≥ 1 cm3。
1.6 影像组学特征提取应用3D Slicer软件(version 4.10.2,美国)在放疗前后的T1平扫、T1增强、T1剪影MR图像上对每个ROI进行影像组学特征提取,每个ROI获得六大类共93个特征,具体分布如下:灰度依赖矩阵类特征(GLDM,Gray-Level Dependence Matrix)14个,灰度共生矩阵类特征(GLCM,Gray-Level Co-occurrence Matrix)24个,一阶类特征(First-Order)18个,灰度游程矩阵类特征(GLRLM,Gray-Level Run-Length Matrix)16个,灰度区域矩阵类特征(GLSZM,Gray-Level Size Zone Matrix)16个,邻域灰度差矩阵类特征 (NGTDM,Neighboring Gray-Tone Difference Matrix)5个。
1.7 统计分析比较放疗前后不同剂量梯度下T1平扫、T1增强、T1剪影三个序列影像组学特征变化及其与放疗剂量的关系。采用IBM SPSS Statistics (version 20.0,美国)统计软件进行Wilcoxon秩和检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 T1平扫图像影像组学特征放疗前后对照分析在T1平扫图像中,0~5 Gy、5~10 Gy、10~15 Gy、15~20 Gy、20~30 Gy、30~40 Gy、> 40 Gy不同剂量梯度下,放疗前后差异有统计学意义的影像组学特征分别有52个、1个、0个、15个、1个、38个、32个,详见表1。
|
|
表 1 差异有统计学意义的特征数量 |
在这些差异有统计学意义的影像组学特征中,0~5 Gy、5~10 Gy、10~15 Gy、15~20 Gy、20~30 Gy、30~40 Gy、> 40 Gy不同剂量梯度下放疗前后最大变化率分别为164.06%、1.39%、无、35.76%、7.4%、156.45%、657.25%。变化率超过 ± 50%,且最显著的影像组学特征分别为GLCM-Cluster Prominence特征(0~5 Gy)、GLSZM-Large Area Low Gray Level Emphasis特征(30~40 Gy)、GLCM-Cluster Prominence特征(> 40 Gy),详见表2。
|
|
表 2 T1平扫图像影像组学特征变化率分析 |
在T1增强图像中,0~5 Gy、5~10 Gy、10~15 Gy、15~20 Gy、20~30 Gy、30~40 Gy、> 40 Gy不同剂量梯度下,放疗前后差异有统计学意义的影像组学特征分别有52个、1个、16个、8个、77个、64个、47个,较T1平扫图像略多,详见表3。
|
|
表 3 差异有统计学意义的特征数量 |
在这些差异有统计学意义的影像组学特征中,0~5 Gy、5~10 Gy、10~15 Gy、15~20 Gy、20~30 Gy、30~40 Gy、> 40 Gy不同剂量梯度下放疗前后最大变化率分别为126.88%、2.7%、198.7%、192.92%、128%、149.19%、531.96%。变化率超过 ± 50%,且最为显著的特征为:GLSZM-Large Area Low Gray Level Emphasis特征(0~5 Gy)、GLCM-Cluster Prominence特征 (10~15 Gy、15~20 Gy、20~30 Gy、30~40 Gy、> 40 Gy),详见表4。
|
|
表 4 T1增强图像影像组学特征变化率分析 |
其中,在不同剂量梯度下,具有高度重复的特征为FirstOrder-Variance、GLDM-Gray Level Variance、GLRLM-Gray Level Variance,如图2所示,三个特征随剂量梯度的变化规律基本类似,0~10 Gy呈下降趋势,10~30 Gy呈整体上升趋势,在30~40 Gy呈现下降趋势,而在 > 40 Gy则又呈巨幅上升趋势。
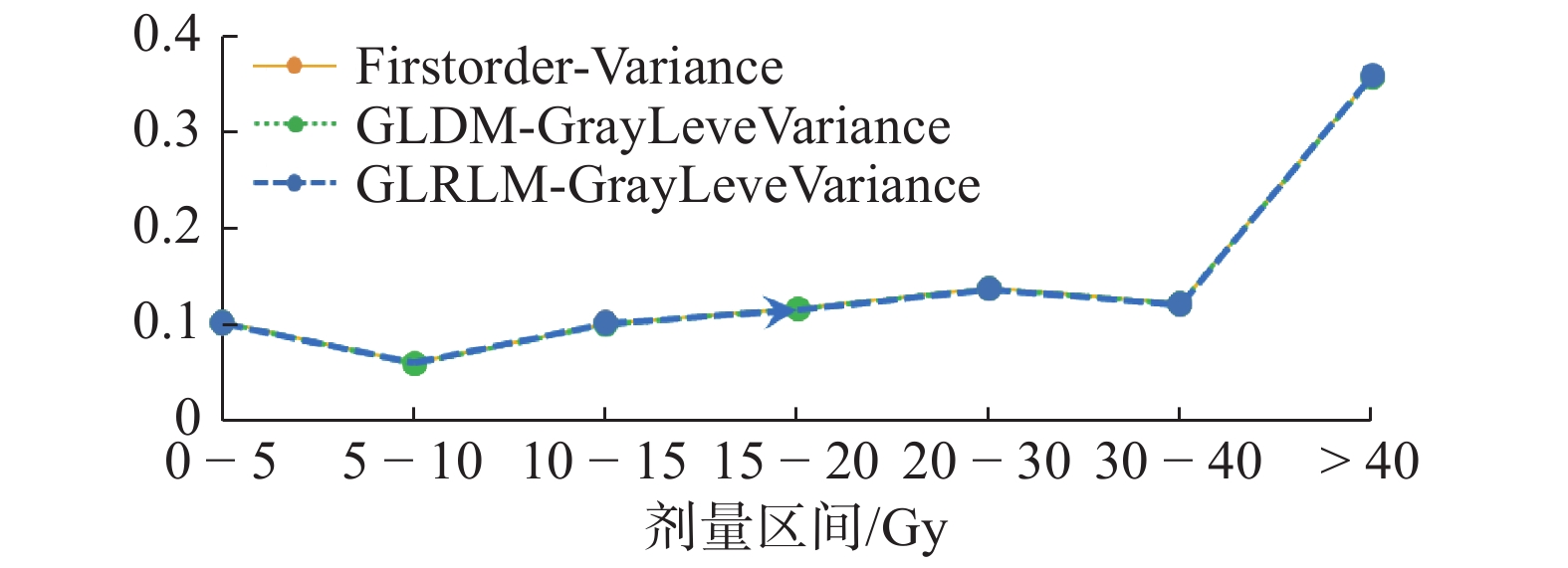
|
图 2 三个高度重复特征变化规律 |
在T1剪影中,0~5 Gy、5~10 Gy、10~15 Gy、15~20 Gy、20~30 Gy、30~40 Gy、> 40 Gy不同剂量梯度下,放疗前后差异有统计学意义的影像组学特征分别有7个、9个、28个、2个、25个、29个、6个,特征个数较T1平扫、T1增强显著减少,详见表5。
|
|
表 5 差异有统计学意义的特征数量 |
在这些差异有统计学意义的影像组学特征中,0~5 Gy、5~10 Gy、10~15 Gy、15~20 Gy、20~30 Gy、30~40 Gy、> 40 Gy不同剂量梯度下放疗前后最大变化率分别为−605.04%、−656.93%、739.06%、−325.36%、1919.53%、4967.44%、6081.3%,最大变化率均显著高于T1平扫及T1增强。变化率超过 ± 50%,且最显著的特征为GLSZM-Zone Entropy特征(0~5 Gy、5~10 Gy)、GLCM-Autocorrelation特征(10~15 Gy),GLSZM-Small Area Low Gray Level Emphasis特征(15~20 Gy)、NGTDM-Strength特征(20~30 Gy)、GLDM-Dependence NonUniformity Normalized特征(30~40 Gy)、FirstOrder-Root Mean Squared特征(> 40 Gy),详见表6。
|
|
表 6 T1剪影影像组学特征变化率分析 |
随着放疗在脑肿瘤综合治疗中的应用日渐增多,放射性脑损伤发生率亦有大幅度提高。急性放射性脑损伤通常发生在放疗开始后数天至数周内,早迟发反应常发生于放疗结束后1~6个月,晚迟发反应常出现在放疗结束6个月以后,且这些反应通常是不可逆的[6-7]。放射性脑损伤表现为疲劳、嗜睡、脑水肿导致的头痛恶心、记忆力减退、认知障碍等,严重影响患者的生活质量,早期发现及预测脑组织变化信息对预防和临床干预脑损伤意义重大[8]。
临床研究表明,脑白质损伤是放射性脑损伤最早且最主要的形式[9-10],脑组织中脑白质神经传导束密集,对放射线更加敏感[6],其造成的影响也更加广泛和持久。
在脑肿瘤放疗早期会导致脑内血管内皮细胞损伤、血管舒张、血脑屏障通透性增加等,亚急性反应则为少突胶质细胞消耗和短暂脱髓鞘的结果[11-12],而此时CT与MR影像学检查往往为阴性表现[13-14]。而影像组学技术可为脑白质的这种微观变化检测提供可行方法。影像组学将宏观的影像信息转为高维特征数据,通过对这些数据的定量分析来综合评价感兴区的异质性信息[15],其在脑组织变化早期检测中的意义重大。
本研究在T1平扫、T1增强及T1剪影三个序列MR影像组学特征分析中,在不同剂量梯度下放疗前后差异有统计学意义的特征最多可达77个;在0~5 Gy低剂量梯度下,T1平扫、T1增强差异具有统计学意义的特征均达到了52个,进一步证实了影像组学特征在揭示脑白质微观变化的能力,即使在低剂量照射情况下,也能发现脑组织的显著变化,有助于实现脑损伤的早发现及临床干预。
本研究发现T1平扫图像在不同剂量梯度下差异有统计学意义特征中,无高度重复特征,而T1增强图像在不同剂量梯度下差异有统计学意义特征中存在高度重复特征,即一阶纹理特征FirstOrder-Variance、二阶纹理特征GLDM-Gray Level Variance、GLRLM-Gray Level Variance三个特征,且随剂量增加的变化趋势基本一致,因此在应用MR影像预测或追踪脑白质变化时T1增强影像组学特征应作为首选。相对于T1平扫、T1增强图像,T1剪影影像组学特征变化率更加显著,部分特征变化率接近了2 000%、5000%以及6000%,因此在进行局部区域脑白质放射性损伤的预测时,T1剪影影像组学特征应作为首选。
本研究运用薄层(1 mm层厚、0 mm层间隔)磁共振容积扫描图像追踪脑白质影像组学特征变化,相较于传统厚层(5 mm层厚、2 mm层间隔)磁共振扫描,可有效避免由于部分容积效应造成的灰质-白质相互干扰现象的影响,提高准确性,能更好的反映脑白质随放射治疗的变化,影像组学进一步量化了脑白质在放疗过程中的变化。
本研究主要分析了脑白质放疗前后在不同剂量梯度下影像组学的特征变化,证实了脑白质影像组学特征变化与放射剂量的相关性。后期课题组拟通过随访,获取患者放射性脑损伤的发生情况,分析影像组学特征变化、放射剂量、放射性脑白质损伤三者之间的相关性,建立基于放射剂量、影像组学特征动态变化的放射性脑损伤预测模型,指导脑肿瘤个体化放疗计划的设计与剂量优化,减少和避免放射性脑损伤的发生。
综上所述,MR影像组学可以发现脑白质随放疗过程的微观变化,这为脑肿瘤放疗中的脑白质动态变化监测及放射性脑损伤早期预测提供可行的客观方法。
| [1] |
曹锦, 杨怡萍, 王冠. 脑转移瘤的放射治疗进展[J]. 现代肿瘤医学, 2020, 28(11): 1985-1989. DOI:10.3969/j.issn.1672-4992.2020.11.041 |
| [2] |
孟曼, 毕金玲, 黄勇. 脑转移瘤全脑放疗疗效与预后相关因素分析[J]. 中国辐射卫生, 2019, 28(4): 458-461. DOI:10.13491/j.issn.1004-714x.2019.04.030 |
| [3] |
马龙, 陈绍水. 放射性脑损伤发病机制及防治的研究与进展[J]. 中国医药科学, 2020, 10(2): 37-40. DOI:10.3969/j.issn.2095-0616.2020.02.010 |
| [4] |
Zhang B, Lian Z Y, Zhong L M, et al. Machine-learning based MRI radiomics models for early detection of radiation-induced brain injury in nasopharyngeal carcinoma[J]. BMC Cancer, 2020, 20(1): 502. DOI:10.1186/s12885-020-06957-4 |
| [5] |
Qiu Q T, Duan J H, Yin Y. Radiomics in radiotherapy: Applications and future challenges[J]. Prec Radiat Oncol, 2020, 4(1): 29-33. DOI:10.1002/pro6.1087 |
| [6] |
中国放射性脑损伤多学科协作组, 中国医师协会神经内科分会脑与脊髓损害专业委员会. 放射性脑损伤诊治中国专家共识[J]. 中华神经医学杂志, 2019, 18(6): 541-549. DOI:10.3760/cma.j.issn.1671-8925.2019.06.001 |
| [7] |
Martino A, Krainik A, Pasteris C, et al. Neurological imaging of brain damages after radiotherapy and/or chimiotherapy[J]. J De Neuroradiol, 2014, 41(1): 52-70. DOI:10.1016/j.neurad.2013.07.005 |
| [8] |
Rahman R, Alexander B M, Wen P Y. Neurologic complications of cranial radiation therapy and strategies to prevent or reduce radiation toxicity[J]. Curr Neurol Neurosci Rep, 2020, 20(8): 34. DOI:10.1007/s11910-020-01051-5 |
| [9] |
Rabinov J D, Brisman J L, Cole A J, et al. MRI changes in the rat Hippocampus following proton radiosurgery
[J]. Stereotact Funct Neurosurg, 2004, 82(4): 156-164. DOI:10.1159/000081639 |
| [10] |
Kennedy A S, Archambeau J O, Archambeau M H, et al. Magnetic resonance imaging as a monitor of changes in the irradiated rat brain. An aid in determining the time course of events in a histologic study[J]. Invest Radiol, 1995, 30(4): 214-220. DOI:10.1097/00004424-199504000-00003 |
| [11] |
Sourati A, Ameri A, Malekzadeh M. Acute side effects of radiation therapy[M]. Cham: Springer International Publishing, 2017.
|
| [12] |
张玮, 王利利, 周菊英, 等. 硫酸镁对放射性脑损伤大鼠C-fos基因表达及学习记忆功能的影响[J]. 中国辐射卫生, 2009, 18(3): 257-259. DOI:10.13491/j.cnki.issn.1004-714x.2009.03.056 |
| [13] |
Sanghvi D. Post-treatment imaging of high-grade gliomas[J]. Indian J Radiol Imaging, 2015, 25(2): 102-108. DOI:10.4103/0971-3026.155829 |
| [14] |
宋琼, 夏黎明, 王承缘, 等. 鼻咽癌放射治疗后放射性脑损伤急性反应早期的1H-MR波谱研究[J]. 中华放射学杂志, 2006, 40(6): 590-593. DOI:10.3760/j.issn:1005-1201.2006.06.007 |
| [15] |
王敏, 宋彬, 黄子星, 等. 大数据时代的精准影像医学: 放射组学[J]. 中国普外基础与临床杂志, 2016, 23(6): 752-755. DOI:10.7507/1007-9424.20160198 |




