2. 湖北省宜昌市第二人民医院肿瘤放射治疗科;
3. 四川大学华西医院肿瘤放射物理技术中心
2. Department of Radiation Oncology, The Second People's Hospital of Yichang;
3. Radiation Oncology Physics Technical Center, West Chian Hospital of Sichuan University
调强放射治疗作为食管癌放疗的主流技术[1],疗效好副反应轻,已成为食管癌患者放射治疗的首选。越是精确的剂量照射,对靶区和危及器官(organs at risk,OAR)勾画的准确性要求越高,否则有可能引起靶区的漏照射和OAR的过量照射[2]。调强放疗要求放疗医师严格准确定义靶区和危及器官,并逐层精准勾画,工作量大。更重要的是分次治疗过程中,摆位误差和患者形态的变化导致计划偏离时,需要重新进行计划设计,整个放疗过程中医师需要多次勾画靶区和危及器官。这是一项复杂又繁重的工作,而且手工勾画还会受到医生的临床经验等主观因素的影响[3]。同一勾画者在不同时间勾画的偏差,这也是影响放疗计划准确度的重要因素[4]。因此,越来越多的研究聚焦于肿瘤危及器官甚至靶区的自动勾画工作[5-6]。国内外研究发现自动勾画软件具有提高勾画效率,克服勾画者间误差的潜在优势,可适用于临床[7-8]。但这些自动勾画软件都是利用图像配准技术,基于图像解剖特征进行空间映射及转换来完成自动勾画。本研究拟应用连心智能放疗云系统,基于机器深度学习对食管癌OAR进行自动勾画测试,通过比较自动勾画与手工勾画的几何形态学和剂量学精度,来探讨其应用于临床的可行性。
1 资料与方法 1.1 病例选择随机选取2018年5月—2019年3月在黄冈市中心医院接受放疗的120例食管癌患者,经病理证实为食管癌,患者均签署知情同意书。所有患者定位均采用仰卧位,双上肢上举,胸上段食管癌患者以颈胸膜固定,胸中段患者以热塑性体膜固定,患者自由呼吸,采用美国GE公司的Lightspeed128排螺旋CT进行计算机断层成像,以5 mm的层厚及层间距行CT静脉团注造影剂增强扫描,扫描得到的CT图像数据通过DICOM网络传输至我科Pinnacle3 9.10计划系统医生工作站。随机抽选100例患者由1名有经验的高年资放疗医师手工勾画危及器官,OARs包括:左肺、右肺、心脏、脊髓、肝脏,并要求上级主任医师审核和修改。将勾画好的图像传入连心智能放疗云平台,建立参考图像数据库。其他20例患者CT图像传入AI,系统自动勾画危及器官作为目标图像。
1.2 连心人工智能放疗系统自动勾画流程对余下20例患者(未包含手工勾画OARs结构)CT图像分对照组和目标组,目标组经过连心放疗云平台自动勾画OARs完毕后,然后回传至放疗计划系统(飞利浦Pinnacle3 9.10),对照组为同一名资深放疗医师手工勾画OARs结构,然后将得到的两种不同结果进行对比。其自动勾画流程如下图 1所示:
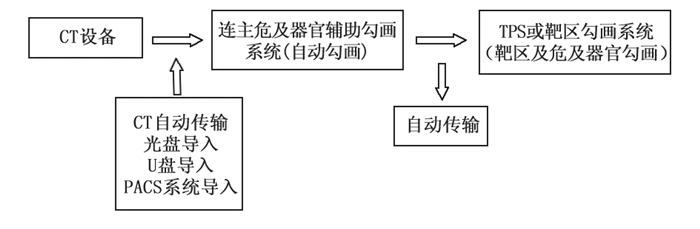
|
图 1 连心智能云平台自动勾画流程 |
对手工勾画OAR的CT图像行调强放射治疗计划设计,在飞利浦放疗计划系统Pinnacle3 9.10上完成,采用7野共面等中心布野,角度分别为320°,350°,10°,40°,180°,130°,210°,射线能量为6MV X线,采用DMPO优化方式,子野数目为45,最小子野面积7 cm2,最小子野调数10 MU。根据靶区处方剂量和危及器官限量要求,食管癌肿瘤区GTV总剂量60~66 Gy/30次,分次剂量为2.0~2.2 Gy/f;PTV要求54 Gy/30次,分次剂量为1.8 Gy/f,剂量覆盖95%的体积;危及器官限量要求:心脏V30 < 45%,V40 < 40%;脊髓Dmax < 45 Gy;左肺V5 < 60%,V20 < 30%;右肺V5 < 60%,V20 < 30%;肝脏Dmean < 20 Gy。
1.4 计划导入将上述在手工勾画OAR的CT图像上制定的计划定义为参考计划,将其导入至自动勾画OAR的CT图像上生成对照计划,得到相应的剂量分布,然后比较20例患者在两种不同勾画方式(手工勾画和自动勾画)下,得到的OAR的剂量学参数差异。
1.5 形态学及剂量学评估(1) 通过飞利浦Pinnacle3 9.10计划系统,以医生手工勾画危及器官的轮廓为“金标准”,评价自动勾画与手工勾画结果吻合程度。
(2) 体积差异(volume difference,ΔV)。为评估两者的差异,定义ΔV为自动勾画与手工勾画的体积差占手工勾画体积之比,正值表示自动勾画高估了目标OAR(过度勾画),负值表示自动勾画低估了目标OAR(勾画不足),其绝对值越接近0,表明自动勾画结果变化程度越小,越接近“金标准”[9-12]。ΔV计算为公式1:
| $\Delta V(\%)=\frac{V_{B}-V_{A}}{V_{A}} \times 100 \% $ | (1) |
(3) 重合度指标OR(overlap ratio)与形状相似性系数DSC(dice similarity coefficient)。使用OR和DSC评价自动勾画与手动勾画危及器官的重合性。OR其值位于0~1之间,越接近1表示自动勾画与手工勾画的重合性越好,反之则两种勾画方式危及器官轮廓差异越大。在图像重合度评估研究中,建议DSC>0.7为重合度较好的标准[10-12]。DSC计算为公式2,OR计算为公式3:
| $ D S C=\frac{2\left|V_{A} \cap V_{B}\right|}{\left|V_{A}\right|+\left|V_{B}\right|} $ | (2) |
| $ O R=\frac{V_{A} \cap V_{B}}{V_{A}} $ | (3) |
其中VA是手工勾画OAR的体积;VB是自动勾画OAR的体积;VA∩VB是自动勾画与手工勾画OAR重合的体积。
(4) 剂量学比较:通过CT断层层面剂量分布和剂量体积直方图(DVH)来评估OAR的受量,按照国际辐射单位和测量委员会(ICRU)83号报告[13]要求,对不同危及器官统计其参考剂量并与手工参考计划进行临床剂量学比对。
1.6 统计学处理采用SPSS 20.0软件对自动勾画与手工勾画相关数据,如勾画时间、器官体积差异、形态学指标OR和DSC分析统计,剂量学数据采用x±s形式表示,进行两两配对t检验,P < 0.05为差异有统计学意义。
2 结果 2.1通过对CT图像导入连心智能勾画平台自动勾画完成到导出到Pinnacle计划系统,总工作流程仅需2~3 min。自动勾画和手工勾画详细时间对比见表 1,可见自动勾画可以大大的节省医师勾画时间,提高工作效率。
|
|
表 1 自动勾画与手工勾画的OAR时间比较(s) |
自动勾画的OAR轮廓与医师手工勾画基本一致,重合度很高,但在某些层面上自动勾画仍存在不可忽视的偏差。CT断层显示某些气孔层面被当作肺部组织进行了自动勾画,肝脏边缘部分某些层面勾画不完整,对于这些层面,医生需要进一步修改才可应用于临床,具体如图 2所示。
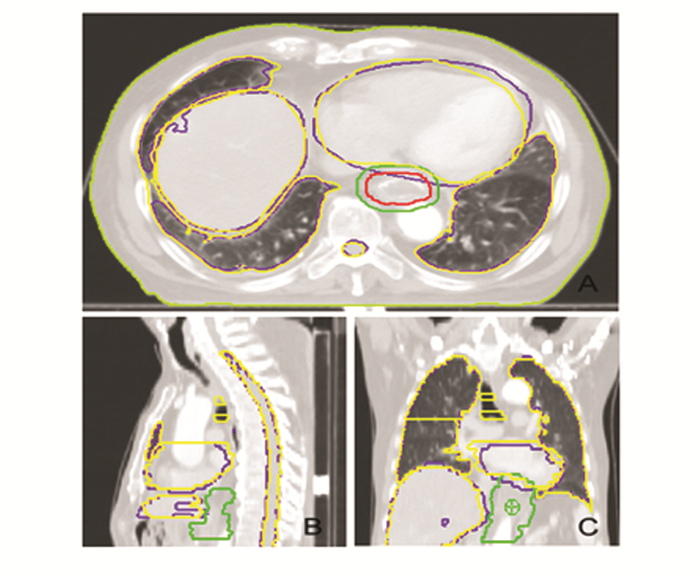
|
图 2 自动勾画的OAR结果CT图像示例 注:绿色为手工勾画,蓝色为自动勾画,红色为肿瘤靶区CTV。A.横截面;B.矢状位;C.冠状位 |
表 2为自动勾画与手工勾画的体积差异、DSC值、OR值对比情况,自动勾画心脏、肝脏、脊髓与手工勾画吻合度相当高,体积变化程度小,两者相比相似性系数平均值在0.9以上,重合度指数大于0.93;右肺的DSC平均值为0.78在观察的五种危及器官中最低,但大于0.7,重合性较好。说明自动勾画方式具有很高的稳定性,可以很好地还原不同体积大小危及器官的的手工勾画效果,直接运用于临床工作中。
|
|
表 2 自动勾画与手工勾画OAR体积差异(ΔV)、相似系数(DSC)和重合度指标(OR)对比(x±s) |
以手工勾画为参考标准,自动勾画与手工勾画危及器官剂量学对比中,左右肺Dmean、V20、V30,左肺V5,肝脏,心脏和脊髓的剂量学指标的差异均无统计学意义(P>0.05),说明自动勾画的剂量分布情况均接近手工勾画,自动勾画精度极高。右肺V5的剂量学指标的差异有统计学意义(P=0.04 < 0.05),说明右肺自动勾画过程中存在某些差异,直接运用于临床前需要人工返修。具体详见表图 3和表 3。

|
图 3 自动勾画与手工勾画的OAR的DVH |
|
|
表 3 自动勾画与手工勾画的OAR剂量分布比较(x±s) |
肿瘤靶区和危及器官的勾画蕴含了肿瘤放疗医师的学识,在体现技术含量的同时也包含了大量的重复工作[14]。我们将危及器官自动勾画智能化模型应用于临床,以期在保证准确勾画的前提下,有效减少勾画时间,提高医师工作效率。林金勇等[15]使用ABAS自动勾画软件应用于头颈部肿瘤调强放疗中的剂量学研究;谷珊珊等[16]使用MIM软件模板数据库的病例数对危及器官自动勾画进行了探讨。ABAS自动勾画软件基于形变配准的原理,使参考图像上的感兴趣器官轮廓与目标图像匹配从而完成自动勾画流程,自动勾画的精度与所勾画的组织结构体积大小有关[17];MIM软件对于不同解剖结构的自动分割能力相差悬虚:结构体积越小,分割结果越差[18]。ABAS软件和MIM软件都是基于图谱的人工智能勾画,线条扭曲严重,棱角分明,运用于临床工作中仍需大量修改。通过研究连心人工智能基于3D反卷积深度神经网络的智能勾画,在危及器官几何精度和剂量精度中的差异。我们发现:连心智能放疗云平台自动勾画精度基本可以达到手工勾画的要求,特别是对于小体积器官也有很高的勾画精度。
本研究中,我们将食管癌自动勾画与手工勾画的每个危及器官时间分别进行了统计和分析,自动勾画的每个器官时间均节省90%以上;手工勾画所有危及器官总时间在25 min以上,而自动勾画流程总时间仅需2~3 min,大大的提高了医师工作效率。自动勾画与手工勾画(金标准)的心脏、肝脏和脊髓形状相似相似性系数DSC值均大于0.9,左肺大于0.86,右肺大于0.78,均高于0.7的标准;两者的心脏、肝脏和脊髓重合度指标值OR均大于0.93,其中左肺OR大于0.89,右肺OR大于0.84,表明自动勾画和手工勾画有很好的重合性和一致性。但左肺跟右肺之间存在微量差异,仔细观察和分析CT勾画层面图像,由右肺某些断层处气管分叉部分和低密度影被自动勾画所致,这要求医师在自动勾画完毕后,需要对自动勾画进行检查,对不足之处进行手工修改。
原始放疗计划导至自动勾画危及器官的食管癌CT图像上,比较二者之间的剂量学分布差异发现:左右肺Dmean、V20、V30,左肺V5,心脏Dmean、D30、D40,肝脏Dmean、D20和脊髓Dmean、Dmax的剂量学指标的差异均无统计学意义(P>0.05),从DVH图像可以看出自动勾画与手工勾画心脏、肝脏和脊髓的剂量曲线几乎重叠,说明自动勾画的几何精度越高,最终所得计划越接近手工勾画计划。但值得注意的是,本研究中右肺V5的剂量学指标的差异有统计学意义(P=0.037 < 0.05),两者右肺剂量上的差异,说明自动勾画与手工勾画上存在某些不同。前面对右肺DSC值和OR指数的分析中发现,气管和支气管层面的误勾,引起右肺体积的增大,导致剂量评估曲线存在差异。说明器官密度和体积大小是影响自动勾画精度的重要因素,体积越大,密度越低,自动勾画效果越差。肺作为串行器官,在临床剂量评估过程中,剂量体积的大小作为临床评价放射性肺炎发生的重要依据,对于有差异的肺组织勾画必须精准,临床应用中需要手工返修方可使用。此处,我们建议对自动勾画情况进行检查返修。
综上所述,连心人工智能对于食管癌危及器官的自动勾画取得了良好的效果,能够得到满意的剂量分布,智能化提高了医师的勾画效率,为医师的发展提供了更多可能,在临床应用中具有广阔的前景。考虑到AI智能是基于大数据的深度学习后模仿,临床应用中仍然建议医师对自动勾画结果进行检查和对不足之处进行手工修改,以保证放疗计划剂量的准确,确保患者治疗的安全。
| [1] |
Huang Y C, Lu H I, Huang S C, et al. FDG PET using SUV max for preoperative T-staging of esophageal sauamous cell carcinoma with and without neoadjuvant chemoradiotherapy[J]. BMC medical imaging, 2017, 17(1): 1-8. |
| [2] |
Beltran M, Ramos M, Rovira J J, et al. Dose variations in Tumor volumes and organs at risk during IMRT for head-and-neck cancer[J]. J Appl Clin Med Phys, 2012, 13(6): 101-111. DOI:10.1120/jacmp.v13i6.3723 |
| [3] |
Geets X, Daisne J F, Arcangeli S, et al. Inter-observer variability in the delineation of pharyngo-laryngeal Tumor, parotid glands and cervical spinal cord:Comparison between CT-scan and MRI[J]. Radiother Oncol, 2005, 77(1): 25-31. |
| [4] |
La T H, Minn A Y, Su Z, et al. Multimodality treatment with intensity modulated radiation therapy for esophageal cancer[J]. Dis Esophagus, 2009, 23(4): 300-308. DOI:10.1111/j.1442-2050.2009.01004.x |
| [5] |
张秀春, 胡彩容, 陈传本, 等. 基于参考图像的ABAS软件自动勾画技术在头颈部肿瘤中的应用研究[J]. 中华放射肿瘤学杂志, 2011, 20(6): 510-512. DOI:10.3760/cma.j.issn.1004-4221.2011.06.018 |
| [6] |
阴晓娟, 胡彩容, 张秀春, 等. 基于图谱库的ABAS自动勾画软件在头颈部肿瘤中的可行性研究[J]. 中华放射肿瘤学杂志, 2016, 25(11): 1233-1237. DOI:10.3760/cma.j.issn.1004-4221.2016.11.019 |
| [7] |
Evans P M. Anatomical imaging for radiotherapy[J]. Phys Med Biol, 2008, 53(12): R151-R191. DOI:10.1088/0031-9155/53/12/R01 |
| [8] |
Li J C, Wang L H, Wang X L, et al. Preliminary study of the internal margin of the gross Tumor volume in thoracic esophageal cancer[J]. Cancer/Radiothérapie, 2012, 16(7): 595-600. DOI:10.1016/j.canrad.2012.05.020 |
| [9] |
Wang X, Lu J D, Xiong X P, et al. Anatomic and dosimetric changes during the treatment course of intensity-modulated radiotherapy for locally advanced nasopharyngeal carcinoma[J]. Med Dosim, 2010, 35(2): 151-157. DOI:10.1016/j.meddos.2009.06.007 |
| [10] |
Deeley M A, Chen A, Datteri R D, et al. Segmentation editing improves efficiency while reducing inter-expert variation and maintaining accuracy for normal brain tissues in the presence of space-occupying lesions[J]. Phys Med Biol, 2013, 58(12): 4071-4097. DOI:10.1088/0031-9155/58/12/4071 |
| [11] |
Nelms B E, Tomé W A, Robinson G, et al. Variations in the contouring of organs at risk:test case from a patient with oropharyngeal cancer[J]. Int J Radiat Oncol, 2012, 82(1): 368-378. DOI:10.1016/j.ijrobp.2010.10.019 |
| [12] |
Valentini V, Boldrini L, Damiani A, et al. Recommendations on how to establish evidence from auto-segmentation software in radiotherapy[J]. Radiother Oncol, 2014, 112(3): 317-320. DOI:10.1016/j.radonc.2014.09.014 |
| [13] |
Hodapp N. The ICRU Report 83:prescribing, recording and reporting photon-beam intensity-modulated radiation therapy (IMRT)[J]. Strahlenther Onkol, 2012, 188(1): 97-99. DOI:10.1007/s00066-011-0015-x |
| [14] |
沈天乐, 杜向慧. 人工智能在恶性肿瘤放疗领域中的应用与前景[J]. 浙江医学, 2018, 40(8): 783-785, 795. |
| [15] |
林金勇, 阴晓娟, 胡彩容, 等. ABAS自动勾画软件应用于头颈部肿瘤调强放疗中的剂量学研究[J]. 肿瘤学杂志, 2018, 24(6): 644-648. |
| [16] |
谷珊珊, 田娟秀, 王运来, 等. 基于MIM软件模版数据库的病例数对危及器官自动勾画的探讨[J]. 中国医学装备, 2018, 15(3): 1-4. DOI:10.3969/J.ISSN.1672-8270.2018.03.001 |
| [17] |
胡彩容, 林小艺, 阴晓娟, 等. 自动勾画软件在食管癌中的应用[J]. 中华放射医学与防护杂志, 2018, 38(9): 684-689. DOI:10.3760/cma.j.issn.0254-5098.2018.09.009 |
| [18] |
蒋璠, 吴昊, 张健, 等. 基于最优自动勾画的放疗计划剂量学评估[J]. 中华放射肿瘤学杂志, 2017, 26(4): 423-428. DOI:10.3760/cma.j.issn.1004-4221.2017.04.012 |




