随着科技的发展和对电离辐射应用的深入研究,放疗已经成为肿瘤患者治疗的重要手段,DNA是电离辐射重要的靶分子之一,电离辐射可引起DNA链断裂,放疗就是通过将能量直接沉积于肿瘤细胞DNA分子上,使其断裂,从而诱导细胞凋亡,达到治疗的目的。但在治疗的过程中也会对辐照部位周围的正常组织造成损伤,其中放射性脑坏死、神经认知功能障碍、颅神经及其他周围神经损伤等神经系统损伤最为常见,这严重影响了患者日后的生存质量[1]。非同源性内部连接通路(non-homologous end-joining, NHEJ)是DNA双链断裂修复的主要方式之一。X射线修复交叉互补基因(X ray repair cross complementing genes, XRCC)是DNA损伤修复过程中参与的一组重要的基因,其中XRCC4、XRCC5和XRCC6基因主要参与NHEJ通路DNA双链的修复过程,其表达量直接影响DNA双链的修复能力[2-4]。本实验通过实时荧光定量PCR技术检测不同剂量照射以及辐照后不同时间点XRCC4、XRCC5和XRCC6基因的相对表达量,探究其表达量的变化情况。
1 材料与方法 1.1 实验动物SPF级5~6周龄雄性SD大鼠, 中国人民解放军军事医学科学院实验动物中心提供,生产许可证号: SCXK-(军) 2012-0004,合格证号: 0035516;动物饲养管理于中国辐射防护研究院实验动物中心,使用许可证号: SYXK(晋) 2013-0002。
1.2 试剂及仪器柱式动物组织总RNA抽提纯化试剂盒(Sangon Biotech(Shanghai));PrimeScriptTM RT reagent Kit with gDNA Eraser(Takara Bio Inc);SYBR Premix Ex TaqⅡ(Takara Bio Inc)。LightCycler480型PCR仪(德国Roche Diagnostics Ltd)
1.3 辐照源山西大医院放疗科直线加速器, 型号Elekta Synergy,英国Elekta Limited生产,照射剂量率:3 Gy/min。
1.4 动物分组及照射SD大鼠经一周检疫后,按照体重随机分成对照组(0 Gy)、10 Gy、20 Gy和30 Gy照射组,30 Gy照射组根据不同时间点,依次为6 h、24 h、72 h、7天、30天,分为5个组。经10%的水合氯醛麻醉后摆位固定,利用6 MeV直线加速器对脑部进行照射, 剂量率为3 Gy/min,源距为1.0 m。
1.5 大鼠海马总RNA提取分别在照后6 h、24 h、72 h、7天、30天将大鼠麻醉后剖杀取海马,按照动物组织总RNA提取试剂盒说明书步骤要求,抽提海马样品中的总RNA,并取2μL在蛋白核酸测定仪检测其浓度与纯度,其余置于-80 ℃冻存备用。
1.6 mRNA表达水平的检测采用RT-PCR法检测XRCC4、XRCC5和XRCC6基因的表达水平,采用生工生物工程股份有限公司设计合成的引物(表 1),以管家基因(β-actin)作为内参,将四个组动物提取的总RNA逆转录成cDNA。以cDNA为模板,进行RT-PCR反应。
|
|
表 1 扩增基因的引物序列 |
逆转录反应条件为:将总RNA 10 μL和逆转录混合液10 μL混匀成20 μL的反应体系,放入PCR仪,经37℃反应15 min,85℃反应5s后终止反应,逆转录完成。PCR反应条件为:以2 μL cDNA为模板,混合液10 μL,上下游引物各0.8 μL,双蒸水6.4 μL混匀形成20 μL的反应体系进行PCR反应,经95℃,30 s预变性;95℃变性5 s;60℃退火和延伸20 s;40个循环,每个样品做三次重复。
1.7 样品归一化处理以β-actin为参比基因,对所有样品进行归一化处理,实验结果用LightCycler480版软件分析。采用“2-△△Ct”相对定量法计算大鼠海马XRCC4、XRCC5和XRCC6的相对表达量。
1.8 数据处理所有数据用SPSS 16.0统计分析软件进行分析,全部数据均以均数±标准差(means±SD)的形式表示,多组间均数比较采用单因素ANOVA方差分析。当P < 0.05认为有统计学差异。
2 结果 2.1 溶解曲线和扩增曲线目的基因XRCC4、XRCC5、XRCC6和β-actin的溶解曲线见图 1。溶解曲线显示,XRCC4、XRCC5、XRCC6基因为单一峰,表明基因扩增均为特异性扩增。图 2显示的为XRCC4、XRCC5、XRCC6和β-actin基因的扩增曲线。
|
图 1 XRCC4、XRCC5、XRCC6和β-actin实时荧光定量PCR的溶解曲线(温度-荧光信号值) |
|
图 2 XRCC4、XRCC5、和XRCC6的实时荧光定量PCR的扩增曲线 |
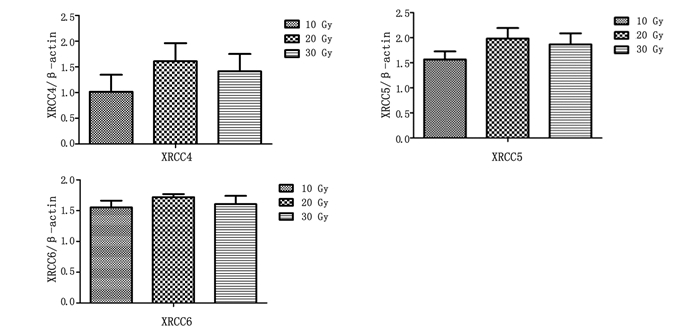
表 2和图 3所示为不同剂量组XRCC4、XRCC5、XRCC6基因实时荧光定量PCR定量比值结果,照射组中XRCC4、XRCC5、XRCC6基因与β-actin的Ct值所算出的相对表达量与对照组的表达量相比较, 以对照组的表达量作为1,处理组与对照组的比值大于1为上调,小于1为下调,从表 2和图 3中可以看出在照后一个月的三个剂量照射组中,XRCC4、XRCC5、XRCC6基因的表达都有所上调(定量比值>1),且20 Gy表达量略高于10 Gy和30 Gy,说明30天后仍在进行修复,但不同剂量之间无明显差异(P>0.05)。
|
|
表 2 XRCC4、XRCC5、XRCC6基因不同剂量实时荧光定量PCR定量比值 |
|
图 3 XRCC4、XRCC5、XRCC6基因不同剂量实时荧光定量PCR定量比值 |
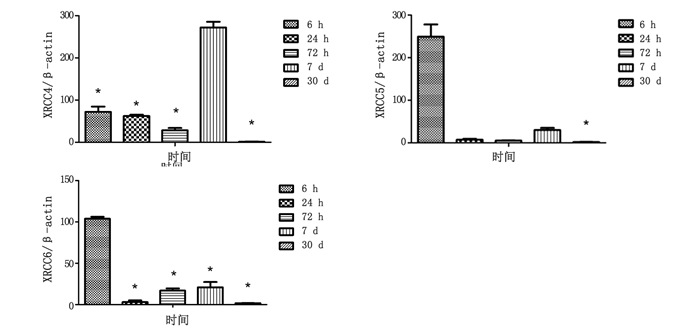
表 3和图 4所示为不同时间点XRCC4、XRCC5、XRCC6基因实时荧光定量PCR定量比值结果。从表 3和图 4中可以看出,30 Gy照射后6 h、24 h、72 h、7天、30天五个不同时间点XRCC4、XRCC5、XRCC6基因均上调表达。XRCC4基因在照后第7天表达量达到最高,与其余4个时间点基因表达量比较均有统计学差异(P<0.05);XRCC5和XRCC6基因在照后6 h表达量达到最高,其中XRCC5基因与照后6h表达量相比,照后30天表达差异具有统计学意义(P<0.05),XRCC6基因与照后6 h表达量相比,其余4个时间点表达差异均有统计学意义(P < 0.05)。
|
|
表 3 XRCC4、XRCC5、XRCC6基因不同时间点实时荧光定量PCR定量比值 |
|
图 4 XRCC4、XRCC5、XRCC6基因不同时间点实时荧光定量PCR定量比值 注:*XRCC4:与7 d相比P<0.05;XRCC5:与6 h相比P<0.05;XRCC6:与6 h相比P<0.05。 |
近年来随着医学影像技术的发展,电离辐射在医疗领域得到广泛的应用,在给人类诊断治疗疾病带来极大利益的同时,也带来了人们共同关注的辐射危害。目前放射诊疗活动在很多基层医疗机构不断增加,基于基层医疗机构的规模和医疗条件,其防护及管理方面呈现出很多问题[5-6]。射线照射后机体可产生自由基。氧自由基攻击细胞膜中生成的丙二醛(MDA), 其能够攻击生物膜,可引起细胞损伤,进一步造成DNA链断裂、染色体畸变、早衰和生命缩短等现象[7]。电离辐射所致DNA损伤主要包括DNA链断裂、DNA交联以及DNA二级、三级结构变化。而机体自身针对DNA损伤具有相应的自我修复机制,其中DNA双链断裂(DSB)主要通过同源重组与非同源末端连接(non-homologous end-joining,NHEJ)两条途径进行修复[8],其中通过NHEJ信号通路修复途径不要求DNA断裂末端的序列具有同源性[2, 6],可以直接连接两个断裂的末端[10],是DSB的主要修复途径。在DSBs发生后,NHEJ主要通过以下过程来进行DNA双链的修复工作:首先异源体KU识别DSB位点并与DNA残留末端连接来保护被核酸酶切断的游离的DNA位点,其中KU是由Ku80蛋白和Ku70蛋白组成,而Ku80蛋白和Ku70蛋白分别由XRCC5基因和XRCC6基因编码;之后,DNA-PKcs,XRCC4/LIG4,聚集并活化DNA依赖性蛋白激酶(DNA-PK);最后,两个断端可直接连接来修复断裂的DNA双链[3, 9, 11]。由此可见XRCC4、XRCC5、XRCC6基因作为NHEJ通路的关键基因,其表达水平的高低可以直接影响NHEJ信号通路的功能[12]。
本次研究针对电离辐射致脑损伤NHEJ通路中与DNA损伤修复有关基因表达变化情况,结果显示,在不同照射剂量中,20 Gy组XRCC4、XRCC5、XRCC6基因表达量最高,说明20 Gy达到了机体的最大修复能力,此结果与Li-Yuan ZHANG[9]的报道相一致。照射后不同时间点(照射后6 h、24 h、72 h、7天、30天)XRCC4、XRCC5、XRCC6基因表达变化情况的研究中,由于单次30 Gy全脑照射可以成功诱导大鼠的急性认知功能障碍[13],造成电离辐射脑损伤,故我们采用了30 Gy对大鼠头部进行照射,并对不同时间点XRCC4、XRCC5、XRCC6基因表达量进行检测,结果显示,XRCC5和XRCC6基因表达量在照后6h达最高,而XRCC4基因表达量在照后7天时达到最高,说明在照后6 h,经过大剂量照射发生大量的DNA双链断裂损伤,需要及时修复,XRCC5基因和XRCC6基因对DNA断裂位点进行识别,故此时XRCC5和XRCC6基因的表达量达到最高,随后在照射后第7天XRCC4参与聚集并活化DNA依赖性蛋白激酶(DNA-PK)对DNA双链进行修复,提示完成电离辐射致脑损伤急性损伤后断裂的DNA双链修复过程。
| [1] |
姜群群, 唐荣华. 放射治疗所致神经系统损伤[J]. 神经损伤与功能重建, 2014, 9(6): 522-525. DOI:10.3870/sjsscj.2014.06.021 |
| [2] |
邱宇凡, 胡蕴慧, 张瑾. DNA同源重组修复与乳腺癌的研究进展[J]. 中国药理学通报, 2016, 32(7): 910-914. DOI:10.3969/j.issn.1001-1978.2016.07.006 |
| [3] |
王芹, 岳井银, 李进, 等. γ射线照射后小鼠XRCC修复基因的mRNA表达[J]. 中国辐射卫生, 2006, 15(1): 1-2. DOI:10.3969/j.issn.1004-714X.2006.01.001 |
| [4] |
范雪娇, 任朋亮, 卢钟娇, 等. DNA损伤修复基因XRCC4、RAD51单核苷酸多态性与中国地区食管癌易感相关性研究[J]. 四川大学学报(医学版), 2013, 44(4): 568-572. |
| [5] |
曾运良, 江石丰, 程晋鹏, 等. 惠州市乡镇卫生院放射防护现状调查[J]. 中国辐射卫生, 2015, 24(4): 333-335. |
| [6] |
朱进平, 顾群, 杨斌, 等. 泰兴市医疗机构放射卫生管理现状分析与策略讨论[J]. 中国辐射卫生, 2015, 24(6): 591-593. |
| [7] |
毕良文, 段伟, 王晓莉, 等. 中药辐射防护剂的研究进展[J]. 中国辐射卫生, 2006, 15(1): 118-120. DOI:10.3969/j.issn.1004-714X.2006.01.071 |
| [8] |
周平坤. DNA修复—基因组稳定性护卫机制的原创与发现之旅[J]. 中国生物化学与分子生物学报, 2016, 32(1): 1-9. |
| [9] |
Zhang LY, Chen LS, Sun R, et al. Effects of expression level of DNA repair-related genes involved in the NHEJ pathway on radiation-induced cognitive impairment[J]. Journal of Radiation Research, 2013, 54: 235-242. DOI:10.1093/jrr/rrs095 |
| [10] |
孟荣荣, 应明真, 王雅杰. NHEJ途径修复DSB的研究进展[J]. 医学研究杂志, 2013, 42(1): 7-10. DOI:10.3969/j.issn.1673-548X.2013.01.004 |
| [11] |
Zhang ZH, Hu Wl. A single nucleotide polymorphism in XRCC4 gene is associated with reduced colorectal cancer susceptibility in female[J]. Journal of Medical Colleges of PLA, 2011, 86: 85-93. |
| [12] |
许义松, 周文静, 祁晓丽, 等. NHEJ信号通路关键基因mRNA表达与宫颈鳞癌同步放化疗敏感性的关系[J]. 西北大学学报, 2015, 45(5): 781-786. |
| [13] |
Ji SJ, Tian Y, Lu Y, et al. Irradiation-induced hippocampal neurogenesis impairment is associated with epigenetic regulation of bdnf gene transcription[J]. Brain Research, 2014, 577: 77-88. |




