铀及其化合物在核工业和军事上的用途非常广泛,铀内污染人体及对人体健康的潜在危害倍受世界各国所关注。铀化合物通过吸入、食入或伤口进入人体后,通常以稳定的6价铀酰离子(UO22+,U(Ⅵ))的形式存在于体液中,在血液中易与许多无机酸、有机酸及血浆蛋白结合[1],经血液循环运输到肾脏和骨骼等主要蓄积靶器官而产生毒性作用[2]。采用螯合剂药物加速体内铀的排出是其主要的治疗措施,但目前仍无有效的药物应用于临床,因此寻求高效低毒的铀促排螯合剂一直是研究者们不懈努力的目标。
金属硫蛋白(MT)是人体富含半胱氨酸的低分子量的金属结合蛋白,它在重金属解毒及微量元素代谢中发挥重要作用[3-5]。有研究报道,预防性给予ZnSO4诱导大鼠内源性MT高表达,能明显促进尿贫铀(DU)排出及降低肾DU蓄积,对DU致肾损伤有较好的保护作用[6-7],表明MT能通过与U(Ⅵ)结合形成无毒或低毒的U(Ⅵ)-MT螯合物经尿排出体外而发挥机体的自我保护作用。但是亦有研究发现,血液循环中的U(Ⅵ)与金属转运蛋白复合物包括U(Ⅵ)-MT复合物经肾小球滤过后大部分被肾近曲小管上皮细胞重吸收,在溶酶体中解离形成磷酸铀晶体,随着该晶体的生长导致溶酶体破坏,释放出游离U(Ⅵ)导致细胞损伤[8]。由此表明内源性MT对机体的保护作用是有限的,必须给予促排药物才能达到更为有效的治疗效果,而螯合剂与MT竞争螯合U(Ⅵ)的作用是影响螯合剂排铀效果的关键因素之一。故本研究拟建立竞争ELISA法以检测螯合剂与MT竞争结合U(Ⅵ)的能力,与本课题组前期进行的螯合剂对细胞和动物铀促排的实验结果相比较以验证其可行性;本研究还同时检测了螯合剂对MT与Zn2+结合的影响以初步探讨其毒性,为今后研发高效低毒的铀促排螯合剂提供简便、快速和高通量的筛选方法。
1 材料与方法 1.1 主要试剂与仪器金属硫蛋白(兔肝MT1/2) (台湾一春实业有限公司);MT抗体(美国Abcam公司);辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG (江苏省碧云天生物技术研究所);硫酸锌(分析纯)(国药集团化学试剂有限公司);醋酸铀酰(UO2(CH3COO)2·2H2O)(美国Chem-Impex公司),用去离子水配制成40 mmol/L的母液,再稀释成不同浓度的工作液。Infinite M200 pro型多功能酶标仪(瑞士TECAN公司);GHP-9160型隔水式恒温培养箱(上海一恒科技有限公司)。
1.2 螯合剂CBMIDA-CaNa2由复旦大学化学系合成,化学名为邻苯二酚-3, 6-二甲撑亚氨基四乙酸二钠钙,分子量482,为深棕色粉末,临用前用无菌去离子水配制成80 mmol/L的浓度;BPCBG由本研究所合成,化学名N, N′-1, 2-亚乙基双[N-(2, 3-二羟基苯甲基)]甘氨酸,分子量420,为淡黄色粉末,临用前用8%碳酸氢钠与之反应配制成40 mmol/L的钠盐溶液;DTPA-CaNa3采用25%的水针剂(上海复旦复华药业有限公司配制)。
1.3 实验方法 1.3.1 ELISA间接法检测系统条件的确定根据文献报道[9]的方法,采用不同浓度(0.2、0.4、0.6、0.8、1、2、3、4 μg/mL)的MT抗原包被96孔酶标板,与1 μg/mLMT抗体特异结合,以及采用不同浓度(0.015 625、0.031 25、0.062 5、0.125、0.25、0.5、1、2、4、8 μg/mL)的MT抗体与2 μg/mL MT抗原包被的酶标板进行免疫反应,以确定本实验体系包被MT抗原和MT抗体的最佳工作浓度,实验步骤如下:①用包被缓冲液(0.1 mol/L碳酸盐缓冲液,pH 9.6)溶解MT,并稀释成一定的质量浓度,加入96孔酶标板中,每孔100 μL,同时设置空白对照孔,周围孔用水封闭防止干燥,4℃,包被过夜,使MT附着于孔板上。②用PBST(含0.05% Tween 20的磷酸缓冲液)清洗3次,每次5 min,洗去多余的MT;用含1%牛血清白蛋白的磷酸缓冲液作为封闭液,每孔加入200 μL,4℃封闭过夜。③封闭结束后,弃液,于吸水纸上拍干,每孔加入100 μL的MT抗体IgG(一抗),37℃孵育3 h,使MT抗体与孔板上的MT进行特异结合。④一抗孵育结束后,用PBST清洗3次,每次5 min,洗去多余一抗;之后每孔加入100 μL 1:2 000稀释的HRP标记的羊抗鼠IgG二抗,37℃,孵育1 h。⑤二抗孵育结束后,用PBST清洗3次,每次5 min,洗去多余的二抗;之后每孔加入100 μL新鲜配制的OPD底物溶液(0.4 mg/mL的柠檬酸-磷酸缓冲液,pH 5.5),室温避光显色15 min后,每孔加入50 μL 2 mol/L H2SO4溶液终止反应。于酶标仪490 nm波长处读取吸光度值A490。
1.3.2 U(Ⅵ)、Zn2+与MT抗体对MT的竞争结合实验采用1.3.1确定的包被MT抗原和MT抗体的最佳工作浓度进行本实验。根据1.3.1的实验步骤,于封闭结束后,分别加入10、75、150、300和600 μmol/L的U(Ⅵ)溶液和Zn2+溶液,每孔50 μL,同时设置空白对照孔;上述所有孔中另加50 μL 2 μg/mL MT抗体,37℃孵育3 h。一抗孵育结束后,按1.3.1中后续步骤进行,以确定本实验体系中最佳的U(Ⅵ)溶液浓度和Zn2+溶液浓度。
1.3.3竞争ELISA法检测螯合剂与MT竞争结合U(Ⅵ)和Zn2+的能力根据1.3.1的实验步骤及其1.3.2确定的实验条件,采用2 μg/mL MT抗原包被、1%牛血清白蛋白封闭和300 μmol/L的U(Ⅵ)溶液或Zn2+溶液孵育、清洗后,分别加入100 μL不同浓度的CBMIDA-CaNa2、BPCBG或DTPA-CaNa3,37 ℃孵育3 h;孵育完毕后弃上清,PBS清洗后,每孔加入100 μL、2 μg/mL MT抗体IgG,按1.3.1中后续步骤进行。
1.4统计分析实验数据以均数±标准差表示,各实验至少重复3次。采用SPSS 11.5统计软件进行单因素方差分析。P<0.05为差异有统计学意义。
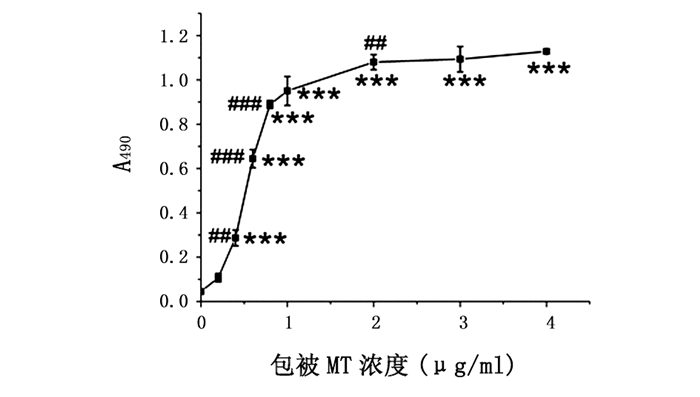
2 结果 2.1 MT抗原最佳包被浓度的确定由图 1可见,随着包被抗原MT浓度的增加,吸光度值明显增加(P<0.001),表现为当MT浓度在0.2~0.8 μg/mL范围内时,吸光度值快速增大;在0.8~2 μg/mL浓度区间内,吸光度值增加放缓;在2~4 μg/mL浓度范围内,吸光度值达坪台期;其中MT浓度为2 μg/mL时吸光度值基本达到峰值,故采用这一浓度作为本实验的最佳包被MT质量浓度。
|
图 1 包被抗原MT质量浓度与吸光度值的关系 注:MT抗体浓度为1 μg/mL;与0 μg/mL MT组相比较,*** P<0.001;与相邻低浓度的MT组相比较,## P<0.01,### P<0.001。 |
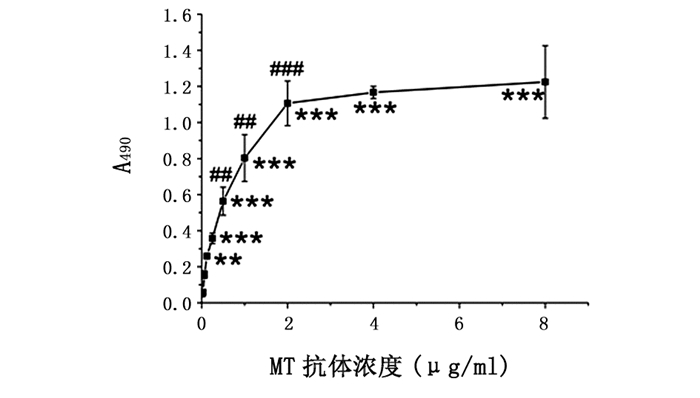
由图 2可见,随着MT抗体浓度的增加,吸光度值明显增加(P<0.001~0.01),表现为当MT抗体浓度在0.062 5~2 μg/mL时,吸光度值随MT抗体浓度增加而快速上升,于2 μg/mL时达到峰值;在2~8 μg/mL浓度范围内,吸光度值达坪台期。由于MT抗体浓度在2 μg/mL时实验所得吸光度值基本达峰值,故选择2 μg/mL为本检测体系的最佳MT抗体浓度。
|
图 2 MT抗体质量浓度与吸光度值的关系 注:包被抗原MT质量浓度为2 μg/mL;与0 μg/mL MT抗体组相比较,** P<0.01,*** P<0.001;与相邻低浓度的MT抗体组相比较,## P<0.01,### P<0.001。 |
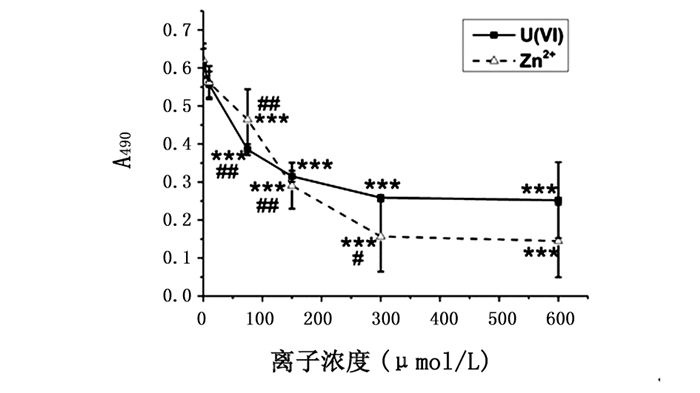
由图 3可见,不论是U(Ⅵ)还是Zn2+,随着其离子浓度的增加,该反应体系的吸光度值明显降低(P<0.001~0.05)。表明U(Ⅵ)、Zn2+与MT的结合阻碍MT抗体与MT的结合,以致反应体系的吸光度值降低,而且U(Ⅵ)、Zn2+浓度越高,与MT结合的U(Ⅵ)、Zn2+越多,吸光度值下降的幅度越大;当离子浓度增大到一定程度后,U(Ⅵ)、Zn2+对MT抗体与MT结合的影响减弱。当U(Ⅵ)和Zn2+浓度为300 μmol/L时,反应体系的吸光度值分别显著降低了约58%(P<0.001)和77%(P<0.001),故选取300 μmol/L为本实验体系的U(Ⅵ)和Zn2+浓度。
|
图 3 U(Ⅵ)和Zn2+与MT抗体对MT的竞争结合作用 注:与0 μmol/L U(Ⅵ)或Zn2+组相比较,*** P<0.001;与同一体系相邻低浓度的U(Ⅵ)或Zn2+组相比较,# P<0.05,##P<0.01。 |
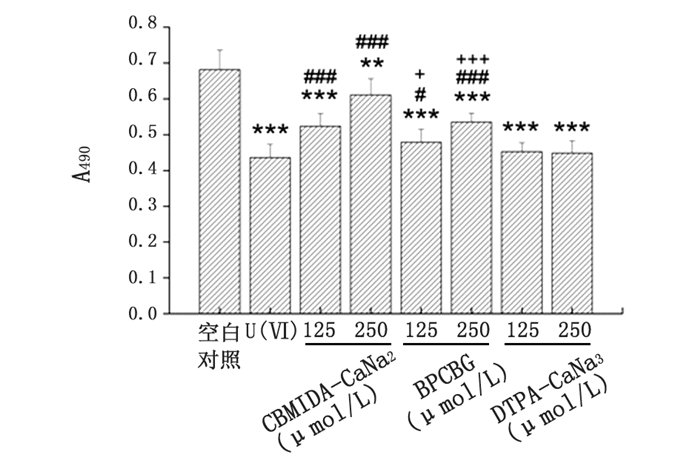
由图 4可见,该体系经300 μmol/L U(Ⅵ)作用后其吸光度值显著降低(P<0.001)。在U(Ⅵ)预处理后分别给予125 μmol/L和250 μmol/L的CBMIDA-CaNa2和BPCBG作用后,反应体系的吸光度值均较U(Ⅵ)单独处理组明显增加,其中2个不同浓度的CBMIDA-CaNa2作用后,使吸光度值分别明显提高了约25%和50%(P<0.001和P<0.001);2个不同浓度的BPCBG作用后,使吸光度值分别明显提高了约11%和24%(P<0.05和P<0.001);进一步比较相同浓度下两种螯合剂的作用可以看到,CBMIDA-CaNa2增加吸光度值的作用明显高于BPCBG的作用(P<0.05和P<0.001);然而,125 μmol/L和250 μmol/L的DTPA-CaNa3作用后未能使吸光度值较U(Ⅵ)单独处理组明显增加。以上结果表明CBMIDA-CaNa2和BPCBG能竞争结合与MT结合的U(Ⅵ),其中CBMIDA-CaNa2的作用强于BPCBG,而DTPA-CaNa3未能竞争结合与MT结合的U(Ⅵ),其结合U(Ⅵ)的能力小于或等于MT。
|
图 4 螯合剂与MT竞争结合U(Ⅵ)能力的比较 注:与空白对照组相比较,**P<0.01,*** P<0.001;与U(Ⅵ)处理组相比较,# P<0.05,### P<0.001;与相同浓度的CBMIDA-CaNa2组相比较,+P<0.05,+++P<0.001。 |
由图 5可见,该体系经Zn2+作用后其吸光度值显著降低(P<0.001);于Zn2+预处理后分别给予125 μmol/L和250 μmol/L的CBMIDA-CaNa2、BPCBG和DTPA-CaNa3作用后,反应体系的吸光度值均较Zn2+单独处理组均未见明显增加,表明它们对MT与Zn2+的结合均无明显影响。
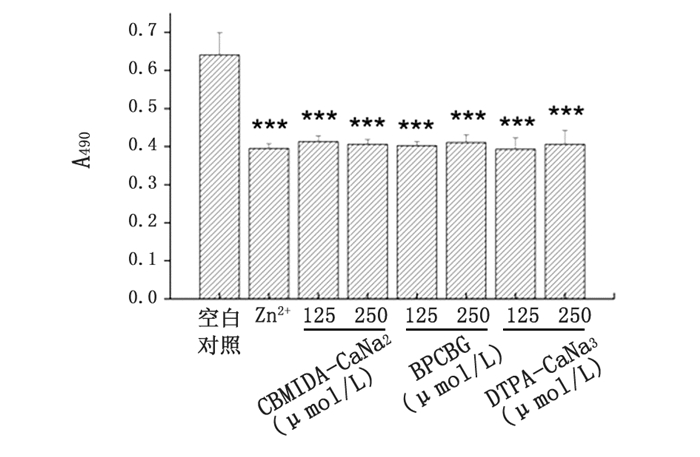
|
图 5 螯合剂与MT竞争结合Zn2+能力的比较 注:与空白对照组相比较,*** P<0.001。 |
本研究建立的螯合剂与MT竞争结合U(Ⅵ)和Zn2+作用的体外检测方法,是在文献报道[9]竞争ELISA法的原理上改进而来的,与该文献探讨Cd2+、Zn2+等金属离子与MT抗体对MT的竞争结合作用的目的完全不同。本实验体系的原理是:U(Ⅵ)或Zn2+先与包被在96孔酶标板中的MT结合,使吸光度值显著降低;再加入螯合剂与MT竞争结合MT上的U(Ⅵ)或Zn2+,当螯合剂从MT上竞争结合U(Ⅵ)或Zn2+越多时,吸光度值回升则越高;反之,当螯合剂与U(Ⅵ)、Zn2+的结合能力小于或等于MT与U(Ⅵ)、Zn2+的结合能力时,吸光度值则无明显变化。与文献报道[9]的Cd2+、Zn2+的作用相近似,U(Ⅵ)亦可使反应体系的吸光度值随其浓度增加而降低,可能与U(Ⅵ)与MT结合后引起MT构型改变而阻碍了MT抗体与MT免疫位点的结合有关,亦表明U(Ⅵ)与MT抗体对MT结合存在着竞争作用,这就为采用该方法检测螯合剂与MT竞争结合U(Ⅵ)的能力提供了可行性。在U(Ⅵ)溶液预处理后分别给予不同浓度的CBMIDA-CaNa2和BPCBG,均可使吸光度值明显回升,CBMIDA-CaNa2的作用约是BPCBG作用的2倍,而给予不同浓度的DTPA-CaNa3,却未能引起吸光度值的增加,表明CBMIDA-CaNa2和BPCBG能竞争结合与MT结合的U(Ⅵ),从而暴露出MT与MT抗体结合的免疫位点,使吸光度值升高,也由此表明CBMIDA-CaNa2和BPCBG螯合U(Ⅵ)的能力明显大于MT,但是BPCBG的作用明显弱于CBMIDA-CaNa2;DTPA-CaNa3则未显示对MT结合U(Ⅵ)的竞争作用。另一方面,该体系经Zn2+预处理后吸光度值也显著降低,而三种螯合剂均未能明显提高Zn2+预处理体系的吸光度值,表明三种螯合剂对Zn2+的结合能力小于或等于MT与Zn2+的结合能力;有文献报道[10],在生理环境下,与UO2 2+相比,MT与Cu2+、Zn2+的结合能力强于与U(Ⅵ)的结合能力,提示MT与Zn2+的结合能力可能大于或等于螯合剂与Zn2+的结合能力,这就意味着这三种螯合剂对MT维持体内微量元素Zn2+、Cu2+等稳态的生理功能无明显影响。
本实验采用竞争ELISA方法检测到CBMIDA-CaNa2、BPCBG和DTPA-CaNa3这3种螯合剂与MT竞争结合U(Ⅵ)能力的差异,与本课题组前期细胞和动物铀促排实验的结果相吻合。前期细胞实验研究表明,50 μmol/L和250 μmol/L CBMIDA-CaNa2和BPCBG均可使染U(Ⅵ) 48 h的肾近曲小管上皮HK-2细胞内U(Ⅵ)蓄积量显著降低,分别较U(Ⅵ)染毒对照组明显降低约35%~41%和21%~34%,CBMIDA-CaNa2的作用优于BPCBG,而DTPA-CaNa3则未显示明显的效果[11-12]。本课题组前期动物实验研究表明,CBMIDA-CaNa2和BPCBG对急性铀中毒大鼠的排U(Ⅵ)效果明显优于DTPA-CaNa3,而且CBMIDA-CaNa2的排铀效果明显优于BPCBG[12-13],其中给予250 mg/kg CBMIDA-CaNa2、BPCBG和500 mg/kg DTPA-CaNa3可使大鼠U(Ⅵ)染毒后24 h肾U(Ⅵ)蓄积量分别较U(Ⅵ)染毒对照组显著降低约90%、44%和27%;250 mg/kg CBMIDA-CaNa2和BPCBG给药能使骨U(Ⅵ)蓄积量分别较U(Ⅵ)染毒对照组明显降低约73%和23%,给予500 mg/kg DTPA-CaNa3反而具有增加骨U(Ⅵ)蓄积的趋势;给予250 mg/kg CBMIDA-CaNa2和BPCBG能促进大鼠U(Ⅵ)染毒后24 h尿U(Ⅵ)排出量是U(Ⅵ)染毒对照组的2.1倍和1.6倍,DTPA-CaNa3则无明显促进尿U(Ⅵ)排出的效果[12-13],DTPA-CaNa3的这一现象也被其他研究者所观察到[2, 14]。
综上所述,本研究检测到螯合剂与MT竞争结合U(Ⅵ)能力的强弱顺序为:CBMIDA-CaNa2>BPCBG>DTPA-CaNa3,其中CBMIDA-CaNa2和BPCBG竞争螯合U(Ⅵ)的能力显著强于MT,而DTPA-CaNa3对MT螯合的U(Ⅵ)无明显的竞争结合作用,与它们在细胞和动物实验中的排U(Ⅵ)效果强弱顺序高度吻合,表明本研究建立的基于MT的竞争ELISA法可作为体外筛选铀促排螯合剂的新方法,它具有简便、快速和高通量的优点。
| [1] |
Montavon G, Apostolidis C, Bruchertseifer F, et al. Spectroscopic study of the interaction of U(Ⅵ) with transferrin and albumin for speciation of U(Ⅵ) under blood serum conditions[J]. J Inorg Biochem, 2009, 103(12): 1609-1616. DOI:10.1016/j.jinorgbio.2009.08.010 |
| [2] |
朱寿彭, 李章.铀及铀系主要核素的放射毒理学//放射毒理学[M].2版, 北京: 原子能出版社, 1992: 222-298.
|
| [3] |
Klaassen C D, Liu J, Diwan B A. Metallothionein protection of cadmium toxicity[J]. Toxicol Appl Pharmacol, 2009, 238(3): 215-220. DOI:10.1016/j.taap.2009.03.026 |
| [4] |
Sabolic I, Breljak D, Skarica M, et al. Role of metallothionein in cadmium traffic and toxicity in kidneys and other mammalian organs[J]. Biometals, 2010, 23(5): 897-926. DOI:10.1007/s10534-010-9351-z |
| [5] |
Blindauer C A, Leszczyszyn O I. Metallothioneins:unparalleled diversity in structures and functions for metal ion homeostasis and more[J]. Nat Prod Rep, 2010, 27(5): 720-741. DOI:10.1039/b906685n |
| [6] |
Hao Y, Ren J, Liu C, et al. Zinc protects human kidney cells from depleted uranium-induced apoptosis[J]. Basic Clin Pharmacol Toxicol, 2014, 114(3): 271-280. DOI:10.1111/bcpt.2014.114.issue-3 |
| [7] |
Hao Y, Ren J, Liu J, et al. The protective role of zinc against acute toxicity of depleted uranium in rats[J]. Basic Clin Pharmacol Toxicol, 2012, 111(6): 402-410. DOI:10.1111/bcpt.2012.111.issue-6 |
| [8] |
Tessier C, Suhard D, Rebiere F, et al. Uranium microdistribution in renal cortex of rats after chronic exposure:a study by secondary ion mass spectrometry microscopy[J]. Microsc Microanal, 2012, 18(1): 123-133. DOI:10.1017/S1431927611012384 |
| [9] |
李慧祺, 梁艺怀, 雷立健, 等. 镉、锌与金属硫蛋白抗体对金属硫蛋白的竞争结合[J]. 环境与职业医学, 2009(2): 118-120. |
| [10] |
Michon J, Frelon S, Garnier C, et al. Determinations of uranium(Ⅵ) binding properties with some metalloproteins (transferrin, albumin, metallothionein and ferritin) by fluorescence quenching[J]. J Fluoresc, 2010, 20(2): 581-590. DOI:10.1007/s10895-009-0587-3 |
| [11] |
Bao Y, Wang D, Hu Y, et al. Efficacy of Chelator CBMIDA-CaNa2 for the Removal of Uranium and Protection against Uranium-induced Cell Damage in Human Renal Proximal Tubular Cells[J]. Health physics, 2013, 105(1): 31-38. DOI:10.1097/HP.0b013e31828911a0 |
| [12] |
Bao Y, Wang D, Li Z, et al. Efficacy of a novel chelator BPCBG for removing uranium and protecting against uranium-induced renal cell damage in rats and HK-2 cells[J]. Toxicol Appl Pharmacol, 2013, 269(1): 17-24. DOI:10.1016/j.taap.2013.02.010 |
| [13] |
暴一众.邻苯二酚类螯合剂对急性铀中毒大鼠的解毒促排效果及其作用机制研究[D].上海: 复旦大学放射医学研究所, 2014.
|
| [14] |
Bergeron R J, Wiegand J, Singh S. Desferrithiocin analogue uranium decorporation agents[J]. Int J Radiat Biol, 2009, 85(4): 348-361. DOI:10.1080/09553000902781089 |




