2. 中国辐射防护研究院
2. China Institute for Radiation Protection
代谢产物组的动态变化及其规律可反映生物体对外因刺激的代谢应答。辐射代谢组学是辐射系统生物学的重要组成部分。国外学者已经进行了γ射线单次急性照射后的尿液相关代谢组学研究[1-4]。本课题组前期进行了60Co γ射线单次急性照射(剂量率为7 Gy/min)和累积照射(剂量率18.000 mGy/min)的相关代谢组学研究[5-6],发现累积照射与单次急性照射的代谢产物组存在差异。本研究拟采用137Cs γ射线以相对较低的剂量率(即0.353 mGy/min)进行累积照射,观察相对较低剂量率的累积照射对大鼠尿液代谢物的影响。
1 材料和方法 1.1 实验动物无特定病原体级健康雄性SD大鼠[北京军事医学科学院实验动物中心,生产许可证号:SCXK-(军)2007-004,实验动物使用许可证号:SYXK(晋)2008-0004]40只,体质量260~280 g。大鼠置于代谢笼中,自由摄食饮水,饲养条件符合GB 14925-2010《实验动物环境及设施》有关要求。本研究经中国辐射防护研究院实验动物伦理委员会批准。
1.2 试剂和仪器2,2,3,3-三甲基甲硅烷基丙酸(2,2,3,3-trimethylsily propionic acid,TSP)、氘水(Deuterium oxide,D2O,优级纯,美国NORELL公司);磷酸盐缓冲溶液(Phosphate buffer solution,PBS,北京化工厂)。AR124CN型电子天平(美国奥豪斯公司);TDL-60C台式离心机(上海安亭科学仪器厂);3-18K低温高速离心机(日本Sigma公司);NON-CFC超低温冰柜(美国Forma Scientific公司);DRX 300超导傅立叶变换核磁共振谱仪(瑞士布鲁克公司);SIMCAP 11.0软件包(美国Umetrics公司)。HMDB数据库(http://www.hmdb.ca/)。TSP/D2O溶液的配制:称取0.011 7 g TSP置于10.0 mL容量瓶,用D2O定容至10.0 mL,配置成终浓度为1.17 g/L的TSP/D2O溶液。
1.3 方法 1.3.1 动物分组和照射采用随机数字表法将大鼠分为对照组和照射组,每组20只。照射组大鼠采用137Cs放射源(中国辐射防护研究院铯源)进行全身照射,照射时活度为1.61 Ci(5.957×1010Bq);放射源位于圆环形笼具的圆心位置,圆环型笼具横切面中心轴线的剂量率为0.353 mGy/min,每天照射1次,每次照射时间为236 min,每天累积照射0.0833 Gy,每3天累积照射剂量为0.2500 Gy,共照射12 d。
1.3.2 动物尿样采集照射组大鼠于照射前1 d及照射开始后第3、6、9、12 d收集当日18:00~次日8:00的尿液(即累积剂量分别为0.00、0.25、0.50、0.75和1.00 Gy)对照组与照射组开始照射后第6 d同步收集尿样。收集的尿样于5 000 r/min(离心半径18 cm)离心5 min后,弃沉淀物,取上清液置于5 mL冻存管、封口,-80 ℃保存备用。尿液体积过大或过小的均为不合格,予以剔除。各组固定10只大鼠的尿样进行检测。
1.3.3 尿液核磁共振氢谱(Hydrogen-nuclear magnetic resonance spectroscopy,1H NMR谱)检测取尿液0.4 mL置于离心管中,加入0.1 mL质量浓度为1.17 g/L的TSP/D2O溶液和0.2 mL PBS溶液(pH值为7.0),涡旋混匀,4 ℃、10 000×g离心10 min。取上清液0.5 mL于核磁管中,检测其1H NMR谱。于DRX 300超导傅立叶变换核磁共振谱仪上采用Noesyprld脉冲序列,温度25 ℃,扫描128次,脉冲角度40°,采集时间2 s,弛豫延迟3 s。尿液样品1H NMR谱以TSP为化学位移参考峰的位置,设为δ 0,相位调整后将1H NMR谱的δ 0~4.5区域进行分段积分,每段为0.04。将积分数据归一化后,以Excel文件贮存。样品化学位移=(样品共振频率-TSP共振频率)/TSP共振频率×106(ppm)。
1.3.4 小剂量率γ辐射损伤相关代谢物分析根据化学位移代表物质的相关数据库和文献资料,指认共同化学位移信息所代表的差异代谢物名称。以照射后第6天累积剂量点数据与对照组数据差异均有统计学意义者,则确认其对应的化学位移所代表的代谢物为共同差异代谢物,分析其相对水平变化规律。样本1H NMR谱中某代谢物的峰面积为该代谢物的化学位移所对应的分段积分值,根据公式“代谢物相对水平=1H NMR谱中该代谢物峰面积/1H NMR谱中δ 0~4.5总峰面积”计算该代谢物的相对水平。
1.4 统计学分析采用SIMCA P11.0和SPSS 18.0软件进行统计分析。采用主成分分析(Principal component analysis,PCA)和偏最小二乘判别分析(Partial least-squares-discriminat analysis,PLS-DA)分析不同累积剂量点大鼠尿样1H NMR谱数据与对照组大鼠的差异,寻找对造成差异贡献较大且变化趋势相同的共同化学位移信息;各组差异代谢物的相对水平进行正态性检验符合正态分布者,以描述;各累积剂量点差异代谢物的相对水平与对照组比较采用单因素方差分析,两两比较采用Dunnett法;指标间的剂量-效应关系分析采用一元回归分析;检验水准α=0.05。
2 结果 2.1 不同累积剂量点对大鼠尿液1H NMR代谢轮廓的影响与对照组比较,0.25 Gy剂量组大鼠尿液的1H NMR谱开始有变化,表明小剂量率累积照射可引起大鼠代谢紊乱。同1只大鼠在对照组和各累积剂量点的尿液1H NMR谱见图 1。
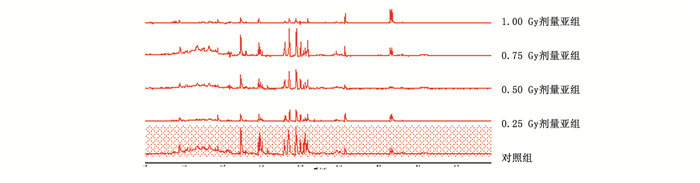
|
图 1 同1只大鼠不同累积剂量点尿液的1H NMR谱 |
PCA结果显示:不同剂量亚组与对照组大鼠尿样代谢物基本无交叉和重叠,表明0.25~1.00 Gy累积照射引起了大鼠尿样1H NMR谱,即代谢物组分的明显改变;其中0.25~1.00 Gy剂量亚组的样本点多数重叠在相同区域,表明各剂量亚组大鼠代谢物组分差异较小。见图 2。分别对各剂量亚组和对照组大鼠尿样的1H NMR谱数据进行PLS-DA分析,结果见图 3。图 3中每个点代表一个代谢物对应的化学位移,离中心点越远其离散度越大,所代表的化合物的相对水平受γ辐射的影响越大,对2组1H NMR谱差异贡献程度越大。每个离散点都有对应的贡献值及相应的化学位移信息,离散程度越大,其贡献值越高。对每个累积剂量点与对照组的PLS-DA分析结果进行统计,筛选出各个累积剂量点共同差异代谢物对应的化学位移信息,进一步参考数据库对共同差异代谢物进行指认,得出尿嘧啶、柠檬酸盐、牛磺酸、瓜氨酸和糖类的化学位移分别为2.58、2.66、3.42、3.70和3.74~3.82。
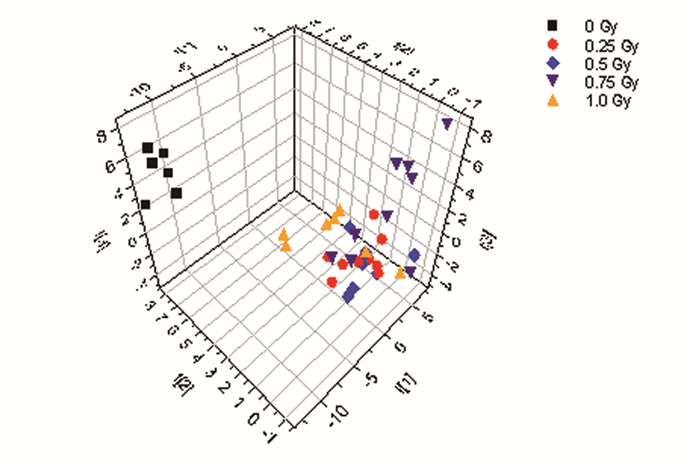
|
图 2 各组大鼠尿1H NMR谱的PCA 3D得分图 注:横、纵、竖坐标分别表示某一样品在第1、2和3主成分的得分,每个点代表 1个样品1H NMR谱的1组分段积分数据对于指定主成分的得分。 |
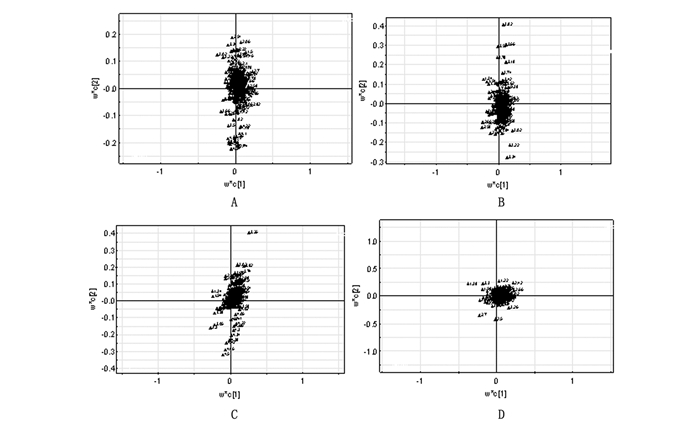
|
图 3 不同剂量亚组与对照组大鼠的尿液1H NMR谱PLS-DA负荷图 注:A:0.25 Gy剂量亚组与对照组大鼠尿液1H NMR谱PLS-DA负荷图;B:0.50 Gy剂量亚组与对照组大鼠尿液1H NMR谱PLS-DA负荷图;C:0.75 Gy剂量亚组与对照组大鼠尿液1H NMR谱PLS-DA负荷图;D:1.00 Gy剂量亚组与对照组大鼠尿液1H NMR谱PLS-DA负荷图。横、纵坐标分别表示各化学位移在第1、2主成分的得分,每个点对于中心点的离散程度代表该点所对应的代谢物对两组间差异的贡献程度。 |
对照组与0Gy剂量亚组代谢物之间无显著差异(P>0.05),说明实验过程中饮食、环境稳定。各剂量亚组的5种差异代谢物相对水平分别高于对照组,差异均有统计学意义(P<0.05)。见表 1。在累积剂量0.00~1.00 Gy范围内,以代谢物的相对水平(
|
|
表 1 各组大鼠尿中差异代谢物相对水平比较结果(x±s) |
辐射代谢组学的研究重点在于从生物体整体代谢水平测定辐射所引起的代谢产物组变化,寻找辐射损伤代谢标志物,定位辐射致代谢紊乱发生的靶器官和代谢途径。SD大鼠断奶后第12~16周其尿液代谢物是稳定的[7];但是代谢物容易受外界如饮水、饲料变化的影响。本研究时间点设置在SD大鼠断奶后第12~16周。为预防实验条件的变化对后期分析带来干扰,设置了自身对照、同步对照的分析,以扣除外界变化的干扰。本研究全过程中未发生意外情况。TYBURSKI等[1, 2]采用超高效液相色谱-飞行时间质谱技术结合模式识别方法开展了啮齿类动物辐射代谢组学研究,发现小鼠接受3.00和8.00 Gy 137Cs γ线照射后,尿代谢谱与对照组均有明显区别,乙酰甘氨酸和β-胸腺嘧啶可作为3.00和8.00 Gy累积剂量点的共同代谢标志物;小鼠接受3.00 Gy 137Cs γ射线照射后,尿中胸腺嘧啶和尿嘧啶水平分别高于照射前(P<0.05)。JOHNSON等[4]采用代谢组学技术研究了γ射线照射大鼠的尿生物标志物,采用超高效液相色谱-飞行时间质谱检测出3.00 Gy γ射射线照射后,大鼠尿中壬二酸和庚二酸等5种代谢物相对水平下调,N-乙酰基牛磺酸和牛磺酸等9种代谢物相对水平上调,照射后第2 d尿牛磺酸相对水平是照射前的2.5倍。GOUDARZI等[8]采用超高效液相色谱-飞行时间质谱技术研究了137Cs γ射线内照射对小鼠尿代谢谱的影响,发现小鼠注射氯化铯后,尿中牛磺酸和柠檬酸盐相对水平高于对照组(P<0.05),且与受到137Cs γ线外照射的小鼠相近,几种氨基酸和脂肪酸代谢通路均受到干扰。
小剂量γ射线累积照射造成的大鼠机体代谢紊乱,其主要表现为:①肾脏代谢变化使尿糖水平升高;②尿柠檬酸盐水平的变化反映了在辐射损伤反应及其修复过程中机体能量代谢的紊乱;③核酸分解代谢增强使尿嘧啶排泄增加;④肝脏胆汁酸代谢异常及其肝肠循环障碍和(或)蛋氨酸、半胱氨酸代谢异常引起尿牛磺酸水平升高。牛磺酸是蛋氨酸和半胱氨酸的代谢物,也是肝kuff细胞和肾脏髓质细胞的有机渗出物[9];其还涉及多种生理功能,如胆汁酸合成、渗透压调节、抗氧化作用和解毒作用,被认为是肝毒性的生物标志物[10]。本研究结果显示,牛磺酸相对水平与累积剂量呈正相关关系(P<0.05),这可能反映了辐射所致的肝kuff细胞和肾脏髓质细胞损伤。瓜氨酸是一种α氨基酸,主要由小肠上皮细胞合成,其相对水平与小肠的功能有关[11-12]。因此,瓜氨酸水平变化是肠功能异常的标志物[13]。有研究表明,血浆中瓜氨酸水平下降与细菌移位有关,细菌移位可提高肠内脂肪酸结合蛋白的水平[14],从而损害肠上皮细胞[15]。血浆瓜氨酸水平下降反应小肠上皮细胞功能下降[16-17]。瓜氨酸在炎症和应激反应期间调节免疫应答[18]。GOUDARZI等[19]研究发现,剂量率为1.1 Gy/min累积4.40 Gy的X射线照射后,大鼠尿液中瓜氨酸水平上升(P<0.05);而剂量率为3.0 mGy/min累积4.40 Gy的X射线照射后,尿液中瓜氨酸水平与对照组比较,差异无统计学意义(P>0.05)。本研究结果显示,在更低的剂量率为0.30 mGy/min的γ射线全身照射后,大鼠尿液中瓜氨酸水平上升,且在累积剂量0.50 Gy达到峰值,随后又有下降趋势,但仍高于对照组,可能属于应激性反应。但由于本次研究的取尿时间仅在累积剂量点当天24 h,需照射结束后连续取尿观察才能证明是否属于应激反应。
| [1] |
TYBURSKI J B, PATTERSON A D, KRISTOPHER W K, et al. Radiation metabolomics. 1. identification of minimally invasive urine biomarkers for gamma-radiation exposure in mice[J]. Radiat Res, 2008, 170(1): 1-14. |
| [2] |
TYBURSKI J B, PATTERSON A D, KRISTOPHER K W, et al. Radiation metabolomics.2. dose and time dependent urinary excretion of deaminated purines and pyrimidines after sublethal gamma-radiation exposure in mice[J]. Radiat Res, 2009, 172(1): 42-57. DOI:10.1667/RR1703.1 |
| [3] |
LANZ C, PATTERSON A D, SLAVIK J, et al. Radiation metabolomics.3. biomaker discovery in the urine of gamma-irradiated rats using a simplified metabolomics protocol of gas chromatography-mass spectrometry combined with random forests machine learning algorithm[J]. Radiat Res, 2009, 172(2): 198-212. DOI:10.1667/RR1796.1 |
| [4] |
JOHNSON C H, PATTERSON A D, KRAUSZ K W, et al. Radiation metabolomics.4.UPLC-ESI-QTOFMS based metabolomics for urinary biomarker discovery in gamma-irradiated rats[J]. Radiat Res, 2011, 175(4): 473-484. DOI:10.1667/RR2437.1 |
| [5] |
张慧芳, 杨彪, 郭月凤, 等. 60Co急性全身均匀照射后大鼠尿液代谢成分特征的初步研究[J]. 辐射研究与辐射工艺学报, 2011, 29(6): 354-358. |
| [6] |
张慧芳, 杨彪, 党旭红, 等. 60Co γ射线累积照射对大鼠尿液中小分子代谢物的影响[J]. 中华放射医学与防护杂志, 2012, 32(4): 358-361. DOI:10.3760/cma.j.issn.0254-5098.2012.04.006 |
| [7] |
WILLIAMS R E, LENZ E M, LOWDEN J S, et al. The metabonomics of ageing and development in the rat:an investigation into the effect of age on the profile of endogenous metabolites in the urine of male rats using 1H NMR and HPLC-TOF MS[J]. Mol Biosyst, 2005, 1(2): 166-175. DOI:10.1039/b500852b |
| [8] |
GOUDARZI M, WEBER W, MAK T D, et al. Development of urinary biomarkers for internal exposure by cesium-137 using a metabolomics approach in mice[J]. Radiat Res, 2014, 181(1): 54-64. DOI:10.1667/RR13479.1 |
| [9] |
WATERS N J, WATERFIELD C J, FARRANT R D, et al. Metabonomic deconvolution of embedded toxicity:application to thioacetamide hepato-and nephrotoxicity[J]. Chem Res Toxicol, 2005, 18(4): 639-654. DOI:10.1021/tx049869b |
| [10] |
SOUIDI M, SCANFF P, GRISON S, et al. Effects of ionizing radiation on the activity of the major hepatic enzymes implicated in bile acid biosynthesis in the rat[J]. C R Biol, 2007, 33(12): 861-870. |
| [11] |
WU G. Synthesis of citrulline and arginine from proline in enterocytes of postnatal pigs[J]. Am J Physiol, 1997, 272(6Pt 1): G1382-G1390. |
| [12] |
CRENN P, HANACHI M, NEVEUX N, et al. Circulating citrulline levels:a biomarker for intestinal functionality assessment[J]. Ann Biol Clin (Paris), 2011, 69(5): 513-521. |
| [13] |
ZEZULOV M, BARTOU KOV M, HL DKOV E, et al. Citrulline as a biomarker of gastrointestinal toxicity in patients with rectal carcinoma treated with chemoradiation[J]. Clin Chem Lab Med, 2016, 54(2): 305-314. |
| [14] |
GRIMALDI D, GUIVARCH E, NEVEUX N, et al. Markers of intestinal injury are associated with endotoxemia in successfully resuscitated patients[J]. Resuscitation, 2013, 84(1): 60-65. DOI:10.1016/j.resuscitation.2012.06.010 |
| [15] |
PAN L, WANG X, LI W, et al. The intestinal fatty acid binding protein diagnosing gut dysfunction in acute pancreatitis:a pilot study[J]. Pancreas, 2010, 39(5): 633-638. DOI:10.1097/MPA.0b013e3181c79654 |
| [16] |
WOO H K, KIM E K, JUNG Y H, et al. Reduced early dried blood spot citrulline levels in preterm infants with meconium obstruction of prematurity[J]. Early Hum Dev, 2015, 91(12): 777-781. DOI:10.1016/j.earlhumdev.2015.09.004 |
| [17] |
CRENN P, DE TRUCHIS P, NEVEUX N, et al. Plasma citrulline is a biomarker of enterocyte mass and an indicator of parenteral nutrition in HIV-infected patients[J]. Am J Clin Nutr, 2009, 90(3): 587-594. DOI:10.3945/ajcn.2009.27448 |
| [18] |
CRENN P, NEVEUX N, CHEVRET S, et al. Plasma l-citrulline concentrations and its relationship with inflammation at the onset of septic shock:a pilot study[J]. J Crit Care, 2014, 29(2): 1-6. DOI:10.1016/S0883-9441(14)00025-2 |
| [19] |
GOUDARZI M, CHAUTHE S, STRAWN S J, et al. Quantitative metabolomic analysis of urinary citrulline and calcitroic acid in mice after exposure to various types of ionizing radiation[J]. Int J Mol Sci, 2016, 17(5): 782-799. DOI:10.3390/ijms17050782 |


