心血管疾病是全球死亡的第一大原因,2015年全球约有1770万人死于心血管疾病;恶性肿瘤是世界第二大常见死因,约有880万例[1]。心血管疾病和恶性肿瘤的多发预示心脏疾病和恶性肿瘤并存的患者数量将呈指数增长。随着肿瘤生物学的进展和治疗手段的不断提高,肿瘤患者的生存期得到显著改善,导致与年龄相关的慢性疾病与恶性肿瘤综合治疗的远期不良反应相叠加。据统计,超过50%的恶性肿瘤患者会接受放疗[2-3]。研究显示放疗后长期存活的恶性肿瘤患者糖尿病,高血压,高脂血症,慢性肾脏疾病和血管疾病的发生率显著增加,这可能与放疗加速动脉粥样硬化有关[4]。突发放射事故中人群的心脏或血管损伤发生率高,提示放射会对心血管产生副作用。心血管疾病发生风险随心脏受照剂量的增加而增加,并可引起冠状血管,瓣膜,心包膜和心肌结构功能异常[5]。乳腺癌,肺癌,食道癌,胸腺瘤和纵隔淋巴瘤是常见的接受放疗的恶性肿瘤,心脏紧邻这些部位,因此不可避免地受到照射。早期乳腺癌和淋巴瘤患者生存时间长,因此,发生放射性心血管疾病的可能性增大。研究显示,在广岛、长崎原爆的长期幸存者中,冠脉事件和中风等血管疾病的发病率随着受照剂量的增加而增加。此外,慢性肾功能衰竭和肝硬化的发病率也增加,这可能会影响心血管疾病的发生[6]。有关恶性肿瘤放疗患者心脏毒性的报道主要集中在1950年-1990年之间,当时的放疗技术导致研究结果可能出现偏差。然而,目前应用图像引导放疗、三维适形放疗以及严格的剂量限制等先进技术,仍无法避免放射性性心血管疾病的发生[7-8]。有关放射性心血管疾病的临床和实验性研究日益增多,表明放射性心血管疾病的发生原因、机制越来越受到人们的重视。随着恶性肿瘤患者生存时间的延长,探讨放疗诱导的心脏功能障碍的基本机制至关重要。因此,我们对放射性心血管疾病发生的病理生理学机制做一简要概述,并详细阐述了其临床表现,最后提出相应的随访监测原则。
1 放射性心血管疾病的病理生理学机制放疗后心内膜改变最显著的是冠状血管,其中毛细血管网络的超微结构改变导致毛细血管/心肌细胞比率降低。心外膜血管损伤导致TGF-β上调引起促血栓形成状态,并激活NF-kB细胞核,最终导致持续炎症的发生[9-10]。由于单核细胞和巨噬细胞对炎症部位的趋化作用以及继发于促血栓形成环境的血管腔闭塞,可能加速动脉粥样硬化的发展。内皮细胞的损伤导致单核细胞向内膜迁移和脂蛋白吞噬,甚至导致在无动脉粥样硬化的情况下形成脂肪斑纹[11]。在具有明确动脉粥样硬化的实验小鼠模型中,放疗引起斑块中超微结构改变,最终引起斑块内出血;巨噬细胞浸润导致斑块易于形成血栓[12]。放疗诱导的炎症变化和内皮改变则通过促凝血系统调节冠状血管中动脉粥样硬化的发展。因此,放疗可直接诱发动脉粥样硬化,也可加速已经存在的动脉粥样硬化。放疗后的心肌改变包括心肌毛细血管内皮细胞变性引起的心肌纤维化,心肌的直接损伤与内皮损伤叠加,导致毛细血管腔内胶原沉积,血管狭窄和心肌血供不断恶化,造成血供减少和心肌持续纤维化重塑的恶性循环[13]。
除了心包,心肌和心内膜损伤外,心脏瓣膜和传导系统也受到放疗诱导的损伤。可表现为继发于纤维化增厚,钙化和瓣膜回缩导致的瓣膜物理回缩和狭窄疾病后的返流性瓣膜疾病。一项尸检研究发现左侧瓣膜更易受到影响,其中79%的二尖瓣或主动脉瓣显示弥漫性瓣膜纤维化[14-16]。放疗引起的变化影响迷走神经/颈动脉窦压力感受器反射的变化,加快基线心率(HR)和异常心率恢复(HRR)[17]。
2 放射性心血管疾病的临床表现放射可引起心包疾病,缺血性心脏病,心脏瓣膜病,传导系统疾病,自主神经改变和心肌病[18-19]。
2.1 心包疾病心包改变是最常见的心血管疾病。
2.1.1 急性心包炎急性心包炎是一种罕见的表现,可能发生在放疗期间或之后。即使在全球最大的癌症治疗中心,在30年内仅报道8例放疗诱发的急性心包炎[7]。临床表现常为放射野内胸痛,伴有炎性标志物如嗜中性粒细胞计数和血沉沉淀率的升高。心电图(ECG)可能正常或异常。临床治疗用非甾体抗炎药(NSAIDs)和秋水仙碱。类固醇激素容易引起心包炎复发,因此只用于对NSAIDs无效或耐药病例[20]。急性心包炎通常是良性的,如果用NSAIDs能够控制,一般不需要停止放疗。急性心包炎患者应密切随访,因为他们有患慢性心包炎的风险。
2.1.2 延迟性心包炎,有或无包膜慢性心包疾病可在放疗后数月至数年发生,可表现为大量心包积液。心包囊中富含蛋白质的渗出物聚积可导致心包积液,而快速积聚可能导致心脏压塞。呼吸困难,端坐呼吸,伴有遥远心音的胸痛,低血压和颈静脉怒张可作为诊断指标。超声心动图仍然是确定诊断和排除压塞的金标准。Fukada等报道,食管照射,纵隔放疗区宽度> 8 cm与心包积液发生率增加有关[21]。不能手术的食管癌放化疗患者发生心包积液的中位时间为5.3个月(1.0~16.7个月)。剂量体积参数V30超过46%与治疗后18个月的心包积液率为73%相关,而当V30低于46%时为13%(P=0.001)[22]。在强调其他致病因素的同时,放疗诱发的心包积液应始终作为关注的重点。大多数积液是自限性的,心包填塞需要紧急心包穿刺。反复发生的积液可能需要心包切开术。
2.1.3 缩窄性心包炎(CP)缩窄性心包炎是任何心脏炎症的远期后遗症。有研究发现86例长期存活的霍奇金淋巴瘤患儿CP的发生率为7%[9]。CP患者可能出现难治性心力衰竭,手术切除壁层心包膜是治疗选择。Avgerinos等人报道36例接受放疗的患者,15年内CP心包切开术发生率为8.3%(n=3)[23]。Bertog等人报道163例接受CP心包切除术的患者,放疗后CP的7年生存率最差为27%(95%CI :9~58)[24]。
2.2 冠状动脉疾病(CAD)乳腺癌和CAD的相关性研究发现,左侧乳腺癌患者易于在远端左前降支(LAD)动脉和远对角动脉处发生狭窄。在分析乳腺癌放疗热点(PTV15 mm以外的受照剂量大于PTV计划剂量的体积)时发现,冠状动脉狭窄的严重程度随着热点的增加而增加。Correa等人在961名患者中研究早期乳腺癌放疗后CAD的特点,出现心血管症状时进行心脏负荷试验和/或导管置入术。在放疗后中位时间为12年(2~24年)时,左侧(59%)较右侧受照患者(8%)有较高的负荷测试异常率(P=0.001),70%的冠状动脉改变在LAD动脉[25]。进一步的分析显示心脏相关性死亡率,左侧乳腺癌患者为3.5%,右侧乳腺癌患者为2%。在放疗后的第二个十年中,患者心脏性死亡的累积风险为左侧6.4%(95%CI:3.5~11.5),右侧3.6%(95%CI:1.8~7.2)。胸痛、CAD和心肌梗塞发生率在左侧放疗患者中较高(P < 0.002)。高血压与CAD风险较高有关[26]。127例Ⅲ期非小细胞肺癌患者剂量递增研究汇总分析显示,2年和4年心脏症状发生率分别为10%和18%。心脏平均剂量和主要冠脉事件发生率呈正相关。(心脏平均剂量为20 Gy与10 Gy时,V5主要冠脉事件发生率分别为56%和34%,V30分别为29%和12%)。发生主要冠脉事件患者的基线CAD也较高(35%比8%),这表明放疗可能会加速动脉粥样硬化的发展[27]。
Darby等人研究报道2168名女性放疗后主要冠状动脉事件与平均心脏剂量具有线性剂量反应关系。第一个十年中的主要冠状动脉事件发生率为44%,在10至19年间为33%,20年为23%。平均心脏剂量每增加1Gy,主要冠状动脉事件发生率增加7.4%(95%CI:2.9~14.5;P < 0.001)。心脏基础危险因素导致放射风险增加,左侧照射比右侧照射发生更高的冠状动脉事件。合并缺血性心脏病,糖尿病,呼吸系统疾病、循环系统疾病和吸烟者女性患冠状动脉疾病的风险较高。心脏平均剂量≥10Gy导致主要冠脉事件发生率增加116%(95%CI:59~195)。与LAD冠状动脉的平均剂量相比,心脏平均剂量是主要冠状动脉事件更好的预测指标[5]。
放疗后诱发的CAD的临床表现无特异性,如胸痛,呼吸困难,心力衰竭,晕厥甚至猝死。放疗诱发的CAD的治疗原则与普通CAD患者相似。然而,如果需要行冠状动脉旁路移植术,所有患者均不适宜使用内乳动脉导管移植,因为内乳血管也可能受到放疗的影响[28]。
2.3 心脏瓣膜病(VHD)瓣膜性心脏病通常在放疗后多年发生。放疗后20年的患者主动脉瓣关闭不全(60%vs4%,P < 0.0001),三尖瓣关闭不全(4%vs0%,P=0.06)和主动脉瓣狭窄(16%vs0%,P=0.0008)发生率比放疗后10年均明显增高。放疗患者的左室短轴缩短率和受年龄和性别影响的左心室质量较低[29]。放疗后患者发生VHD的风险随放疗剂量呈线性增加。VHD发生率与受损瓣膜受到超过纵隔限制剂量的剂量相关(P < 0.001)[30]。虽然大多数患者仅有轻、中度VHD,但仍有一些患者会发生需要手术或经皮介入治疗的明显瓣膜疾病,因此密切随访仍至关重要。另有少数报道指出,无症状VHD转变为症状性VHD的平均时间为5年[15]。
2.4 心肌病和充血性心力衰竭(CHF)大剂量放疗导致心肌纤维化,弥漫性心肌纤维化阻碍心肌协调运动,最终导致收缩性心力衰竭。此外,失活的心肌肾素-血管紧张素-醛固酮系统引起交感神经过度活化,导致心室重塑,进一步加剧心力衰竭。临床表现可能类似于伴有积液的CP,但无法用液体引流或心包剥离术缓解症状[15]。Mulrooney等指出,在14 358名儿童5年生存者中发现,儿童的CHF危险比为5.9(95%CI:3.4~9.6;P < 0.001)。与未照射的幸存者相比,放射剂量≥15 Gy心脏发生CHF,心肌梗死(MI)和VHD的危险增加2~6倍。心脏不良事件的风险甚至会持续到放疗后30年[31]。
2.5 传导系统在急性期,大多数患者发生与放疗相关的非特异性ECG改变。Gomez等人报道R波异常和房间隔ST改变是最常见的表现。放疗诱发的右束支传导阻滞见于右束接近心内膜的纵隔放疗患者[32]。放疗后患者很少会出现数年的CHB,但仍有一些严重患者可能需要安装永久性心脏起搏器。CHB通常在放疗后1-23年发生[33]。
2.6 自主神经功能障碍纵隔放疗的患者有发生自主神经功能障碍的风险。Groarke等人将接受放疗的霍奇金淋巴瘤患者的运动能力参数作为观察指标发现,自主神经功能障碍参数如静息HR(≥80次/min)和1分钟HRR(如果主动冷却≤12次/分钟或被动恢复≤18次/分钟)在受照患者中升高。随着放疗剂量和时间的增加,自主神经功能障碍的发生率增加。静息HR和HRR异常与运动能力低下有关。HRR异常的全因死亡风险较高(风险比4.60,95%CI:1.62~13.02)[17]。合并糖尿病可能会加重自主神经功能障碍,且可能导致忽视心绞痛症状。
2.7 肺静脉闭塞性疾病肺静脉阻塞性疾病是放疗后的罕见表现,仅见少数病例报道。血栓形成,纤维化,增生性淋巴管炎,血管内膜炎导致动脉和小静脉内皮细胞发生动脉硬化和脉管系统变窄,最终可能导致肺动脉高压的发生[34]。
3 放射性心血管疾病的生物标志物肌钙蛋白T(TnT),肌钙蛋白I(TnI)和脑利钠肽(BNP)是心脏损伤的潜在生物标志物。Gomez等人做了一项探索性研究,评估胸部恶性肿瘤放疗期间TnI和BNP水平的变化,仅1例患者在放疗后中位BNP升高,其余18例患者BNP未随时间增加[31]。Palumbo等人发现,放疗后1个月和6个月时BNP水平升高(P < 0.001)。标准化BNP与V20,V25,V30,V45,平均心脏剂量和最大心脏间距显著相关(P < 0.05)。4例患者发生冠状动脉事件,其中1例V20,V25,V30和V45最高的MI患者随访1~12个月,BNP持续升高。BNP可作为预测放疗后心脏毒性的潜在指标[33]。TnT是心肌损伤的指标。58例乳腺癌患者在放疗期间,21%的患者TnT升高。大剂量的全心(P=0.02)及左心室受照(P=0.03),LAD接受15 Gy(P=0.03)和20 Gy(P=0.03)与TnT升高相关[34]。这些研究仅在短期内评估心脏标志物,是否能转化为预测长期结果还有待阐明。
4 放射性心血管疾病的监测原则在心脏附近或纵隔放疗的患者应接受定期的终身随访。详细的基线水平和体格检查是必须的。任何有心脏杂音或临床危险因素的患者都应有基线超声心动图。另外,所有患者都应该进行基线血脂和甲状腺功能检查。每年进行一次临床随访是合理的,但目前尚无特定的临床或影像随访方法。对于无症状的高危患者5年后随访超声心动图,10年后进行无创性心脏负荷测试;另一种方法是不管放疗5年后还是10年后,仅在心脏出现相关症状或杂音时随访超声心动图,纵膈放疗10年后行心脏负荷测试或冠状动脉造影。在所有的随访中,详细的病史和体格检查至关重要。有些患者可能会出现无症状性心包积液,因此随访中应定期常规完成胸部X线和CT扫描,并详细了解每次的随访情况。图 1说明了一种用于放射性心血管疾病的随访方法。
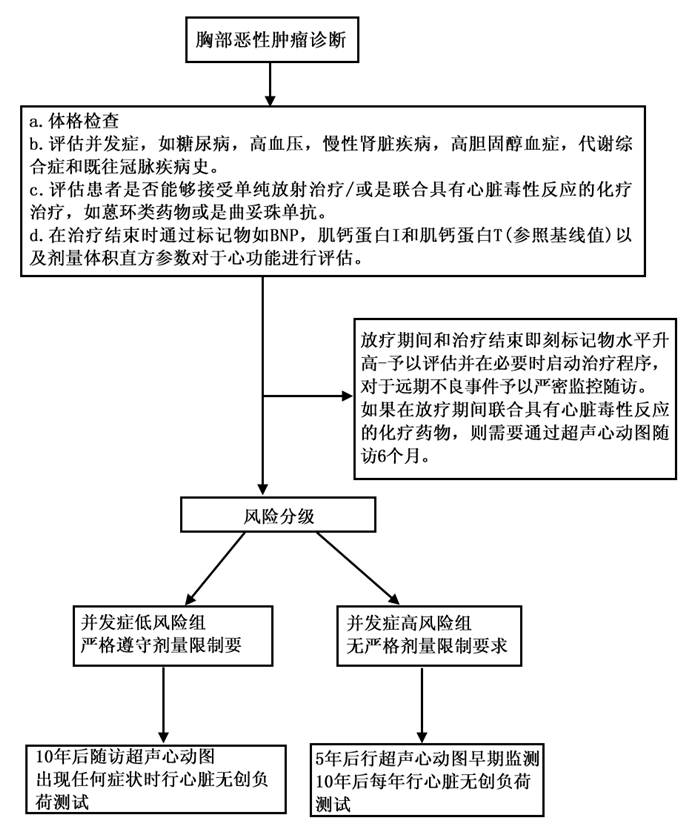
|
图 1 胸部恶性肿瘤患者放射治疗后随访推荐方案示意图 |
随着人类寿命的不断延长,恶性肿瘤和心血管疾病必然会增多。尽管现有的有关放射性心血管疾病的研究结果大部分来自开展放疗技术的早期,但仍有一些潜在风险持续存在,这可从肺癌剂量增加研究中得到证实。需要关注放射性心血管疾病潜在的病理生理学机制和临床表现,从而更好的监测和防治这部分患者。风险预测模型和潜在生物标志物的监测可用于预测在未来可能发生心脏事件的患者。放射治疗后应提高对这种并发症的认识,并在患者放疗后的随访过程中详细监测。这就要求越来越多的肿瘤放疗科医师,内科医师,放射科医师和心脏病专家密切合作,将放射性心血管疾病的发病率和患病率以类似于肿瘤登记的方式集中登记,并在癌症治疗中心不断维持。
| [1] |
WHO. Cardiovascular Diseases (CVDs) (2017) http://www.who.int/mediacentre/factsheets/fs317/en/
|
| [2] |
Delaney G, Jacob S, Featherstone C, et al. The role of radiotherapy in cancer treatment[J]. Cancer, 2005, 104(6): 1129-1137. DOI:10.1002/(ISSN)1097-0142 |
| [3] |
Baskar R, Lee KA, Yeo R, et al. Cancer and radiation therapy:current advances and future directions[J]. Int J Med Sci, 2012, 9(3): 193-199. DOI:10.7150/ijms.3635 |
| [4] |
Sarfati D, Koczwara B, Jackson C. The impact of comorbidity on cancer and its treatment[J]. CA Cancer J Clinm, 2016, 66(4): 337-350. DOI:10.3322/caac.v66.4 |
| [5] |
James M, Swadi S, Yi M, et al. Ischaemic heart disease following conventional and hypofractionated radiation treatment in a contemporary breast cancer series[J]. J Med Imaging Radiat Oncol, 2018, 1-7. |
| [6] |
Harry M. Cullings. Impact on the Japanese atomic bomb survivors of radiation received from the bombs[J]. Health Phys, 2014, 106(2): 281-293. DOI:10.1097/HP.0000000000000009 |
| [7] |
van Nimwegen FA, Ntentas G, Darby SC, et al. Risk of heart failure in survivors of Hodgkin lymphoma:effects of cardiacexposure to radiation and anthracyclines[J]. Blood, 2017, 129(16): 2257-2265. DOI:10.1182/blood-2016-09-740332 |
| [8] |
Al-Kindi SG, Oliviera GH. Incidence and trends of cardiovascular mortality after common cancers in young adults:analysis of surveillance, epidemiology and end-results program[J]. World J Cardiol, 2016, 8(6): 368-374. DOI:10.4330/wjc.v8.i6.368 |
| [9] |
Nabati M, Yosofnezhad K, Taghavi M, et al. Non-Hodgkin's Lymphoma Presenting as Constrictive Pericarditis:A Rare Case Report[J]. J Tehran Heart Cent, 2016, 11(2): 92-97. |
| [10] |
Halle M, Gabrielsen A, Paulsson-Berne G, et al. Sustained inflammation due to nuclear factor-kappa B activation in irradiated human arteries[J]. J Am Coll Cardiol, 2010, 55(12): 1227-1236. DOI:10.1016/j.jacc.2009.10.047 |
| [11] |
Hansson G. Inflammation, atherosclerosis, and coronary artery disease[J]. N Engl J Med, 2005, 352(16): 1685-1695. DOI:10.1056/NEJMra043430 |
| [12] |
Stewart FA, Heeneman S, Te Poele J, et al. Ionizing radiation accelerates the development of atherosclerotic lesions in ApoE-/-mice and predisposes to an inflammatory plaque phenotype prone to hemorrhage[J]. Am J Pathol, 2006, 168(2): 649-658. DOI:10.2353/ajpath.2006.050409 |
| [13] |
Liu LK, Ouyang W, Zhao X, et al. Pathogenesis and prevention of radiation-induced myocardial fibrosis[J]. Asian Pac J Cancer Prev, 2017, 18(3): 583-587. |
| [14] |
Basavaraju SR, Easterly CE. Pathophysiological effects of radiation on athero-sclerosis development and progression, and the incidence of cardiovascular complications[J]. Med Phys, 2002, 29(10): 2391-2403. DOI:10.1118/1.1509442 |
| [15] |
Carlson RG, Mayfield WR, Normann S, et al. Radiation-associated valvular disease[J]. Chest, 1991, 99(3): 538-545. DOI:10.1378/chest.99.3.538 |
| [16] |
Wethal T, Lund M-B, Edvardsen T, et al. Valvular dysfunction and left ventricular changes in Hodgkin's lymphoma survivors.A longitudinal study[J]. Br J Cancer, 2009, 101(4): 575-581. DOI:10.1038/sj.bjc.6605191 |
| [17] |
Groarke JD, Tanguturi VK, Hainer J, et al. Abnormal exercise response in long-term survivors of Hodgkin lymphoma treated with thoracic irradiation:evidence of cardiac autonomic dysfunction and impact on outcomes[J]. J Am Coll Cardiol, 2015, 65(6): 573-583. DOI:10.1016/j.jacc.2014.11.035 |
| [18] |
Nielsen KM, Offersen BV, Nielsen HM, et al. Short and long term radiation induced cardiovascular disease in patients with cancer[J]. Clin Cardiol, 2017, 40(4): 255-261. DOI:10.1002/clc.2017.40.issue-4 |
| [19] |
Yusuf SW, Sami S, Daher IN. Radiation-induced heart disease:a clinical update[J]. Cardiol Res Pract, 2011, 317659. |
| [20] |
Yusuf SW, Hassan SA, Mouhayar E, et al. Pericardial disease:a clinical review[J]. Expert Rev Cardiovasc Ther, 2016, 14(4): 525-539. DOI:10.1586/14779072.2016.1134317 |
| [21] |
Fukada J, Shigematsu N, Ohashi T, et al. Pericardial and pleural effusions after definitive radiotherapy for esophageal cancer[J]. J Radiat Res, 2012, 53(3): 447-453. DOI:10.1269/jrr.11194 |
| [22] |
Wei X, Liu HH, Tucker SL, et al. Risk factors for pericardial effusion in inoperable esophageal cancer patients treated with definitive chemoradiation therapy[J]. Int J Radiat Oncol Biol Phys, 2008, 70(3): 707-714. DOI:10.1016/j.ijrobp.2007.10.056 |
| [23] |
Avgerinos D, Rabitnokov Y, Worku B, et al. Fifteen-year experience and outcomes of pericardiectomy for constrictive pericarditis[J]. J Card Surg, 2014, 29(4): 434-438. DOI:10.1111/jocs.v29.4 |
| [24] |
Bertog SC, Thambidorai SK, Parakh K, et al. Constrictive pericarditis:etiology and cause-specific survival after pericardiectomy[J]. J Am Coll Cardiol, 2004, 43(8): 1445-1452. DOI:10.1016/j.jacc.2003.11.048 |
| [25] |
Correa CR, Litt HI, Hwang WT, et al. Coronary artery findings after left-sided compared with right-sided radiation treatment for early-stage breast cancer[J]. J Clin Oncol, 2007, 25(21): 3031-3037. DOI:10.1200/JCO.2006.08.6595 |
| [26] |
Harris EER, Correa C, Hwang WT, et al. Late cardiac mortality and morbidity in early-stage breast cancer patients after breast-conservation treatment[J]. J Clin Oncol, 2006, 24(25): 4100-4106. DOI:10.1200/JCO.2005.05.1037 |
| [27] |
Wang K, Eblan MJ, Deal AM, et al. Cardiac toxicity after radiotherapy for stage Ⅲ non-small-cell lung cancer:pooled analysis of dose-escalation trials delivering 70 to 90 Gy[J]. J Clin Oncol, 2017, 35(13): 1387-1394. DOI:10.1200/JCO.2016.70.0229 |
| [28] |
Veeragandham RS, Goldin MD. Surgical management of radiation-induced heart disease[J]. Ann Thorac Surg, 1998, 65(4): 1014-1019. DOI:10.1016/S0003-4975(98)00082-4 |
| [29] |
Cutter DJ, Schaapveld M, Darby SC, et al. Risk of valvular heart disease after treatment for Hodgkin lymphoma[J]. J Natl Cancer Inst, 2015, 107(4): djv008. |
| [30] |
Mulrooney DA, Yeazel MW, Kawashima T, et al. Cardiac outcomes in a cohort of adult survivors of childhood and adolescent cancer:retrospective analysis of the Childhood Cancer Survivor Study cohort[J]. BMJ, 2009, 339: b4606. DOI:10.1136/bmj.b4606 |
| [31] |
Gomez DR, Yusuf SW, Munsell M, et al. A prospective exploratory analysis of cardiac biomarkers and electrocardiogram abnormalities in patients receiving thoracic radiation therapy with high-dose heart exposure[J]. J Thorac Oncol, 2014, 9(10): 1554-1560. DOI:10.1097/JTO.0000000000000306 |
| [32] |
Kramer MR, Estenne M, Berkman N, et al. Radiation-induced pulmonary veno-occlusive disease[J]. Chest, 1993, 104(4): 1282-1284. DOI:10.1378/chest.104.4.1282 |
| [33] |
Palumbo I, Palumbo B, Fravolini ML, et al. Brain natriuretic peptide as a cardiac marker of transient radiotherapy-related damage in left-sided breast cancer patients:a prospective study[J]. Breast, 2016, 25: 45-50. DOI:10.1016/j.breast.2015.10.004 |
| [34] |
Skytta T, Tuohinen S, Boman E, et al. Troponin T-release associates with cardiac radiation doses during adjuvant left-sided breast cancer radiotherapy[J]. Radiat Oncol, 2015, 10: 141. DOI:10.1186/s13014-015-0436-2 |


