2. 南方医科大学公共卫生学院放射医学系;
3. 南方医科大学南方医院放疗科
2. Dept. of Radiation Medicine, School of Public Health, Southern Medical University;
3. Dept. of Radiation Oncology, Nanfang Hospital, Southern Medical University
电离辐射作为物理损伤因子,其对机体的损伤一直是人们关注的焦点。辐射引起生物分子损伤的机制之一是导致自由基的产生,而一氧化氮(NO)是辐射引起的自由基之一[1-2]。已有的研究表明,NO具有自分泌和旁分泌的作用,既是第一信使分子,又是第二信使分子,其由L精氨酸与氧气在一氧化氮合酶(NOS)的作用下合成[1]。肝脏是体内NO合成的重要器官,肝实质细胞、肝巨噬细胞(Kupffer细胞)和肝窦内皮细胞均能合成NO。NO对肝脏既有保护作用,也有损害作用;既参与许多生理过程,又参与许多病理过程[3]。不同的NO表达量在不同的生理或病理状态下起不同作用。p53蛋白被认为是DNA损伤的“传感器”,多种类型的DNA损伤可激活p53蛋白的表达,并进一步通过诱导其下游信号通路的激活而发挥损伤修复、细胞周期阻滞和细胞凋亡等功能。普遍认为,NO是一种DNA损伤剂和诱变剂,辐射是否会诱导动物肝脏NO水平的变化并进一步诱导p53蛋白的变化而发挥各种作用,是目前研究的热点。本研究通过给予小鼠致死剂量γ射线一次全身均匀照射,观察小鼠辐射后肝脏NO水平的变化以探讨其规律,同时观察肝脏组织中诱导型NOS(iNOS)的变化和p53蛋白表达的关系,以探讨其相关性。
1 材料和方法 1.1 实验动物无特定病原体级健康成年NIH小鼠42只(南方医科大学实验动物中心,6~8周龄,实验动物许可证号:scxk粤2006-0015),雄性,体质量(18~25) g,该鼠为美国国立卫生研究院(NIH)培育而成的,1980年引入我国。动物饲养条件符合GB 14925-2010《实验动物环境及设施》有关要求:试验过程中动物均在SPF屏障环境中饲养,12 h/12h明暗交替照明,温度23℃~26℃,相对湿度40%~70%;定期消毒、清洗笼具;动物房噪声<60 dB(A);换气次数≥15次/h;相通区域的最小静压差≤10 Pa;氨质量浓度≤14 mg/m3。
1.2 仪器和试剂60Co γ辐射源(剂量率0.3 Gy/min,广州市辐照中心);LD4-2型水平离心机(北京医用离心机厂);普通台式离心机(德国艾本德公司);XW-80A型旋涡混和器(上海越磁电子科技有限公司);722N型分光光度计(上海精密科学仪器有限公司);振荡器(上海医科大学仪器厂);37 ℃恒温水浴箱(广州市康恒仪器有限公司);匀浆器(海门盛泰实验仪器有限公司),光学显微镜(德国莱卡仪器有限公司)。NO检测试剂盒、考马斯亮兰检测试剂盒(南京建成生物工程研究所第一分所)。抗iNOS、抗p53多克隆抗体、免疫组织化学(SABC)试剂盒、二氨基联苯胺(DAB)显色剂、磷酸盐缓冲液(PBS,武汉博士德公司);多聚甲醛固定液、血清封闭液(北京鼎国昌盛生物技术有限公司)。
1.3 动物分组及模型建立实验动物随机分为7组,每组6只。第1组动物为对照组,不予60Co γ辐射源照射,其余6组动物分别为照射后1、3、6、9、12、24 h组(以下统称“辐射组”),置于距60Co γ辐射源0.3 m处接受30 min γ射线一次全身均匀照射,照射剂量为9.0 Gy(致死剂量);照射后,动物于如前所述的SPF屏障环境中饲养。对照组、照射后1 h组和照射后24 h组由于动物在照射过程中发生机械挤压,各死亡1只。
1.4 方法 1.4.1 肝脏组织获取对照组和辐射组分别在照射前和照射后1、3、6、9、12、24 h 7个时间点,用颈椎脱臼法处死小鼠,各组小鼠例数为5、5、6、6、6、6、5只。解剖获取肝脏组织,剔除肝脏组织的脂肪和筋膜并用生理氯化钠溶液漂洗以去除血液,于匀浆器中匀浆,3 500 r/min离心(离心半径为10 cm)10 min后取上清液用于肝脏组织中NO水平检测。
1.4.2 NO水平检测考马斯亮兰试剂盒检测肝脏匀浆组织中总蛋白水平,NO检测试剂盒检测肝脏组织上清中NO水平。
1.4.3 SABC法检测肝脏iNOS和p53蛋白的表达在上述对应时间点获取的肝脏组织裁成1.0 cm×1.0 cm×0.5 cm大小,剔除组织上的脂肪,于PBS中充分洗涤。于体积分数为4%多聚甲醛固定液中4 ℃固定,模具包埋、切片、烤片。二甲苯-二甲苯、体积分数为100%酒精、体积分数为100%酒精、体积分数为95%酒精、体积分数为90%酒精、体积分数为80%酒精和体积分数为70%酒精依次脱蜡,并进行抗原修复,血清封闭(900 μl PBS:100 μl血清封闭液)。加一抗过夜,加二抗后再加SABC,置于37 ℃温箱中0.5 h后DAB显色。浸泡于苏木精中复染0.5 min,脱水、封片并镜检。镜下iNOS阳性反应物质呈黄色或棕黄色,位于胞浆。p53蛋白组化染色阳性细胞核为黄色或棕黄色。在高倍镜(×400倍)下随机选取5个视野,计数300个细胞,算出阳性细胞数。
1.5 统计学分析采用SPSS 11.5软件进行统计分析。计量资料以x±s描述,各组肝脏组织中NO水平比较采用单因素方差分析,肝脏组织中iNOS和p53蛋白的相关性分析采用Pearson相关分析。检验水准α=0.05。
2 结果 2.1 致死剂量照射后肝脏组织中NO水平变化情况肝脏组织中NO水平在照射后呈现先升高后降低的趋势。与照射前比较,照射后6、9 h肝脏组织中NO水平升高,差异均有统计学意义(P<0.05),照射后12 h肝脏组织中NO水平开始恢复,并于照后24 h降至正常参考值范围(P>0.05)。见表 1。
|
|
表 1 肝脏组织NO水平变化 |
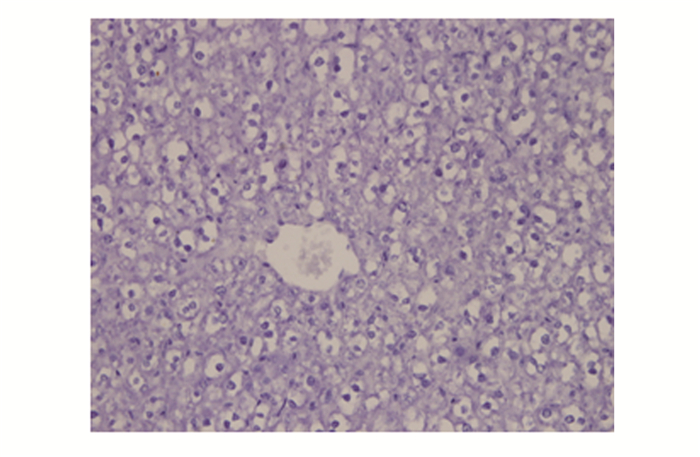
对照组小鼠肝脏组织中iNOS和p53蛋白均为阴性表达,照射后各组小鼠肝脏组织中均有iNOS和p53蛋白的阳性表达。照射后不同时间点,iNOS和p53蛋白的表达差异有统计学意义(P<0.01)。iNOS和p53蛋白的表达呈现正相关关系[相关系数(r)为0.797,P<0.01]。见表 2。照射后6 h组p53蛋白和iNOS蛋白的表达情况见图 1、2。

|
图 1 照射后6 h组p53蛋白的表达 (SABC法,×400) |
|
图 2 照射后6 h组iNOS的表达s (SABC法,×400) |
|
|
表 2 致死剂量照射后肝脏组织iNOS和p53蛋白的变化 |
NO是一种极不稳定的生物自由基,相对分子质量小,结构简单,常温下为气体,微溶于水,具有脂溶性,可快速透过生物膜扩散,生物半衰期只有3~5 s[3]。近年来,越来越多的证据表明,NO可能在人体机能的许多方面发挥作用。在生理条件下产生的NO具有舒张血管、心肌保护、脑保护等有益作用;但在应激情况下产生的NO参与疾病的病理过程,发挥其细胞毒性作用,例如NO可通过作用于巯基、与超氧阴离子反应或直接损伤DNA等加重细胞损伤[4-5]。
电离辐射的照射可以引起全身多器官系统的损伤,包括对肝脏的损伤。那么作为自由基之一的NO在辐射引起的肝脏损伤中终究发挥什么样的作用?基于此,笔者观察了致死剂量照射情况下小鼠肝脏组织NO水平的变化情况。结果显示,肝脏组织中NO水平在照射后呈现先升高后降低的趋势。和照射前比较,照射后6 h时,肝脏组织中NO水平开始升高并一直持续到照射后9 h,差异有统计学意义(P<0.05),照射后12 h肝脏组织中NO水平降至正常参考值范围(P>0.05)。这些结果显示,致死剂量的电离辐射能诱导动物肝脏组织中NO水平升高,从而发挥对肝脏组织的破坏作用。
体内NO的生成依赖于NOS。NOS有3种形式存在:即在正常状态下表达的神经元型NOS(nNOS)、内皮型NOS(eNOS)以及在损伤后诱导表达的iNOS。iNOS反映应激情况下NO的合成情况[6]。笔者用SABC法观察致死剂量照射后iNOS和p53蛋白的变化,并研究了两者的相关性,以期今后进一步探索辐射情况下NO影响细胞功能的上下游信号分子,例如肿瘤坏死因子(TNF)、γ干扰素等。结果表明,照射后肝脏组织中iNOS和p53蛋白的表达随时间的推移而升高,在照射后6 h时达到最高,并持续一段时间,并于照射后12 h下降,这与NO的表达相一致,且iNOS和p53蛋白间的表达存在正相关关系(r=0.797,P<0.01)。与杨岚等[7]对口腔鳞癌的研究结果一致。NO激活p53蛋白其可能的机制是,当机体受到电离辐射时,iNOS表达升高,产生NO,NO造成细胞DNA损伤时,可触发p53蛋白蓄积,进而引起下游信号通路改变,发生不同的效应。与蒋磊等[8]研究运动对大鼠心肌细胞及NOS的影响结果相类似,即NO的激活可以增加p53蛋白的表达。
因此,笔者认为辐射能引起动物肝脏组织损伤的途径之一是诱导肝脏组织中NO的水平变化,其进一步的机制可能是诱导p53蛋白的变化,并进一步引起其下游分子的改变导致相应的细胞效应。由于本文仅是对动物辐射损伤后NO水平变化情况进行初步观察,对其更详细的调控机制及细胞损伤效应未能进入深入的探讨,这将是今后进一步研究的方向。
| [1] |
郑辉, 甄荣, 廖京辉, 等. 辐射损伤后不同阶段细胞内外一氧化氮和总抗氧化能力变化的实验观察[J]. 中华放射医学与防护杂志, 2007, 27(6): 546-548. DOI:10.3760/cma.j.issn.0254-5098.2007.06.009 |
| [2] |
Lee HC, An S, Lee H, et al. Activation of epidermal growth factor receptor and its downstream signaling pathway by nitric oxide in response to ionizing radiation[J]. Mol Cancer Res, 2008, 6(6): 996-1002. DOI:10.1158/1541-7786.MCR-08-0113 |
| [3] |
Hirst DG, Robson T. Nitric oxide physiology and pathology[J]. Methods Mol Biol, 2011, 704: 1-13. DOI:10.1007/978-1-61737-964-2 |
| [4] |
Ilmarinen-Salo P, Moilanen E, Kankaanranta H. Nitric oxide induces apoptosis in GM-CSF-treated eosinophils via caspase-6-dependent lamin and DNA fragmentation[J]. Pulm Pharmacol Ther, 2010, 23(4): 365-71. DOI:10.1016/j.pupt.2010.04.001 |
| [5] |
Rothkamm K, Burdak-Rothkamm S. Ionizing radiation-induced DNA strand breaks and γ-H2AXγ-H2AX foci in cells exposed to nitric oxide[J]. Methods Mol Biol, 2011, 704: 17-25. DOI:10.1007/978-1-61737-964-2 |
| [6] |
Singh S, Gupta AK. Nitric oxide:role in tumour biology and iNOS/NO-based anticancer therapies[J]. Cancer Chemother Pharmacol, 2011, 67(6): 1211-1224. DOI:10.1007/s00280-011-1654-4 |
| [7] |
杨岚, 王友元, 王丽萍, 等. iNOSP53在口腔鳞癌中的表达及与预后的关系[J]. 安徽医学, 2013, 34(3): 245-248. DOI:10.3969/j.issn.1000-0399.2013.03.005 |
| [8] |
蒋磊, 周振茂, 夏美燕, 等. 运动对大鼠心肌细胞与一氧化氮合酶的影响[J]. 西北农林科技大学学报:自然科学版, 2013, 41(6): 8-12. |




