2. 南方医科大学南方医院放疗科;
3. Inviscan SAS, France Strasbourg;
4. 电子科技大学医学院附属四川省肿瘤医院(研究所)放疗科;
5. 陕西省人民医院呼吸内二科;
6. 浙江省肿瘤医院放射肿瘤学重点实验室
2. Dept. Radiation Oncology, Nanfang Hospital, Southern Medical University;
3. Inviscan SAS, Strasbourg;
4. Dept. Radiation Oncology, Sichuan Cancer Hospita;
5. Zhejiang Key Lab of Radiation Oncology, Zhejiang Cancer Hospital
放射性肺损伤(radiation-induced lung injury, RILI)是肺癌及其他胸部纵膈肿瘤(如食道癌、淋巴瘤、乳腺癌等)放射治疗后常见的并发症之一[1-2]。由于放疗过程中受肿瘤位置、病灶大小、侵犯范围、受累及高危淋巴结与呼吸动度影响,将不可避免地造成部分正常肺组织处于较高的治疗剂量范围内,放射性肺炎或者纤维化是临床上影响胸部肿瘤放疗计划与患者预后的重要因素[2-3]。小鼠放射性肺损伤的发生过程及时间规律与临床患者出现的病理生理学改变较为相似,是迄今为止研究这一重要问题的关键模型, 尤其在控制射线剂量肺部毒副作用[4-8]与抗放射性肺炎及纤维化药物研究[9-12]中具有不可替代的作用。除此之外,放射性肺损伤小鼠模型因其极为相似的慢性炎症和纤维化病理改变,使其成为研究特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)这一疑难疾病机制的理想模型。特发性肺纤维化是一种原因不明的、以弥漫性肺泡炎和肺泡结构紊乱最终导致肺间质纤维化为特征的疾病[13],在全世界范围内发病率呈逐年上升的趋势[14-15]。IPF造成肺组织不可逆转地丧失氧气交换的能力,急性IPF目前国际上尚无有效治疗药物且多于6个月内使患者死于呼吸循环衰竭。
受制于小鼠肺部体积(最大径 < 1 cm)及周围临近脏器限制,全肺野照射通常需经腹腔或静脉麻醉后使用小动物精确放疗系统(IGRT)完成辐照。由于价格较为昂贵且耗时费力,目前全国仅引进数台IGRT小动物辐射仪。另一方面,采用IGRT小动物辐射仪每次最多能容纳三只小鼠,加上X射线球管由于自身降温需要,每日能完成照射的小鼠数量有限。基于上述原因,IGRT无法满足多次分割的照射计划(如2 Gy×25-fx)或大规模前临床药物试验(如抗放射性肺损伤药物、潜在肺毒性药物等)。因此,探索低成本、快速大批量精准照射的有效方法,对于普及小鼠放射性肺损伤这一重要放射生物学模型具有重要的实际意义。本研究拟结合无创通气麻醉(如异氟醚、七氟醚、安氟醚等)、精确影像学肺部体积测量、标准化胸腔暴露等创新手段建立整套照射固定装置,以期借助常规医用直线加速器能完成批量小鼠精准肺野照射,为更好开展放射性肺损伤研究奠定实验基础。
1 材料与方法采用8~10周龄C57BL6雌性小鼠,SPF级饲养,购自北京维通利华实验动物技术有限公司(许可证号:SCXK(京)2012-0001)。于南方医科大学实验动物中心饲养,温度(23±1)℃,相对湿度55%±5%,压力差≤10 Pa,每日光照12 h,自由摄食饮水。照射前将小鼠放置入充满异氟烷(Isoflurane)雾化气体的诱导盒,经小动物气体吸入式麻醉机给予气体麻醉(300~500 ml/min)。小鼠深度麻醉转移至本研究设计的专用胸部照射装置并妥善固定,胸腔保持与治疗床平行。照射装置主体采用聚甲基丙烯酸甲酯材料(Poly-methylmethacrylat),可避免X射线射入后散射后造成小鼠吸收剂量(absorbed dose)误差。装置配有1:1雾化麻醉气体面罩,可保证每只小鼠均获得雾化混合异氟烷气体,达到麻醉与肌松作用以确保照射实验顺利进行。本胸部照射装置一次可同时容纳20只小鼠的全肺照射实验,但亦可根据不同实验要求进一步增加槽孔数量从而扩大小鼠照射规模。采用放疗科常规医用直线加速器(Siemens Artiste Linac)进行照射。照射剂量可根据不同实验要求自由设置调整。
使用小动物显微CT成像系统(In vivo micro-CT SkyScan)进行胸部断层成像和三维重建[16]。CT扫描采集参数如下:管电压40kV,阳极电流0.4 mA,图像被重建为256×256×512矩阵,体素尺寸(voxel size)0.13 mm。CT图像采用OsiriX Imaging软件(OsiriX v.3.9.4 version)进行图像后处理与分析。
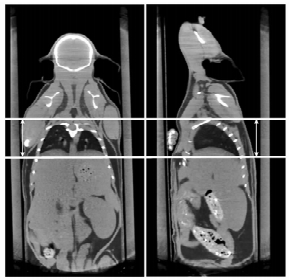
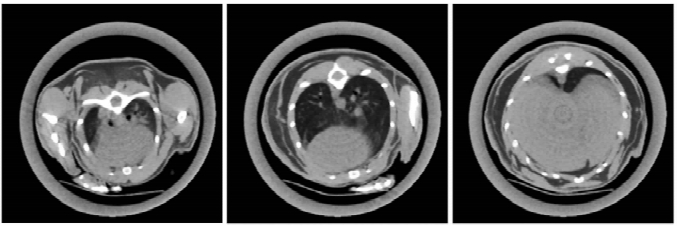
2 结果照射范围与呼吸动度是小鼠全肺野照射中的首先考虑因素。Micro-CT扫描成像后进行三维重建,在影像学水平首先确定小鼠肺结构在冠状位(图 1,左)及矢狀位图像上(图 1,右)的解剖位置与尺寸(取12只小鼠的平均值)。并根据小鼠呼吸频率及幅度确定平时及深度麻醉情况下受呼吸动度影像的肺部位置及尺寸动态改变规律。确保小鼠接受照射时既包全肺部动态范围,又不增加邻近脏器毒性,如肝脏、胃及肠管等。接着进一步根据CT断层图像分析,分别确定了肺部照射范围上界包括肺尖(图 2,左),中线(图 2,中)以及与肺下界(图 2,右),并将以上影像学测量尺寸以刻度的形式标记于专门设计的肺野照射装置,用来指导激光线定位与实际操作。
|
图 1 小鼠肺结构在CT冠状位与矢状位的图像上的定量测量与照射野的确定 |
|
图 2 小鼠全肺照射野的上界、中线、下界及对应临近解剖结构在CT轴位图像上的显示 |
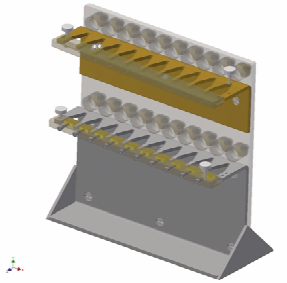
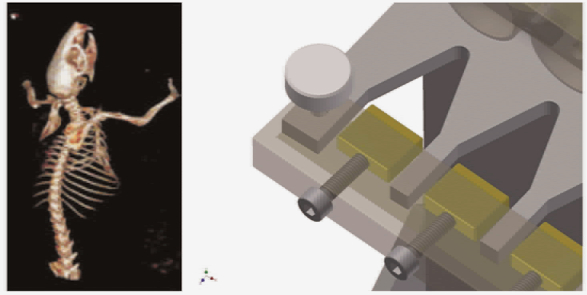
该肺野照射固定装置采用聚甲基丙烯酸甲酯(Poly-methylmethacrylat)为主要材料,大致可分为小鼠固定架和麻醉通气系统两部分构成(图 3)。固定架由前固定(固定凹槽)和后固定(可活动)两部分组成。固定凹槽的空间(横径与长径)正好容纳一只小鼠的胸腔,如3D效果图(图 4,左)所示姿势放置入固定凹槽,双上肢置于上方,胸腔及以下位于固定槽下方。这样小鼠胸腔部分得以完整暴露出来。后固定部分由一块可移动条与每排10个可调节弹力栓组成(图 4,右)。弹力栓的作用是可根据小鼠的不同体积大小可任意调整后方弹性栓子力度、确保小鼠得以妥善固定又不影响其正常呼吸。
|
图 3 无创吸入式麻醉精准肺野照射装置示意图 |
|
图 4 照射过程中小鼠固定姿势与固定架(前固定与后固定)详细结构 |
固定架上方是麻醉雾化面罩,每只面罩适合容纳小鼠头部范围,并经内置管道提供来自小动物气体吸入式麻醉机的雾化异氟烷与空气混合气体。在整个照射过程中全程给予麻醉气体直至照射结束。该混合气体具有麻醉镇静及肌松作用,确保实验过程中小鼠处于深度麻醉、均匀呼吸动度,也可以避免因骨骼肌兴奋造成照射中的摆位误差。
3 讨论放射性肺损伤小鼠模型在长期以来在肺纤维化机制、放射生物学及抗肺损伤药物前临床研究等领域被广泛使用[17-18]。然而,由于照射技术、设备及方式各异,不可避免导致不同实验室之间实验数据的不均质性,也为横向比较研究造成了一定障碍。照射过程中受照射范围、固定方式、麻醉时间与深度等各种实际状况所限,使得小鼠肺损伤模型在辐照环节上一直未能形成精准、高效、低成本的标准化手段。本研究设计了一种小鼠“简易填装”、“弹匣式”的胸腔照射固定及定位装置,借助常规医用加速器即可开展大批量小鼠照射实验。
腹腔、静脉及肌肉注射麻醉(如戊巴比妥钠、氯胺酮、氨基甲酸乙酯)是动物实验及手术中较为普遍的麻醉方式。但由于小鼠自身个体差异、体重影响、麻醉给药速度及用量不当、反复麻醉次数过多等各方面因素,该方式较容易出现麻醉意外,如呼吸、心跳改变甚至过量导致死亡。具体原因可由于麻醉药物毒性引起神经系统抑制,从而导致心血管和呼吸抑制并诱导体温显著降低[19]。也可因肌松剂过量造成呼吸肌麻痹导致呼吸骤停。本研究在诱导麻醉和照射过程中全程采用无创气体麻醉,相比较注射麻醉而言简便易行、剂量(流速)可控、麻醉过程中稳定不易苏醒、停药后苏醒快。而常用麻醉剂如异氟醚、七氟醚、氟烷是国际上公认的安全较高的吸入性麻醉剂[20-21]。从诱导麻醉到照射完成一般需要15~20 min,在此期间内采用气体麻醉相较于常规注射麻醉对实验动物的安全性显著提高。
另外需值得注意的是,小鼠体积微小,照射中稍有不慎引起的位置的偏倚,有可能造成高剂量射线照到肺部以外其他脏器组织如头部及消化道系统。这种情况既会影响到实验结果准确性,重则引起小鼠意外死亡导致实验失败。本研究设计装置采用内置通气管道连接面罩,麻醉稳定性比静脉麻醉得以提高,一定程度上减少了麻醉过程中呼吸频率、幅度的明显改变及骨骼肌发生不自主颤动的情况,从而明显降低了照射过程的摆位误差、增加照射稳定性。
肺野照射装置的固定架部分也具有一定增加安全性与照射稳定性的作用。小鼠上肢及以上部分本牢牢控制在固定架以上,确保了颈部及头部位置的相对固定且距离照射野具备一定的安全距离(如图一、图四所示)。头部器官是小鼠放射敏感性最高的部位,采取有利姿势有助增加照射中的安全性。
综上所述,小鼠放射性肺损伤模型是研究临床放射性肺炎与纤维化以及特发性肺纤维化的理想模型。本研究所设计的集麻醉、固定、定位为一体的“弹匣式”小鼠肺野照射装置,可显著增加胸部放射实验的准确性、简易性、安全性、稳定性和高效性。大幅减低实验成本的同时、也减少了对IGRT小动物辐照仪的依赖性,依靠临床常规加速器就能开展高精度、大批量小鼠全肺野照射,具有一定的科研应用及推广价值。
| [1] |
Graves PR, Siddiqui F, Anscher MS, et al. Radiation pulmonary toxicity:from mechanisms to management[J]. Seminars in radiation oncology, 2010, 20: 201-207. DOI:10.1016/j.semradonc.2010.01.010 |
| [2] |
Mehta V.. Radiation pneumonitis and pulmonary fibrosis in non-small-cell lung cancer:pulmonary function, prediction, and prevention, International journal of radiation oncology[J]. biology, physics, 2005, 63: 5-24. |
| [3] |
Marks L, Yu X, Vujaskovic Z, et al. Radiation-induced lung injury[J]. Seminars in Radiation Oncology, 2003, 13: 333-345. DOI:10.1016/S1053-4296(03)00034-1 |
| [4] |
Zhou C, Jones B, Moustafa M, et al. Abdollahi, Quantitative assessment of radiation dose and fractionation effects on normal tissue by utilizing a novel lung fibrosis index model[J]. Radiat Oncol, 2017, 12: 172. DOI:10.1186/s13014-017-0912-y |
| [5] |
Travis EL, Tucker SL. Isoeffect models and fractionated radiation therapy, International journal of radiation oncology[J]. biology, physics, 19887, 13: 283-287. |
| [6] |
Travis EL, Thames HD, Watkins TL, et al. The kinetics of repair in mouse lung after fractionated irradiation, International journal of radiation biology and related studies in physics[J]. chemistry and medicine, 1987, 52: 903-919. |
| [7] |
Douglas BG, Fowler JF. The effect of multiple small doses of X rays on skin reactions in the mouse and a basic interpretation[J]. Radiat Res, 2012, 178: AV125-138. DOI:10.1667/RRAV10.1 |
| [8] |
Douglas BG, Fowler JF. Letter:Fractionation schedules and a quadratic dose-effect relationship[J]. The British journal of radiology, 1975, 48: 502-504. DOI:10.1259/0007-1285-48-570-502 |
| [9] |
Abdollahi A, Li M, Ping G, et al. Inhibition of platelet-derived growth factor signaling attenuates pulmonary fibrosis[J]. The Journal of experimental medicine, 2005, 201: 925-935. DOI:10.1084/jem.20041393 |
| [10] |
Bickelhaupt S, Erbel C, Timke C, et al. Effects of CTGF Blockade on Attenuation and Reversal of Radiation-Induced Pulmonary Fibrosis[J]. J Natl Cancer Inst, 2017, 109. |
| [11] |
Flechsig P, Dadrich M, Bickelhaupt S, et al. LY2109761 attenuates radiation-induced pulmonary murine fibrosis via reversal of TGF-beta and BMP-associated proinflammatory and proangiogenic signals[J]. Clinical cancer research:an official journal of the American Association for Cancer Research, 2012, 18: 3616-3627. DOI:10.1158/1078-0432.CCR-11-2855 |
| [12] |
Rube CE, Uthe D, Schmid KW, et al. Dose-dependent induction of transforming growth factor beta (TGF-beta) in the lung tissue of fibrosis-prone mice after thoracic irradiation, International journal of radiation oncology[J]. biology, physics, 2000, 47: 1033-1042. |
| [13] |
TJ Gross, Hunninghake GW. Idiopathic pulmonary fibrosis[J]. N Engl J Med, 2001, 345: 517-525. DOI:10.1056/NEJMra003200 |
| [14] |
Navaratnam V, Fleming KM, West J, et al. The rising incidence of idiopathic pulmonary fibrosis in the U.K[J]. Thorax, 2011, 66: 462-467. DOI:10.1136/thx.2010.148031 |
| [15] |
Nalysnyk L, Cid-Ruzafa J, Rotella P, et al. Incidence and prevalence of idiopathic pulmonary fibrosis:review of the literature[J]. Eur Respir Rev, 2012, 21: 355-361. DOI:10.1183/09059180.00002512 |
| [16] |
Zhou C, Bauer J, Brons S, et al. Development of non-invasive CT scan based monitoring in studying pulmonary toxicity induced by whole thoracic irradiation[J]. Int J CARS, 2013, 8: S265-266. |
| [17] |
Yamaguchi Y, Takihara T, Chambers RA, et al. A peptide derived from endostatin ameliorates organ fibrosis[J]. Sci Transl Med, 2012, 4: 136-171. |
| [18] |
Travis EL. Organizational response of normal tissues to irradiation[J]. Semin Radiat Oncol, 2001, 11: 184-196. DOI:10.1053/srao.2001.25243 |
| [19] |
Tremoleda JL, Kerton A, Gsell W. Anaesthesia and physiological monitoring during in vivo imaging of laboratory rodents:considerations on experimental outcomes and animal welfare[J]. EJNMMI Res, 2012, 2: 44. DOI:10.1186/2191-219X-2-44 |
| [20] |
Delgado-Herrera L, Ostroff RD, Rogers SA. Sevoflurance:approaching the ideal inhalational anesthetic. a pharmacologic, pharmacoeconomic, and clinical review[J]. CNS Drug Rev, 2001, 7: 48-120. |
| [21] |
Johnson RA, Striler E, Sawyer DC, et al. Comparison of isoflurane with sevoflurane for anesthesia induction and recovery in adult dogs[J]. Am J Vet Res, 1998, 59: 478-481. |




