2. 天津中医药大学第一附属医院
2. First Teaching Hospital of Tianjin University of Tradiational Chinese Medicine
急性电离辐射对机体造成一系列严重的损伤,其中以造血系统最为敏感[1]。辐射损伤后,造血系统的功能恢复和重建在辐射损伤救治中占十分重要地位。造血系统辐射损伤的主要远期效应之一就是造血衰老,表现为造血干细胞(hematopoietic stem cell, HSC)自我更新能力下降或丧失的辐射远期损伤效应,即长期骨髓抑制。因此,寻找辐射损伤后恢复机体造血功能的方法对辐射损伤救治有重大意义。
急性辐射损伤在中医理论里属于火毒,毒火炽盛,直中脏腑,患者肾阴亏虚,肝阳上亢而致恶心呕吐,肾精亏虚,生髓乏源,导致骨髓空虚,无法化生血液,最终气阴两伤[2]。中药复方抗衰片(主要成分有丹参、桑寄生、何首乌、淫羊藿、杜仲、茯苓、菖蒲、龟甲、党参等,缩写为KS)具有健脾益肾等功效,可以调和阴阳,填精补髓。间充质干细胞(mesenchymal stem cells, MSC)是一种骨髓基质细胞,具有支持、调节造血干细胞的功能[3-6],是造血干细胞龛(也称为微环境)的主要组成成分。我们的前期研究发现,KS对MSC的增殖具有促进作用[7],因此,我们希望通过KS作用间充质干细胞,继而调节HSC的造血,提高电离辐射损伤的救治效果。
本实验研究复方抗衰片及其核心单药CP对辐射损伤修复的影响。
1 材料与方法 1.1 实验动物C57BL/6小鼠,雄性,9~10周龄,SPF级饲养,购自北京维通利华实验动物技术有限公司(许可证号:SCXK(京)2012-0001)。于中国医学科学院放射医学研究所SPF级动物实验中心饲养,温度(23±1)℃,相对湿度55%±5%,压力差≤10 Pa,每日光照12 h,自由摄食饮水。
1.2 主要试剂MesenCult® MSC Basal Medium (Mouse;STEMCELLTECHNOLOGIES公司,产品号:05501);MesenCult® MSCStimulatory Supplements(Mouse;STEMCELL公司,产品号:05502);IMDM培养基(Gibco公司);DMEM培养基(Gibco公司);胎牛血清(FBS,HyClone公司);胰蛋白酶(Invitrogen公司);抗衰片(天津中医药大学第一附属医院);硫酸新霉素(上海阿拉丁生化科技股份有限公司)。
1.3 主要仪器pocH-100i自动血细胞计数仪(日本希森美康株式会);社超净工作台(苏州净化SW-CJ-2FD);CO2培养箱(NAP-CO MODEL 5410);倒置显微镜(OLYMPUS IM);137Cs γ射线照射源(加拿大原子能有限公司,Gammacel 40)。
1.4 实验方法 1.4.1 KS药液配制抗衰片7.5 g,去离子水50 mL。煮沸,15 min,离心取上清,4℃保存备用。
1.4.2 CP药液配制CP13.5 g,去离子水50 mL,煮沸15 min,离心取上清,4℃保存备用。
1.4.3 外周血监测48只C57BL/6小鼠,按随机数表法分为空白对照组、照射组、照射+KS组、照射+CP组,每组12只。照射组、照射+KS组、照射+CP组进行5.5 Gy 137Cs γ射线单次全身照射,剂量率1 Gy/min。照射后各组小鼠饮水中均加入1.1 g/L硫酸新霉素预防感染。照后各组每隔一天灌胃给药两天,每天一次,空白对照组和照射组给生理盐水0.2 mL,照射+KS组给KS药液0.2 mL,照射+CP组给CP药液0.2 mL。从照射后1个月起,每月眼内眦取血监测血常规变化,同时观察小鼠毛色及行为。
1.4.4 间充质干细胞克隆(CFU-F)形成实验48只小鼠,按随机数表法分为:给药空白对照组(给药空白)、给药照射组(给药-)、照射+KS组、照射+CP组,每组12只。给药、KS、照射+CP组进行5.5 Gy 137Cs-γ射线单次全身照射,剂量率1 Gy/min。照射后给药空白和给药-组每天给生理盐水0.2 mL灌胃,照射+KS组每天给KS药液0.2mL灌胃,连续给4周。4周后颈椎脱臼处死小鼠,无菌条件下取小鼠双侧股骨和胫骨,剔除其上附着的肌肉和结缔组织。用含2%FBS的IMDM冲出骨髓,制成单细胞悬液,计数有核细胞。按2×106个细胞/孔接种于6孔板,每组设3个复孔。第9 d计数每孔克隆形成数,大于50个细胞计数为一个克隆。
2 实验结果 2.1 外周血结果照射后,3组照射的小鼠精神萎靡、毛色暗淡,2个月后基本恢复,4个月后,照射的3组小鼠毛色变花白,空白对照仍为黑色。在实验中空白对照组白细胞总数及白细胞分类中的淋巴细胞持续下降,另外3组在照后1月至照后2月中白细胞及淋巴细胞显著升高,之后基本持平。空白对照组的中性粒细胞在实验中变化不大,而另外3组中性粒细胞在照后1个月至照后3个月持续升高,之后数量略微下降。照射后一个月,照射组、照射+KS组和照射+CP组的白细胞总数(空白对照组、照射组、照射+KS组和照射+CP组分别为10.83±2.28、4.13±1.07、5.20±1.17和5.63±1.44)以及白细胞分类中的中性粒细胞(空白对照组、照射组、照射+KS组和照射+CP组分别为2.78±1.50、0.64±0.56、0.80±0.44和1.24±1.11)和淋巴细胞(空白对照组、照射组、照射+KS组和照射+CP组分别为8.05±1.19、3.48±0.67、4.38±0.82和4.39±1.08)都显著低于空白对照组(P < 0.05),但是照射+KS组和照射+CP组的白细胞总数(见图 1)和淋巴细胞数(见图 3)高于照射组(P < 0.05)。照射后两个月,照射+KS组的白细胞(9.66±1.43,见图 1)和中性粒细胞(2.06±0.55,见图 2)高于照射组(白细胞7.59±0.77,中性粒细胞1.83±0.58)(P < 0.05)。照射五个月后,各组数据趋于一致,仅有照后6个月时照射+BS组中性粒细胞高于照射组。这说明KS和CP都可以在电离辐射损伤后短期内促进造血功能的恢复。而在3个月后,辐射造成的损伤已基本修复,KS和CP这两种药物也就不再对外周血起作用。
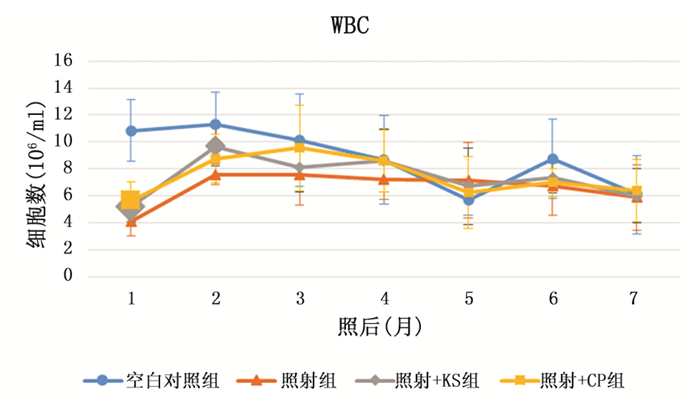
|
图 1 外周血白细胞数变化趋势图(较大的标记代表差异有统计学意义) |
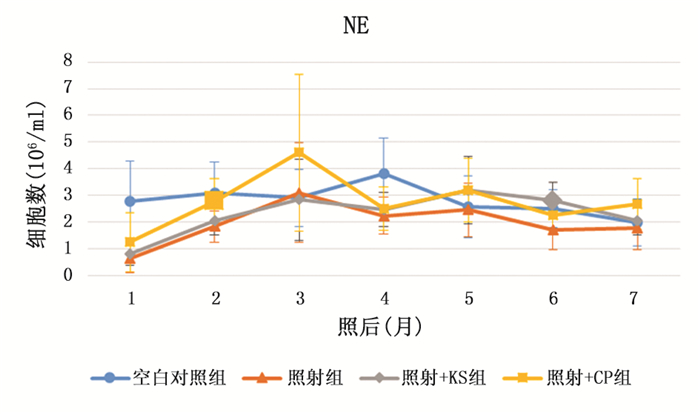
|
图 2 外周血中性粒细胞数变化趋势图(较大的标记代表差异有统计学意义) |
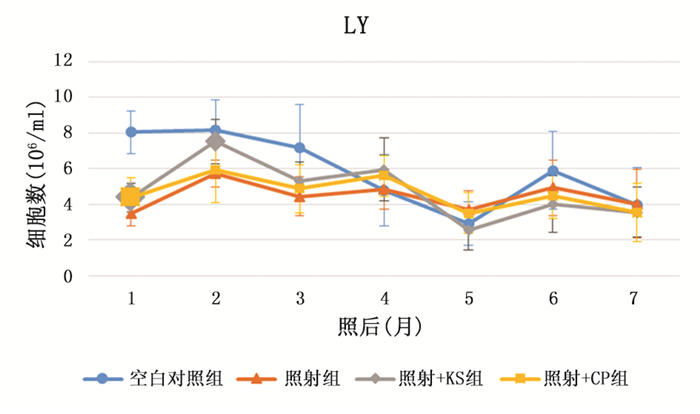
|
图 3 外周血淋巴细胞数变化趋势图(较大的标记代表差异有统计学意义) |
照射+KS组与照射+CP组均高于照射组(P < 0.05),其中照射+KS组低于空白对照组(P < 0.05),而照射+CP组与空白对照组差距不明显(P>0.05),说明KS和CP均有保护间充质干细胞的作用。见图 4。
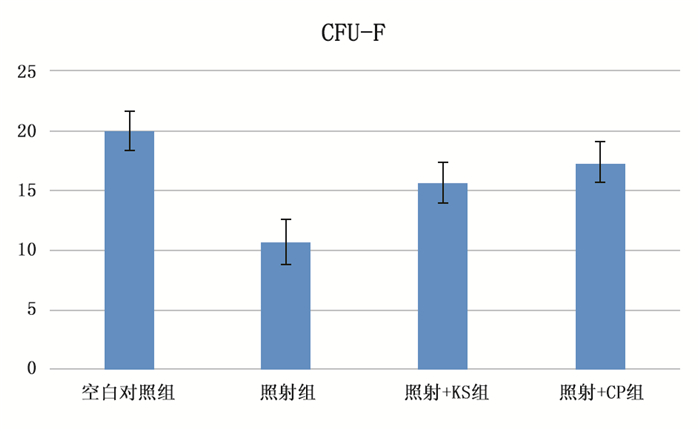
|
图 4 CFU-F结果 |
骨髓造血功能的维持依赖于造血干细胞和造血干细胞龛的相互作用[8]。电离辐射在损伤骨髓造血干细胞的同时,也会损伤造血干细胞所在的骨髓造血微环境(即造血干细胞龛)。骨髓造血干细胞龛包括骨髓中的血管内皮细胞、脂肪细胞、成纤维细胞、间充质干细胞、成骨细胞、巨噬细胞等多种非造血细胞和细胞外基质[9]。其中间充质干细胞可以分泌多种细胞外因子,如SCF等,调节造血干细胞功能。间充质干细胞还可以通过细胞表面信号分子调节造血干细胞,如Jagged-1[9-12],此外间充质干细胞还具有向其它骨髓基质细胞分化的能力,可以分化为脂肪细胞、软骨细胞和成骨细胞[13],进一步参与造血干细胞龛对HSC的支持和调控作用。因此,间充质干细胞是重要的骨髓基质细胞成分,是造血干细胞龛的重要组成部分。
本实验对接受亚致死剂量γ射线照射的小鼠给予对间充质干细胞具有调节作用的KS和CP,以期通过调节造血干细胞龛活性来调控骨髓造血能力。外周血中白细胞寿命较短,其中淋巴细胞寿命大约3-5 d,中性粒细胞平均只在血液中停留6-8 h,其数量对造血功能的变化较为敏感,常用来反映造血功能。实验中空白对照组小鼠白细胞总数和淋巴细胞数的持续下降是小鼠年龄增长(衰老)造成的正常现象[14],另外3组照射的小鼠在2个月后恢复速度放缓,是因照后白细胞总数和淋巴细胞数的恢复与其自然减少相互抵消,所以变化不大。本实验中可以看到,在照射后一个月,照射+KS组和照射+CP组白细胞和淋巴细胞高于照射组,而随着小鼠造血的逐步恢复各组差距逐渐减小,最终消失。同时KS和CP都能促进间充质干细胞的增殖。可以推测,KS、CP是通过作用间充质干细胞调节造血微环境,进而调节造血干细胞的功能,促进外周血白细胞、淋巴细胞数量等的恢复。本实验中所用的CP为单药,更有利于在后续的研究中对药效成分进行系统分析和相关机制研究。
现有的抗辐射损伤药物大多需要在受照前或受照后立即给药,这限制了它们在核意外事故中的应用。KS和CP在照后给药可以促进造血重建,提高患者白细胞水平,降低感染几率,这对于意外受照患者的救治有重要意义。
综上所述,KS和CP可以通过间充质干细胞调节造血功能,促进辐射后的造血恢复。其调节造血的具体机制仍不十分明确,需要进一步进行分子水平实验来探讨。
| [1] |
关雪晶, 吴宏, 何晓莉, 等. 当归多糖对辐射损伤小鼠骨髓基质细胞的影响[J]. 第三军医大学学报, 2013, 35(08): 779-783. |
| [2] |
张蓉, 骆斌, 李峰, 等. 从毒邪致病论电离辐射损伤的中医病机[J]. 北京中医药大学学报, 2007(09): 595-596. DOI:10.3321/j.issn:1006-2157.2007.09.006 |
| [3] |
魏伟, 许超, 叶志勇, 等. 混合培养体系中间充质干细胞与造血干细胞生物学特性[J]. 生理学报, 2016, 68(05): 691-698. |
| [4] |
Goulard M, Dosquet C, Bonnet D. Role of the microenvironment in myeloid malignancies[J]. Cellular and Molecular Life Sciences, 2017, 1-15. |
| [5] |
Yao J C, Link D C. Concise review:the malignant hematopoietic stem cell niche[J]. Stem Cells, 2017, 35(1): 3-8. |
| [6] |
Münz F, Perez R L, Trinh T, et al. Human mesenchymal stem cells lose their functional properties after paclitaxel treatment[J]. Scientific reports, 2018, 8(1): 312. DOI:10.1038/s41598-017-18862-1 |
| [7] |
康肖梦, 王华伟, 杜利清, 等. 抗衰片对电离辐射损伤后小鼠骨髓造血作用的影响[J]. 天津医药, 2016, 44(01): 59-62. |
| [8] |
Morrison S J, Scadden D T. The bone marrow niche for haematopoietic stem cells[J]. Nature, 2014, 505(7483): 327. DOI:10.1038/nature12984 |
| [9] |
Spees J L, Lee R H, Gregory C A. Mechanisms of mesenchymal stem/stromal cell function[J]. Stem cell research & therapy, 2016, 7(1): 125. |
| [10] |
Gama-Norton L, Ferrando E, Ruiz-Herguido C, et al. Notch signal strength controls cell fate in the haemogenic endothelium[J]. Nature communications, 2015, 6: 8510. DOI:10.1038/ncomms9510 |
| [11] |
Nakamura Y, Arai F, Iwasaki H, et al. Isolation and characterization of endosteal niche cell populations that regulate hematopoietic stem cells[J]. Blood, 2010, 116(9): 1422-1432. DOI:10.1182/blood-2009-08-239194 |
| [12] |
Frenette P S, Pinho S, Lucas D, et al. Mesenchymal stem cell:keystone of the hematopoietic stem cell niche and a stepping-stone for regenerative medicine[J]. Annual review of immunology, 2013, 31: 285-316. DOI:10.1146/annurev-immunol-032712-095919 |
| [13] |
Hu K, Sun H, Gui B, et al. TRPV4 functions in flow shear stress induced early osteogenic differentiation of human bone marrow mesenchymal stem cells[J]. Biomedicine & Pharmacotherapy, 2017, 91: 841-848. |
| [14] |
赵凯, 杨星宇, 万颖寒, 等. 小鼠骨髓造血干细胞、外周血组成随年龄的变化趋势及其相关性分析[J]. 中国细胞生物学学报, 2011, 33(11): 1213-1219. |


