2. 天津医科大学总医院放射治疗科
2. Department of Radiation Oncology, Tianjin Medical University General Hospital
肺癌是目前最主要的肿瘤相关性死亡的病因[1]。放疗目前是中晚期肺癌的主要治疗手段之一。虽然随着放疗技术的进步,中晚期肺癌患者的局部控制率已取得明显的提高,然而在部分中晚期患者中,其局部控制率仍较低,5年生存率为10%~20%,其治疗失败的主要原因在于局部复发[2]。其中,肿瘤细胞的放疗抵抗是其主要制约因素之一。因此,探索有效的放疗增敏药物已成为当今解决肿瘤细胞放疗抵抗的热点研究。
二甲双胍作为一种被广泛应用于2型糖尿病的经典降糖药物,其安全性好,价格低廉。最近流行病学研究揭示二甲双胍能降低糖尿病患者的肿瘤风险[3]。一些临床前的研究已经证实二甲双胍在体内外均具有抗肿瘤作用[4]。然而,二甲双胍在肺癌细胞中增敏放疗的机制仍不清楚。
本研究中,我们主要探索二甲双胍对肺癌A549细胞的放疗增敏作用的机制,我们初步研究结果显示二甲双胍增敏放疗的机制是降低放疗相关的G2检查点及抑制DNA损伤修复。我们的研究结果为二甲双胍作为一种有效的放射增敏剂提供有力的理论依据。
1 材料与方法 1.1 细胞培养购买人非小细胞肺腺癌细胞系A549(ATCC)。将A549细胞培养在DMEM培养基中(Gibco),加入10%胎牛血清(Gibco),100 U /ml青霉素和100 μg/ml链霉素(Gibco),在37℃,含有5%二氧化碳培养箱中静置培养。每2~3天换液1次,待细胞生长到70%~80%融合后行传代,传代后的细胞生长到10%左右使用X射线照射后用于克隆形成试验。二甲双胍购自Sigma并且在每次使用前用新的样品溶解于DMEM培养基中。
1.2 细胞活力测定将A549细胞接种在96孔板中,第二天用不同浓度的二甲双胍(2.5~160 mM)处理。A549细胞暴露于二甲双胍中24 h后,给予其染色并使用Cell Counting Kit-8(Dojindo)制造商的方案,在450 nm下对96孔板行读数,计数后统计。
1.3 克隆集落形成实验在0~6 Gy放疗之前,用或不用5 mM二甲双胍处理A549细胞24 h。在放疗后立即处理细胞,并稀释(大概每孔培养细胞数目约4000个)再铺板到60 mm培养皿中,每次处理均为一式三份。在无药物培养基中温育10~14 d后,将细胞固定并用含无水甲醇0.5%的结晶紫染色,并在显微镜下计数克隆菌落形成数目(>50个为一菌落形成),随后计算克隆形成率,根据0、2、4、6 Gy剂量点使用线性二次模型回归方法绘制细胞存活曲线。
1.4 流式细胞仪技术将A549细胞暴露于5 mM二甲双胍24 h,并进行6 Gy的放疗或不放疗。对于细胞周期分析,在放疗后24 h,将细胞用胰蛋白酶溶解,后用PBS洗涤2次,固定在70%冰冷的乙醇中并在-20℃下储存过夜。实验样品然后重悬于PBS中,并用50 μg/ ml碘化丙啶(PI)溶液,含有0.2%Triton X-100和100 μg/ ml无DNA酶的RNase A用于分析。对于凋亡分析,在放疗后24 h,收获细胞,使用膜联蛋白V-FITC凋亡检测试剂盒I(BD Biosciences)按照制造商的说明。显示阳性表面膜联蛋白V染色而无细胞可渗透性PI的细胞被鉴定为凋亡细胞。
1.5 免疫印迹法将A549细胞暴露于5 mM二甲双胍24 h,随后以6 Gy的剂量进行或不进行照射。在放疗后24 h,将细胞用PBS液体洗涤3次,用含有RIPA裂解液与苯甲基磺酸氟(PMSF)以98:2混合后裂解细胞提取蛋白。通过BCA蛋白试剂盒定量各组蛋白浓度,以不同分子蛋白大小配置不同比例的凝胶,待用,上蛋白样品,经电泳、转膜。将转完后的膜用5%BSA的TBST缓冲液在室温下封闭1 h,然后与温育一抗在4℃摇床上过夜。第二天,PVDF膜在室温下用辣根过氧化物酶缀合的二抗摇床上温育1 h,TBST缓冲液洗涤3次,每次10 min,加入ECL化学发光剂,放入暗盒中并压片,2~5 min后显影、定影。使用以下抗体:DNA-PK(Abcam),Ku80,Ku70,γ-H2AX(Ser139),β-actin(Cell Signaling Technology)。
1.6 统计学分析使用SPSS 13.0软件统计分析。每组实验重复三次,统计数据时对于两组比较,使用t检验。对于两组以上的比较,使用单因素方差分析。P<0.01表示有统计学差异。
2 结果 2.1 二甲双胍可抑制肺癌A549细胞的增殖和放射增敏作用用CCK8的方法检测二甲双胍对肺癌A549细胞增殖的影响。随着二甲双胍浓度的增加,A549细胞的增殖抑制作用越强,其IC50为42.02 mM。而当二甲双胍浓度低于10 mM时,A549细胞增殖下降稍平稳,故选择5mM适可剂量作为放射增敏研究浓度。上述结果说明二甲双胍能明显抑制A549细胞的增殖(图 1A)。

|
图 1 二甲双胍可抑制肺癌A549细胞的增殖和克隆形成能力增敏放疗 注:A:用CCK8的方法检测二甲双胍对肺癌A549细胞的生长抑制。以不同梯度的二甲双胍处理A549细胞24 h,随着二甲双胍浓度的增加,A549细胞的增殖抑制作用越强(P<0.01)。B:集落形成实验结果显示用5mM的二甲双胍作用A549细胞24 h,二甲双胍联合放疗组的细胞形成克隆的能力明显下降。 |
集落形成实验结果显示用5 mM的二甲双胍作用A549细胞24 h后,二甲双胍联合放疗组与单纯放疗组相比,其A549细胞克隆形成能力明显下降。放疗联合二甲双胍组细胞存活分数(SF值)为1.39,单纯放疗组细胞存活分数(SF值)为0.1(图 1B)。
2.2 二甲双胍可诱导A549细胞凋亡从而增敏放疗细胞凋亡被认为是一种潜在辐射增敏机制,我们应用流式细胞仪检测A549肺癌细胞凋亡率,其结果显示:单纯放疗组A549细胞放疗后24 h细胞凋亡率为10.6%,而5 mM二甲双胍联合6 Gy放疗后24 h,细胞凋亡率达30.6%(P<0.01)。上述结果提示二甲双胍可增敏A549肺癌细胞辐射敏感性,其主要的机制可能是促进其细胞凋亡(图 2)。
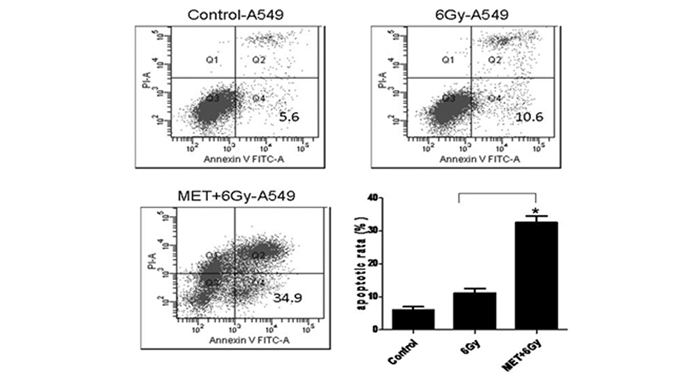
|
图 2 二甲双胍可诱导A549细胞发生凋亡而增敏放疗 注:流式检测不同处理组A549细胞的凋亡率:5mM二甲双胍联合6 Gy放疗24小时后可以明显提高放射线诱导的细胞凋亡(P<0.01)。 |
细胞周期是决定放射敏感性的重要因素之一。而且降低G2检查点能够让更多的未修复的DNA肿瘤细胞进入有丝分裂,直至死亡。因此,我们细胞周期检测结果显示:6 Gy放疗联合5 mM二甲-双胍组24 h后G2/M期比例为8%,单纯放疗组G2/M期比例为26%,二甲双胍联合放疗可以降低放疗后G2/M期比例引起有丝分裂灾难导致细胞死亡,从而可增敏放疗(图 3)。
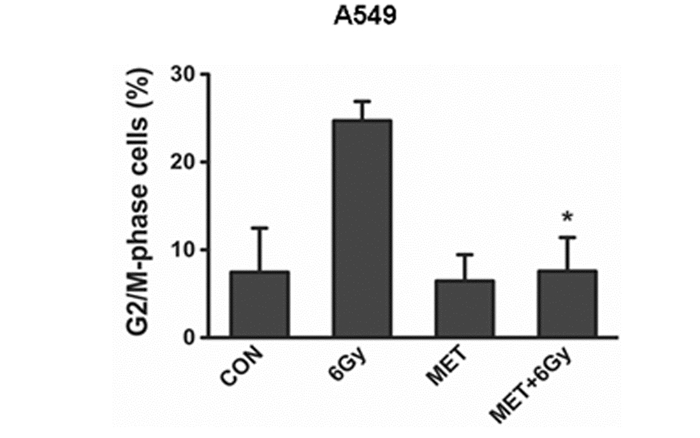
|
图 3 二甲双胍可以降低了肺癌A549细胞G2/M期的分布增敏放疗 注:流式检测不同处理组的细胞G2/M期的比例:二甲双胍联合放疗可以降低放疗后G2/M期比例引起有丝分裂灾难导致细胞死亡(P<0.01)。 |
应用免疫印迹技术检测不同处理组细胞中的DNA损伤及修复蛋白表达水平,结果显示:5 mM二甲双胍与6 Gy放射联合作用于A549细胞24 h后,γ-H2AX损伤蛋白表达较对照组增多,DNA-PK,Ku70及Ku80修复蛋白表达较对照组明显减少(P<0.01)。
3 讨论近年来,二甲双胍一直被报道能够在多种肿瘤中起到增敏放疗作用,诸如:肝癌、食管癌、鼻咽癌,乳腺癌,前列腺癌[5]。类似的,我们研究显示二甲双胍明显的抑制肺癌A549细胞的增殖。而二甲双胍联合放疗能明显降低A549细胞的克隆形成能力,增加细胞凋亡以增加放疗增敏作用。进一步研究其可能的机制是降低放疗相关的G2检查点及抑制DNA损伤修复。而本实验中,二甲双胍作为A549肺癌细胞一个有效的放疗增敏药物研究具体体现于以下三个方面。
首先,越来越多的研究表明肿瘤细胞放疗抵抗很大部分因素源于细胞凋亡抵抗,因此促进细胞凋亡被认为是一种潜在辐射增敏化机制。Lin等研究者发现,分子靶向激酶抑制剂(Ve-465)通过增加凋亡的机制能显著增强辐射诱导的肿瘤生长抑制[6]。Grosse等研究者发现舒尼替尼联合辐射通过内在途径诱导滤泡性甲状腺癌细胞凋亡[7]。此外,二甲双胍在鼻咽癌细胞中已被报道能增强辐射诱导的细胞凋亡且激活了凋亡蛋白caspase-3活性[8]。在本研究中,我们也发现低浓度5mM二甲双胍联合放疗能够显着增加肺癌细胞凋亡率(图 2),这表明二甲双胍可增敏肺癌辐射敏感性,其主要的机制是促进细胞凋亡。
其次,目前研究表明细胞在M及G2期放射敏感性最高,然而大部分肿瘤细胞的生存通常依赖于G2关键阻滞点,因其可以通过让受损伤的肿瘤细胞DNA得以修复来避免死亡[9]。因此,降低G2关键点能够让更多的未修复的DNA肿瘤细胞进入有丝分裂。从而让这些肿瘤细胞趋于死亡,这也代表着肿瘤特异性放射增敏的一个发展策略。既往国外Zhang X研究发现蟾蜍灵在脑胶质瘤细胞中可诱导G2/M期阻滞来增敏放疗[10]。我们用流式细胞仪研究同样显示二甲双胍联合放疗能够明显降低放疗后A549细胞G2/M期的比例,进而使未完成修复的细胞进入有丝分裂,直到死亡,从而起到放疗增敏作用(图 3)。

|
图 4 二甲双胍能提高放疗对肺癌A549细胞的DNA损伤并降低其修复 注:免疫印迹技术检测不同处理组细胞中的DNA损伤及修复蛋白表达水平:5 mM二甲双胍与6 Gy放疗组作用于A549细胞24 h后,γ-H2AX损伤蛋白表达较对照组增多,DNA-PK,Ku70及Ku80修复蛋白表达较对照组明显减少(P<0.01)。 |
另外,放疗作为恶性肿瘤的主要治疗手段之一,二甲双胍联合放疗提高肿瘤的控制率,其最重要机制在于增加肿瘤细胞DNA损伤。而DNA损伤修复有助于肿瘤细胞对放射治疗产生抵抗力,非同源末端重组修复在哺乳动物细胞中是DNA双链断裂修复的主要方式,在真核生物中,重要的非同源末端重组修复蛋白是DNA-PK、Ku70和Ku80[11]。此外,国外临床研究显示放疗后局限期前列腺癌患者中外周血淋巴细胞DNA-PK活性可能是预测PSA复发和尿毒性的重要标志物,可能有助于前列腺癌的个性化治疗[12]。这些发现使DNA损伤修复蛋白成为潜在的治疗靶点来治疗肿瘤细胞。本研究中,我们发现经过放疗24 h后,放疗组中γ-H2AX损伤蛋白表达量较对照组稍增多,DNA-PK,Ku70及Ku80修复蛋白较对照组明显减少,而二甲双胍联合放疗组处理γ-H2AX损伤蛋白表达明显多于对照组,DNA-PK,Ku70及Ku80修复蛋白较对照组也明显减少,这表明了二甲双胍抑制了DNA的修复。因此,把放射治疗,二甲双胍及DNA修复蛋白结合起来,特别是通过减少DNA-PK蛋白,是一个特别有研究意义的放疗增敏策略。
总而言之,我们的研究结果已经证明了低浓度二甲双胍可有效增强肺癌细胞系的放射敏感性。可能的机制是降低放疗相关的G2检查点及抑制DNA损伤修复。这些作用可能涉及更多的分子信号通路。但是,我们的数据是基于二甲双胍的体外研究,而二甲双胍在体内的研究或许更复杂。我们应继续探讨二甲双胍联合放疗在体内的临床实验研究,为二甲双胍成为临床放射增敏剂提供理论依据。
| [1] |
Jemal A, Siegel R, Xu J, Ward E. Cancer statistics, 2010[J]. CA Cancer J Clin, 2010, 60(5): 277-300. DOI:10.3322/caac.20073 |
| [2] |
Timmerman R, Paulus R, Galvin J, et al. Stereotactic body radiation therapy for inoperable early stage lung cancer[J]. JAMA, 2010, 303(11): 1070-1076. DOI:10.1001/jama.2010.261 |
| [3] |
Wan G, Yu X, Chen P, et al. Metformin therapy associated with survival benefit in lung cancer patients with diabetes[J]. Oncotarget, 2016, 7(23): 35437-35445. |
| [4] |
Suwei D, Liang Z, Zhimin L, et al. NLK functions to maintain proliferation and stemness of NSCLC and is a target of metformin[J]. J Hematol Oncol, 2015, 8: 120. DOI:10.1186/s13045-015-0203-8 |
| [5] |
Coyle C, Cafferty FH, Vale C, et al. Metformin as an adjuvant treatment for cancer:a systematic review and meta-analysis[J]. Ann Oncol, 2016, 27(12): 2184-2195. DOI:10.1093/annonc/mdw410 |
| [6] |
Lin ZZ, Chou CH, Cheng AL, et al. Radiosensitization by combining an aurora kinase inhibitor with radiotherapy in hepatocellular carcinoma through cell cycle interruption[J]. Int J Cancer, 2014, 135(2): 492-501. DOI:10.1002/ijc.v135.2 |
| [7] |
Grosse J, Warnke e, Wehland M, et al. Mechanisms of apoptosis in irradiated and sunitinib-treated follicular thyroid cancer cells[J]. Apoptosis, 2014, 19(3): 480-490. DOI:10.1007/s10495-013-0937-0 |
| [8] |
Li H, Chen X, Yu Y, et al. Metformin inhibits the growth of nasopharyngeal carcinoma cells and sensitizes the cells to radiation via inhibition of the DNA damage repair pathway[J]. Oncol Rep, 2014, 32(6): 2596-2604. DOI:10.3892/or.2014.3485 |
| [9] |
Dixon H., Norbury CJ.. herapeutic exploitation of checkpoint defects in cancer cells lacking p53 function[J]. Cell Cycle, 2002, 1(6): 362-368. DOI:10.4161/cc.1.6.257 |
| [10] |
Zhang X, Huang Q, Wang X, et al. Bufalin enhances radiosensitivity of glioblastoma by suppressing mitochondrial function and DNA damage repair[J]. Biomed Pharmacother, 2017, 94: 627-635. DOI:10.1016/j.biopha.2017.07.136 |
| [11] |
Lee Y, Li HK, Masaoka A, et al. The purine scaffold Hsp90 inhibitor PU-H71 sensitizes cancer cells to heavy ion radiation by inhibiting DNA repair by homologous recombination and non-homologous end joining[J]. Radiother Oncol, 2016, 121(1): 162-168. DOI:10.1016/j.radonc.2016.08.029 |
| [12] |
Someya M, Hasegawa T, Hori M, et al. Local tumor control and DNA-PK activity of peripheral blood lymphocytes in prostate cancer patients receiving radiotherapy[J]. J Radiat Res, 2017, 58(2): 225-231. |




