2. 山东省安康医院
2. Shandong Ankang Hospital
矽肺是由于在生产过程中长期吸入游离二氧化硅含量较高的粉尘达一定量后所引起的以肺组织纤维化为主的全身性疾病。一氧化氮(NO)作为一种与矽肺炎症反应和纤维化密切相关的生物自由基,近年来受到普遍重视。硝酸盐/亚硝酸盐(NO2-/NO3-)是NO代谢的稳定终末产物,被广泛应用于间接指示肺内NO水平[1]。硝基酪氨酸作为内源性过氧亚硝酸盐(ONOO-)生成的特异性标志物, 可以间接反映肺内氧化和过氧化的程度以及体内炎症反应水平[1]。课题组前期研究发现[2],接尘工人和矽肺患者诱导痰液中NO2-/NO3-、硝化酪氨酸含量高于对照组,且诱导痰中NO2-/NO3-水平与接尘工龄有较好的相关性,NO2-/NO3-与矽肺炎症过程有一定的同步性,提示NO2-/NO3-可能反应矽肺患者和接尘人群的炎症程度,其作为矽肺早期炎性标志物也具有潜在可能性。本次实验研究了不同剂量染尘大鼠早期支气管肺泡灌洗液(BALF)中NO2-/NO3-、硝基酪氨酸含量变化,以及与病理变化之间的关系,进一步阐释NO及其衍生物在尘肺发病过程中的变化和作用,探讨NO衍生物作为矽肺早期炎性标志物的可行性。
1 材料与方法 1.1 动物及分组选择清洁级Wistar大鼠168只,雄性,体重170~220g,由山东大学动物实验中心提供。适应环境一周,随机分为对照组(生理盐水)、低剂量组(15 mg/mL)、中剂量组(30 mg/mL)、高剂量组(60 mg/mL)染尘实验组,每组42只。
1.2 试剂和仪器SiO2粉尘由Sigma公司提供,纯度为99 %,粒子直径在0.5~10 μm之间,80%粒子在1~5 μm之间。硝化酪氨酸ELISA试剂盒及NO2-/NO3-试剂盒分别由荷兰Hycult公司和加拿大Blowen公司提供。
1.3 实验方法 1.3.1 建立动物模型矽尘混悬液,由无菌生理盐水溶液溶解配制,临用前加入青霉素钠2500 U/mL,高压消毒灭菌,以防止肺部感染。
大鼠乙醚麻醉后,平躺在操作台上,用镊子提起舌头,把耳镜慢慢从口插入,借助反光灯观看耳镜深部并找到气管开口,钝头插管向下轻轻地插入至支气管分叉处,快速注入1mL粉尘悬液,注入前轻轻回抽,有连续气泡且无阻力确认插入气管,方能注入。注入后上下抖动大鼠数分钟,以防悬液倒流,使粉尘在肺部分布均匀,注意观察大鼠的呼吸,及时采取抢救措施。对照组采用同样的方法注入1 mL生理盐水。
1.3.2 收集支气管肺泡灌洗液收集模型建成后,每组分6个时间点分别取7只大鼠处死,将肺组织进行气管插管。抽取2 mL 37℃无菌生理盐水,缓慢注入肺组织,间隔30s后抽取灌洗液,反复进行3次灌洗,可收集到灌洗液约5 mL。将灌洗液在4℃下1500 rpm, 离心10 min,取上清液进行硝酸盐/亚硝酸盐、硝化络氨酸含量的测定。
1.3.3 肺组织病理学观察灌洗结束后将整个肺脏从胸腔内取出,剔除气管、支气管等结缔组织,在生理盐水内漂洗一次,用滤纸吸干水分称取重量,用10%中性缓冲福尔马林液固定肺组织,石蜡包埋,切片厚度5 μm,行HE染色,普通光镜下观察肺组织病理变化。
1.3.4 测定硝酸盐/亚硝酸盐、硝化络氨酸含量酶联免疫吸附法(ELISA)测定硝化酪氨酸,硝酸酶还原法测定NO2-/NO3-。具体步骤严格按试剂盒的操作要求进行。
1.4 统计学处理采用SPSS 17.0统计软件,实验数据均采用x±s表示,各组比较采用单因素方差分析,各组间两两比较采用LSD法检验,NO2-/NO3-与硝化酪氨酸之间的相关分析采用Pearson相关分析。以P<0.05为具有统计学意义。
2 结果 2.1 病理学结果 2.1.1 肺组织标本肉眼观查对照组各时间点双肺组织呈粉红色或淡粉红色,质地柔软,表面光滑,灌洗时回缩良好。染尘组1 d双肺组织出现出血点,并且随着染尘剂量的增加出血点逐渐增多。3 d双肺颜色加深,弥漫性出血,体积比正常组增大,个别肺组织出现实变及海绵样病变,尤其以高剂量组比较明显。7 d双肺体积明显增大,肺包膜紧张,海绵样病变严重,高剂量组出现点状白斑。14 d双肺颜色呈暗红色,肿胀,片状白斑明显增多。21 d双肺布满灰白色的针头样突起,分布均匀,表面不光滑,并随着剂量的增加病变越严重。28d双肺肿胀,肺表面可见不规则较大的白色,灌洗时弹性减弱,高剂量组该病理变化更突出。
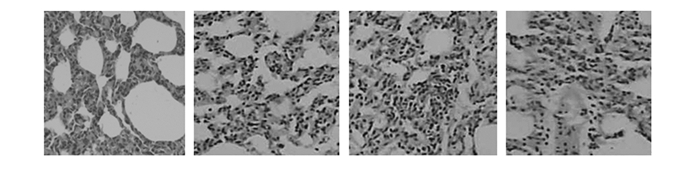
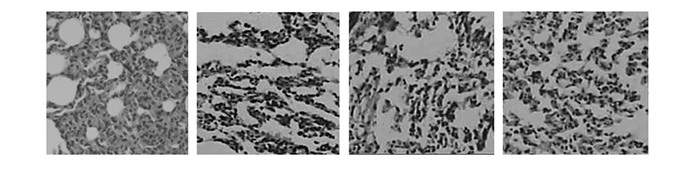
2.1.2 肺组织切片HE染色观察对照组,1~3 d肺组织出现充血,水肿,炎性细胞增多;7 d肺组织炎症逐渐消失;14 d后肺组织基本恢复正常,结构清晰。染尘组,1~3 d肺组织出现充血,有浆液性蛋白渗出液,炎性细胞开始增多、浸润。7 d气管、支气管及肺组织充血明显,部分支气管粘膜上皮细胞及肺泡上皮细胞脱落缺损,肺泡间隔增宽且水肿,可见较多的中性粒细胞、巨噬细胞浸润,同时局部肺泡腔内可见浆液性渗出增多,随着剂量的增加病理变化更加严重。14 d肺泡间隔进一步增宽,部分肺组织结构破坏。淋巴细胞、浆细胞渗出增多,有大量巨噬细胞增生、聚集,见图 1。21 d肺泡腔萎缩,部分消失,肺泡间隔断裂,肺泡结构大部分遭到破坏,炎性细胞主要为淋巴细胞。28 d肺间隔小血管壁增厚,伴有成纤维细胞增生,胶原纤维增多并沉积在肺间隔内,部分肺组织呈肺不张样改变,高剂量组尤为明显,见图 2。
|
图 1 染尘大鼠14d肺组织HE(hematoxylin-eosin staining)染色观察(×200) 注:从左至右依次为对照组、低剂量组、中剂量组、高剂量组。 |
|
图 2 染尘大鼠28d肺组织HE(hematoxylin-eosin staining)染色观察(×200) 注:从左至右依次为对照组、低剂量组、中剂量组、高剂量组。 |
对大鼠BALF中NO2-/NO3-浓度进行单因素方差分析,组间两两比较采用LSD检验,结果显示各染尘组NO2-/NO3-水平明显高于对照组,差异均有统计学意义(P<0.05),见表 1。随着时间的延长,各染尘组NO2-/NO3-水平逐渐增高,第14 d时,达到高峰,且与低剂量组相比,高剂量染尘组大鼠BALF中NO2-/NO3-水平明显增高(P<0.05);其他时点各染尘组之间NO2-/NO3-水平并无显著性差异。
|
|
表 1 染尘大鼠BALF中NO2-/NO3-含量测定结果 |
对大鼠BALF中硝化酪氨酸含量进行单因素方差分析,组间两两比较采用LSD检验,结果显示低剂量染尘组在第3~21 d,硝化酪氨酸水平明显高于对照组(P<0.05),中剂量组在第1、3、14、21和28 d硝化酪氨酸水平明显高于对照组(P<0.05);高剂量组在各个时点硝化酪氨酸水平都明显高于对照组,差异有统计学意义(P<0.05)见表 2。各染尘组大鼠硝化酪氨酸水平在染尘14 d时达到最高峰,随后又有不同程度的下降,但到28 d时仍高于对照组。各染尘组间的硝化酪氨酸水平并无显著性差异,剂量-反应关系不明显。
|
|
表 2 染尘大鼠BALF中硝化酪氨酸含量测定结果 |
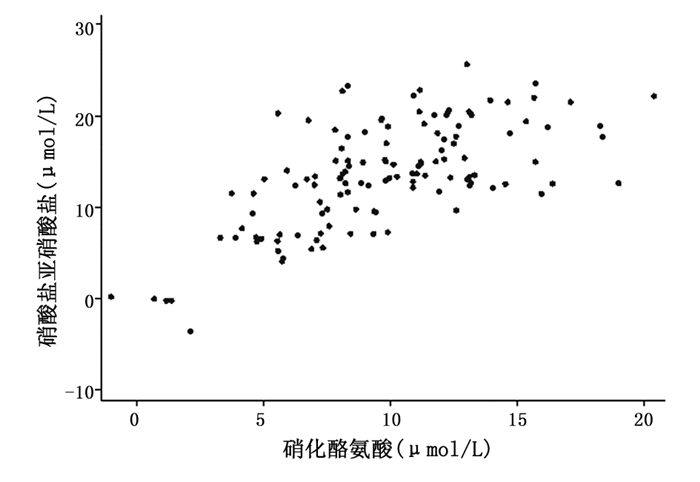
大鼠BALF中NO2-/NO3-水平与硝化酪氨酸水平的相关关系见图 3,Pearson相关分析显示, 两者呈相关关系(r = 0.6598, P=0.000)。
|
图 3 大鼠BALF中NO2-/NO3-与硝化酪氨酸关系散点图 |
一氧化氮(NO)是体内重要的生理递质和细胞间、细胞内的化学信使, 除参与机体生理过程的调节和宿主防御及免疫反应外还在炎症反应中发挥复杂的作用,研究表明它参与了矽肺早期的炎症反应过程,并与肺纤维化的形成密切相关[3]。NO是由NO合成酶(NOS)氧化L-精氨酸的胍基氮而形成,目前已经确定的NOS亚型有三种,分别称为神经元型NOS(nNOS)、内皮型NOS(eNOS)和诱导型NOS(iNOS)。iNOS主要存在于巨噬细胞、中性粒细胞、成纤维细胞及气管、支气管上皮细胞中,生理状态下一般不表达,受炎性介质和细胞因子的刺激而激活,产生大量NO,引起气道炎症、水肿、肺损伤等不良反应[1-2]。
呼吸道内产生的NO,部分进入体内发挥其生理或病理作用;部分与氧结合形成硝酸盐/亚硝酸盐;部分与体内含硫醇类物质反应,生成硫化亚硝基蛋白和硫化亚硝基硫醇,后者在酸性环境重新释放NO到呼吸道;还有部分与气道内的超氧阴离子结合,形成超氧亚硝酸阴离子(NOON-),最终与蛋白质酪氨酸残基或游离酪氨酸发生硝化反应,生成稳定的代谢产物3-硝基酪氨酸[4]。在炎症病理状态下, 气道内NO氧化速率很快, 生成后迅速转变为稳定的代谢终产物NO2-/NO3-,因此BALF中NO2-/NO3-水平可间接指示肺内NO水平。本实验各染尘组大鼠BALF中NO2-/NO3-水平随着暴露后时间延长而逐渐升高,在14 d时达到高峰,随后在21 d~28 d观察期内BALF中NO2-/NO3-又有所下降,从染尘剂量看,NO2-/NO3-水平随剂量增加有增高。
病理结果显示,本实验大鼠染尘后1~3 d后即有炎症细胞开始浸润,随后逐渐有大量炎性细胞浸润,直至14 d左右肺组织的炎症反应最明显,21 d后,肺泡腔开始萎缩,肺泡间隔断裂,纤维细胞及胶原组织开始出现,炎性细胞浸润逐渐减少,肺组织结构破坏并逐渐向纤维化进展。由病理结果可以看出在染矽尘早期阶段,大鼠BALF中NO2-/NO3-水平随着矽尘引起的炎症反应的不断加重而升高。Porter DW[1]等研究也发现大鼠BALF中NO2-/NO3-水平在矽尘暴露后16天就明显增高,并且随着暴露时间延长暴露量的增加NO2-/NO3-水平不断增高。Wang k等[2]对同一煤矿的接尘工人的调查研究发现,接尘工人诱导痰液中NO2-/NO3-的含量较地勤人员明显升高,并与接尘工龄有较好的正相关性。本实验提示BALF中的NO2-/NO3-增加的时间与肺部病理改变基本一致,且在大部分时点NO2-/NO3-水平与染尘剂量有较好的剂量反应关系,因此NO2-/NO3-可能在早期能反映矽肺炎性反应的程度。
NO除本身具有细胞毒效应外,还可以通过过氧亚硝基阴离子(ONOO-)介导其细胞毒性作用。当局部NO浓度升高至μmol/L级以上时,可与超氧阴离子快速反应生成ONOO-,ONOO-作为一种强氧化剂具有极强的细胞毒性,除直接损伤细胞之外,还可使许多蛋白质的酪氨酸残基硝基化而使其失活、功能消失,抑制内源性SOD酶活性,参与介导多种原因造成的肺损伤[4-5]。ONOO-还能激活核转录因子-κB(NF-κB)从而调节细胞因子、趋化因子等炎介质的表达,但是ONOO-极不稳定, 半衰期只有0.9 s左右就分解为高活性的·OH和NO2 ·等自由基, 因此直接检测ONOO-比较困难[6]。硝基酪氨酸是ONOO-与蛋白质上的酪氨酸残基结合生成的稳定的终末代谢物, 是内源性ONOO-生成的特异性标志物,检测肺内硝基酪氨酸的生成可以反映ONOO-生成量的变化。本实验中,各染尘组大鼠BALF中硝化酪氨酸较对照组有明显升高,染尘组大鼠硝基酪氨酸水平的总体变化与观察到的大鼠染尘后早期炎症反应等病理性改变在时间上一致,与BALF中的NO2-/NO3-水平有相关性,说明高浓度二氧化硅在引起肺内NO大量生成的同时,可引起体内ONOO-生成增多,发挥细胞毒性,引起体内氧化损伤和炎症反应。从染尘大鼠各时点BALF中NO2-/NO3-和硝化络氨酸水平动态变化看,染尘后均是一个逐步升高的过程,在14 d前后达高峰,随后逐渐降低,28 d时硝化络氨酸已经与对照无差异;从BALF中两种物质开始升高的时间看硝化酪氨酸略晚于NO2-/NO3-;从剂量反应关系看,BALF中NO2-/NO3-水平随剂量增加的趋势更明显。由此推测NO对矽尘的反应更加直接,而硝化络氨酸的生成需要高浓度的O2-·和NO存在,O2-·和NO的产量和浓度在它们的产生系统中有着重要意义,同时过氧亚硝基阴离子也不是硝化络氨酸生成的唯一依赖途径,其生成的调节过程还存在其他机制。Wang k等[2]对矽肺患者诱导痰中NO2-/NO3-和硝基酪氨酸水平进行检测,结果发现尘肺患者诱导痰中NO2-/NO3-和硝基酪氨酸水平均明显高于接尘工人组和对照组,且NO2-/NO3-水平与接尘工龄呈明显正相关关系,这与本次研究结果相似。Sharawy MH[7]等研究用棕榈酸甲酯给予大鼠矽肺模型后发现,棕榈酸甲酯都会引起NO2-/NO3-同乳酸脱氢酶(LDH)、BALF中炎性细胞聚集以及炎性因子TNF-α的降低,说明NO2-/NO3-与其他炎性指标有同步性。本研究也认为,NO2-/NO3-含量与矽肺炎症过程有很好的同步性和剂量反应关系,可作为潜在的矽肺早期炎性标志物,而硝化络氨酸是炎症状态下NO的产物,BALF中的浓度与接触剂量不存在明显的关系,可能决定硝化酪氨酸含量水平的还有其他作用机制。
研究结果还提示NO2-/NO3-作为反映气道炎症的潜在指标,与反映气道炎症的间接指标硝基酪氨酸在矽肺早期有良好的正相关性,这也进一步说明了两者作为炎症反应指标的指示作用。
总之,矽肺大鼠BALF中NO2-/NO3-和硝基酪氨酸含量变化在28 d观察期内的与早期炎症性病理过程基本上一致,因此能在一定程度上反映气道炎症状态; 其动态变化可能成为观察早期病情进展的良好指标。这一实验为进一步探讨NO在尘肺发病过程中的变化和作用提供了有益的途经,当然这还需要进一步深入研究其变化规律和时间-剂量与炎症水平的反应关系。
| [1] |
Porter DW, Millecchia L, Robinson VA, et al. Enhanced nitric oxide and reactive oxygen species production and damage after inhalation of silica[J]. Am J Physiol Lung Cell Mol Physiol, 2002, 283(2): 485-493. DOI:10.1152/ajplung.00427.2001 |
| [2] |
Wang K, Wang R, Liu ZL, et al. Changes of NO2-/NO3- and nitration tyrosine concentrations in induced sputum of silicosis patients[J]. Zhonghua Lao Dong Wei Sheng Zhi Ye Bing Za Zhi, 2009, 27(1): 30-33. |
| [3] |
范红敏, 袁聚祥, 秦天榜, 等. 丙二醛、总抗氧化能力和诱导型一氧化氮合酶筛检煤工尘肺价值的探讨[J]. 工业卫生与职业病, 2011(5): 261-263. |
| [4] |
Razavi HM, Werhun R, Scott JA, et al. Effects of inhaled nitric oxide in a mouse model of sepsis-induced acute lung injury[J]. Crit Care Med, 2002, 30(4): 868-873. DOI:10.1097/00003246-200204000-00026 |
| [5] |
Aikio O, Vuopala K, Pokela ML, et al. Nitrotyrosine and NO synthases in infants with respiratory failure:Influence of inhaled NO[J]. Pediatr Pulmonol, 2003, 35(1): 8-16. DOI:10.1002/(ISSN)1099-0496 |
| [6] |
Beckman J S, Beckman TW, Chen J, et al. Apparent hydroxyl radical production by peroxynitrite. Implication for endothelial injury from nitric oxide and superoxide[J]. Proc Natl Acad Sci USA, 1990, 87(4): 1620-1624. DOI:10.1073/pnas.87.4.1620 |
| [7] |
Sharawy M H, Elagamy D S, Shalaby A A, et al. Protective effects of methyl palmitate against silica-induced pulmonary fibrosis in rats[J]. International Immunopharmacology, 2013, 16(2): 191-198. DOI:10.1016/j.intimp.2013.04.007 |




