2. 中国医学科学院北京协和医学院放射医学研究所天津市分子核医学重点实验室;
3. 山东省医学科学院放射医学研究所
2. Institute of Radiation Medicine, Chinese Academy of Medical Sciences and Peking Union Medical College;
3. The Radiation Medical Institute, SAMS
电离辐射为非特异性刺激,作用于机体后,通过物理、化学和生物学的复杂机理导致其细胞、组织、器官系统乃至整个机体功能代谢和器质性的损伤。细胞内含有大量水分,会在电离辐射作用下产生大量的氧自由基、羟自由基等,自由基对细胞的危害很大[1]。减少射线对机体的损伤是辐射防护需要探讨和解决的问题。研究表明乳铁蛋白(Lactoferrin,LF)具有抗衰老、抗氧化、提高机体免疫力和抗肿瘤等多种生物活性。有报道LF可抑制多种革兰氏阳性菌、革兰氏阴性菌、真菌和霉菌,且对热和pH稳定[2]。Osmond RI[3]等研究表明由乳腺细胞、白细胞分泌产生的乳铁蛋白进入组织细胞后,可以参与血液凝固、激活NK细胞、促进产生白细胞介素及肿瘤坏死因子等。1996年Shimmura等[4]通过紫外线(UV-B)引起的兔角膜炎模型中发现, 泪液中含有LF可以减轻UV-B照射所引起角膜上皮的辐射损伤。Fujihara等[5]通过鼠紫外线角膜炎模型观察到LF可抑制UV-B角膜上皮损伤。本研究推测乳铁蛋白可能有抗辐射作用,目前国内外关于这方面的报道还不多。本研究拟通过小鼠整体的辐射损伤作为动物模型,观察乳铁蛋白对辐射引起的抗氧化系统损伤的防护作用及其机制,为乳铁蛋白抗辐射功能的开发提供研究资料。
1 材料与方法 1.1 材料balb/c小鼠(SPF级),6周龄,清洁级,体重20~22g,雄性,购于北京华阜康生物科技股份有限公司【合格证号SCXK(京)2009-0004】,饲养于室温21℃~26℃,湿度60%~70%,饮水和饲料均经过无菌消毒。直线加速器(PRIMUS High Energy,德国西门子公司),双目光学显微镜(日本Olympus光学工业株式会社);人乳铁蛋白(Human Lactoferrin, HLF, Sigma-Aldrich),SOD、MDA试剂盒(Sigma-Aldrich)。
1.2 方法 1.2.1 研究分组及给药方法将小鼠按随机分组原则分为3组,即正常对照组、照射对照组和乳铁蛋白防护组,每组12只。乳铁蛋白防护组每天1次给小鼠灌胃,hLF溶液3 ml/次,(1.0 g/L hLF,灌胃前30 min,36 mghLF溶于36 ml生理盐水中,混匀,配制成1.0 g/L hLF溶液,室温放置),正常对照组和照射对照组给予等量的生理盐水。
1.2.2 照射方法采用西门子PRIMUS医用电子直线加速器,除正常组外,其余两组均实施加速器X射线照射,源皮距100 cm,照射野40 cm × 40 cm,照射剂量率为2 Gy/min。于室温下,将小鼠固定于固定架上进行全身照射,照射在山东省千佛山医院肿瘤放疗中心完成。
1.2.3 观察生存率36只小鼠随机分成3组,即正常对照组、照射对照组、乳铁蛋白防护组。用乳铁蛋白灌胃30 d后,除正常对照组外,其余2组均实施加速器X射线全身照射,照射剂量为6.8 Gy。观察30 d内各组小鼠一般情况以及生存率并进行比较。
1.2.4 抗氧化试验及样本采集36只小鼠随机分成上述3组,每组12只。连续灌胃7 d,最后1次灌胃2 h后照射对照组和乳铁蛋白防护组的小鼠接受2.0 Gy X射线全身照射,24 h后取眼球血测SOD、MDA;处死小鼠,取肝脏组织做切片。
1.2.5 外周血超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量测定每组小鼠称重,眼球取血于非抗凝管中,室温放置2 h后,2 000 r/min,离心25 min(r=20 cm),取上层血清,按照SOD、MDA试剂盒说明检测SOD活力和MDA水平。
1.2.6 肝脏组织形态的观察肝脏组织经过固定,包埋,石蜡切片经脱蜡,HE染色,脱水,封固等程序,应用光学显微镜观察组织形态情况并拍照保存,对每组选取15个视野。
1.3 统计学方法采用SPSS 16.0统计软件处理数据,数值以表示,3组间比较用单因素方差分析和q检验。检验水准α=0.05。
2 结果 2.1 乳铁蛋白对受照小鼠生存率的影响本研究中,照射对照组小鼠在照后8 d生存率37.5%,30 d生存率0。而乳铁蛋白防护组照后8 d的生存率92.8%,30 d生存率为28.5%。照射对照组小鼠3 d开始死亡,死亡主要发生在4~8 d。乳铁蛋白防护组的小鼠从第8天开始出现死亡,主要发生在14~16 d。研究结果发现,第8 d、14 d小鼠的生存率乳铁蛋白防护组与照射对照组、正常对照组相比较,差异有统计学意义P < 0.05(表 1)。乳铁蛋白防护组的生存率和死亡小鼠的平均存活时间与照射对照组、正常对照组比较,差异有统计学意义,P<0.05(表 2)。
|
|
表 1 各组小鼠照射后30d生存率(%) |
|
|
表 2 各组小鼠30 d生存率及平均存活时间(x±s) |
小鼠受6.8 Gy X射线照射后30 d的生存状况显示,正常对照组小鼠体积明显增大、体重显著增加、饮水、饮食、活动、毛色、精神状态均正常,无死亡;照射对照组小鼠体重明显下降,饮食饮水量减少,毛皮光泽差,脱毛现象较严重,精神萎靡,活动减少,状态很差;乳铁蛋白防护组的损伤程度较照射对照组轻。
2.3 乳铁蛋白对受照小鼠血清抗氧化能力的影响表 3示,照射对照组中小鼠受到2.0 Gy X射线照射后,血清中SOD活性明显下降,与正常对照组比较差异均有统计学意义,P < 0.05;乳铁蛋白防护组的小鼠受照后小鼠血清中的SOD活性与照射对照组比较明显升高,两组比较差异有统计学意义,P < 0.05。从照射对照组中可以发现小鼠受照后血清中MDA含量与正常对照组比较明显升高(P < 0.05),乳铁蛋白防护组的MDA含量较照射对照组明显降低,P < 0.05。
|
|
表 3 hLF对小鼠2.0 Gy X射线照射后血清SOD和MDA的影响(x±s) |
辐射后24 h,正常对照组小鼠的肝脏形态光镜下可见组织结构正常,几个区域肝窦轻度扩张,偶尔可见肝细胞点状坏死。照射对照组小鼠肝脏的组织光镜下可见肝小叶、肝窦、肝细胞结构正常,体积增加,静脉壁增厚,水肿,中央静脉周围肝细胞肿大,肝窦及部分小血管有不同程度的扩张、充血、断裂,胞质疏松或变空,双核现象明显,肝细胞排列紊乱,也可见大量的凋亡细胞,并可见肝组织中有较多点灶状坏死,并且偶尔可以见到片状坏死。乳铁蛋白防护组肝组织上述现象不明显,与正常对照组的肝组织接近,肝小叶、肝窦、肝板及肝细胞结构正常,少数区域肝窦轻度扩张,偶见肝细胞点状坏死及纤维细胞增多(图 1)。
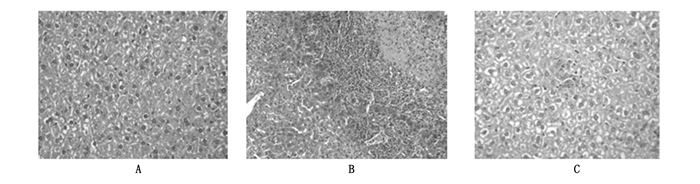
|
图 1 正常对照组、照射对照组和乳铁蛋白防护组小鼠肝脏组织结构(HE ×400) 注:A.正常肝脏细胞结构完整,静脉和肝窦清晰,组织增生;B.辐射正常对照组肝脏组织结构紊乱,静脉和肝窦充血扩张,可见大量的凋亡细胞;C.辐射防护组静脉和肝窦充血较轻,无纤维组织增生,可见少量的细胞凋亡。 |
辐射不仅可以直接对组织细胞造成损伤导致机体产生各种损伤,还可引起基因突变、诱发肿瘤,造成衰老和缩短寿命等,也可以因其引起的基因突变导致组织损伤[6-8]。X射线照射能够大大增加小鼠的死亡率。评价抗辐射药物最简单的方法就是观察实验动物辐照后30 d的生存率及其生存状态。本研究中,照射对照组小鼠照射后3 d开始死亡,死亡主要发生在4~8 d,小鼠在照后4 d生存率67%,30 d生存率0。而乳铁蛋白防护组照射后小鼠第8 d开始出现死亡,主要发生在14~16 d,死亡高峰时间往后推迟;小鼠在照后4 d、30 d的生存率分别为93.8%、28.5%。乳铁蛋白防护组与照射对照组、正常对照组小鼠的平均存活时间比较差异有统计学意义。本研究结果表明乳铁蛋白防护组能够显著提高经X射线照射后小鼠30 d的生存率、平均存活天数,延迟死亡的高峰时间,改善生存状态,进而说明了受照小鼠给与乳铁蛋白后,生存率明显提高,生存质量也有所上升,乳铁蛋白可能具有较好的抗辐射作用。
丙二醛(MDA)是氧自由基攻击细胞膜中的不饱和脂肪酸,引发脂质过氧化作用而形成的脂质过氧化物。MDA的量可以反映机体内脂质过氧化的严重程度,从而间接反映细胞膜损伤的程度[9]。SOD是胞内一种重要的抗氧化酶,催化O2-转化为H2O2和O2的反应,SOD活力高低反应机体清除氧自由基的能力。射线照射后机体可产生自由基。氧自由基攻击细胞膜中生成的MDA,其能够攻击生物膜,可引起细胞损伤,进一步造成DNA链断裂、染色体畸变、早衰和生命缩短等现象[10-11]。正常情况下,机体内存在抗氧化酶能够清除自身产生的自由基。但当机体产生大量的自由基时,机体很难清除,清除与产生的自由基失去平衡。研究结果显示,小鼠受到X射线照射后,SOD活力显著下降,MDA水平明显升高,提示可能存在机体的氧化-还原平衡遭到破坏;乳铁蛋白防护组的小鼠受到射线照射后,SOD活力较照射对照组有一定程度的增加,MDA含量水平较照射对照组下降,从一定程度上反映了体内的脂质过氧化物下降从而对DNA遗传物质的影响降低。以上结果表明乳铁蛋白能够降低由于射线引发的自由基数量,从而减少射线对细胞的损伤。hLF抗辐射作用途径之一有可能是通过改善抗氧化功能作用实现的。
李志沭等[12]发现人乳铁蛋白对人鼻咽癌细胞增殖、人肝脏癌细胞的生长起到抑制作用,对正常细胞无抑制作用。由此可见,乳铁蛋白在临床上有一定的应用价值,但对于其在辐射损伤中是否有保护作用,以及这种辐射保护作用在临床放疗中是否有效还需进一步的研究。本研究通过建立小鼠全身辐射损伤模型,研究乳铁蛋白的抗辐射损伤作用,通过对肝脏组织切片HE染色的病理学检查,结果显示与照射对照组比较,乳铁蛋白防护组小鼠的肝脏损伤明显减轻、肝细胞凋亡明显减少,说明辐射对肝脏组织有损伤作用,但乳铁蛋白能够减轻辐射对小鼠肝组织的损伤作用。
本研究表明,人乳铁蛋白可提高受照小鼠的生存率、生存质量,提高血清SOD活性并显著抑制血清MDA含量的升高,也可减轻肝脏组织的损伤和肝细胞的凋亡。提示其对小鼠急性辐射损伤具有一定的保护作用。但是研究需要进一步证实,其辐射防护的机理尚待进一步研究。
| [1] |
吴德昌. 放射医学[M]. 北京: 军事医学科学院出版社, 2001: 14-85.
|
| [2] |
安美忱, 刘宁. 牛乳铁蛋白素抗菌活性及抗菌活性位点[J]. 微生物学通报, 2009, 36(10): 1526-1531. |
| [3] |
Osmond RI, Kett WC, Skett SE, et al. Protein-heparin interactions measured by BIAcore 2000 are affected by the method of heparin immobilization[J]. Anal Biochem, 2002, 310(2): 199-207. DOI:10.1016/S0003-2697(02)00396-2 |
| [4] |
Shimmura S, Suematsu M, Shimoyama M, et al. Subthreshold UV radiation-induced peroxide formation in cultured corneal epithelial cells:the protective effects of lactoferrin[J]. Exp-Eye-Res, 1996, 63(5): 519-526. DOI:10.1006/exer.1996.0142 |
| [5] |
Fujihara T, Nagano T, Endo K, et al. Lactoferrin protects against UV-B irradiation-induced corneal epithelial damage in rats[J]. Cornea, 2000, 19(2): 207-211. DOI:10.1097/00003226-200003000-00015 |
| [6] |
Cumberbatch M, Dearman RJ, Uribe-Luna S, et al. Regulation of epidermal Langerhans cell migration by lactoferrin[J]. Immunology, 2000, 100(1): 21-28. DOI:10.1046/j.1365-2567.2000.00014.x |
| [7] |
程德勇.乳铁蛋白对T细胞及肠道黏膜发育的影响[D].上海: 上海交通大学, 2009. http://med.wanfangdata.com.cn/Paper/Detail/DegreePaper_D068885
|
| [8] |
Zuccotti GV, Vigano A, Borell M, et al. Modulation of innate and adaptive immunity by lactoferrin in human immunodeficiency virus (HIV)-infected, antiretroviral therapy-naive children[J]. Int J Antimicrob Agents, 2007, 29(3): 353-355. DOI:10.1016/j.ijantimicag.2006.11.017 |
| [9] |
武毅, 于晓风, 曲绍春, 等. 仙人掌茎粗多糖的抗衰老作用研究[J]. 人参研究, 2000, 12(4): 23-25. |
| [10] |
毕良文, 段伟, 王晓莉, 等. 中药辐射防护剂的研究进展[J]. 中国辐射卫生, 2006, 15(1): 118-120. DOI:10.3969/j.issn.1004-714X.2006.01.071 |
| [11] |
Arora R, Chawla R, Sagar R, et al. Evaluation of radioprotective activities Rhodiola imbricata Edgew-a high altitude plant[J]. Mol Cell Biochem, 2005, 273(1-2): 209-223. DOI:10.1007/s11010-005-0822-4 |
| [12] |
李志沭, 仇志琴, 杨欢, 等. 人乳铁蛋白对鼻咽癌细胞增殖的影响[J]. 现代肿瘤医学, 2010, 18(1): 15-17. DOI:10.3969/j.issn.1672-4992.2010.01.005 |




