目前放射源广泛用于医疗、科研、农业、工业等领域,虽然监管不断加强,但辐射事故仍然发生(如2014年江苏南京铱源被人误捡),对放射从业人员和公众的健康造成很大的威胁,但截至目前对辐射伤员的救治尚无简单易行的现场救治措施。辐射防护作用原理有多种学说,其中体温过低学说则认为温度的变化可改变细胞及组织的辐射敏感性,降低氧代谢率,减少自由基产生,使辐射损伤得到有效的恢复[1]。但到目前为止,还鲜见将低温应用于辐射防护相关方面的报道,本文观察了亚低温(28℃~30℃)对大剂量外照射的影响,探讨亚低温对急性辐射损伤的保护作用,为亚低温在急性外照射辐射损伤救治中的应用提供基础和依据。
1 材料与方法 1.1 实验动物清洁级健康雄性Balb/C小鼠,16~18g,购于中国食品药品检定研究院,实验动物生产许可证号:SCXK(京)2009-0017。中国辐射防护研究院GLP中心动物实验室饲养管理,实验动物使用许可证号:SYXK(晋)2013-0002。
1.2 辐照源60Co辐照源,3300 Ci,剂量率为0.87 Gy/min,中国辐射防护研究院附属医院提供,由中国疾病预防控制中心辐射防护与核安全研究所2014年刻度。
1.3 主要仪器与试剂ACS-3A型电子秤(上海有声衡器有限公司);HEMAVET950型动物血液分析仪(DERW公司,美国),所用稀释液、溶血剂均由美国DERW公司提供;CX21型生物显微镜(OLYMPUS, 日本);组织包埋机、全自动脱水机、组织切片机(Thermor公司,美国);H0-3多通道温度巡检仪(北京鸿鸥成运科技有限公司);福意联恒温箱(北京福意电器有限公司);盐酸氯丙嗪注射液(上海禾丰制药有限公司);生理盐水(石家庄鹏海制药有限公司);甲醛(天津市大茂化学试剂厂)。
1.4 实验动物分组及处理30只小鼠检疫后称体重排序,按随机数字表法将动物分为2组,即辐射对照组和亚低温干预组,每组15只,两组小鼠均接受10 Gy 60Co γ射线单次全身照射;亚低温干预组在照射后即刻腹腔注射0.05%氯丙嗪,给予剂量为0.1ml/10g,放入恒温箱,使其肛温降低至30℃~33℃,维持6 h;辐射对照组在照射后即刻腹腔注射等体积的生理盐水。
1.5 照射条件照射小鼠置于带孔的单层盘盒内,放置在医用60Co治疗机照射台上单次全身照射,照射距离为80 cm。照射完毕将小鼠送至实验室自由饮食饮水,照射当日计为第0 d。
1.6 观察指标 1.6.1 30天生存率随时观察两组小鼠的存活情况,记录两组小鼠生存期,并计算30 d存活率、平均存活天数和保护指数[2]。
| $ 保护指数=\left[ \left( \text{ab+30c} \right)\text{/n} \right]\text{/}\left[ \left( \text{a'b'+30c'} \right)\text{/n'} \right] $ |
式中,a、a’代表亚低温干预组和辐射对照组死亡小鼠平均存活天数;b、b’代表亚低温干预组和辐射对照组死亡小鼠死亡数;c、c’亚低温干预组和辐射对照组死亡小鼠30 d存活数量;n、n’代表亚低温干预组和辐射对照组小鼠总数。
1.6.2 外周血象照前1 d和照后1、3、7、14 d,剪小鼠尾尖用采全血20 μl,与2 ml稀释液混匀后,用全自动血球计数仪检测。
1.6.3 病理组织学检查动物死亡后尸检,摘取心、肝、肺、肾、脾、小肠、睾丸,所取脏器经10%甲醛固定后常规石蜡包埋,切片,HE染色后病理观察。30 d存活动物在第30 d行相同处理。
1.7 统计学方法生存曲线绘制应用Kaplan-Meier氏法。各检测数据以均数±标准差(x±s)表示,采用SPSS 17.0统计学软件,对两组动物进行独立样本t检验分析,以P<0.05认为差异有统计学意义。
2 结果 2.1 亚低温对10 Gy照射小鼠生存状态的影响照后第3 d,辐射对照组小鼠毛竖起,活动量明显减少,有稀便、脓便。和对照组相比,亚低温干预组小鼠毛竖起程度较轻,活动量大于辐射对照组;两组小鼠均于照后第4 d开始出现死亡,照后1周内死亡动物尸检多见肺出血,脾减小,胃内充满内容物;照后1周后死亡动物体重明显减轻,尸检多见胃肠出血,肾脏色白。
2.2 亚低温对10 Gy照射小鼠的保护指数由表 1可见,照后30 d,两组均有2只存活,30 d存活率相同,但是亚低温干预组小鼠照后3~26 d存活动物数量大于辐射对照组,平均存活天数比辐射对照组多3.4 d,保护指数为1.216。
|
|
表 1 亚低温对10 Gy照射小鼠的保护指数 |
由表 2可见,照射前两组小鼠外周血象各指标均无统计学差异;在照后6h和24h,亚低温干预组小鼠外周血白细胞数、红细胞数、血小板数及血红蛋白含量均高于辐射对照组,且差异有统计学意义(P < 0.05);在之后的各时间点,两组动物外周血象各指标均无统计学差异。
|
|
表 2 亚低温对10 Gy照射小鼠外周白细胞的影响(x±s, n=15) |
两组小鼠死亡的小鼠的尸检病理结果可见:辐射对照组与亚低温干预组出现的脏器病理变化大致相似,但轻重不一,以辐射对照组的病变程度更为严重,详见下述。
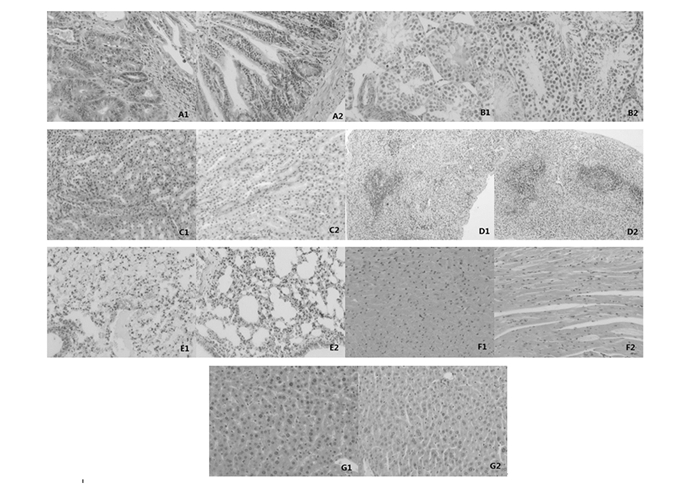
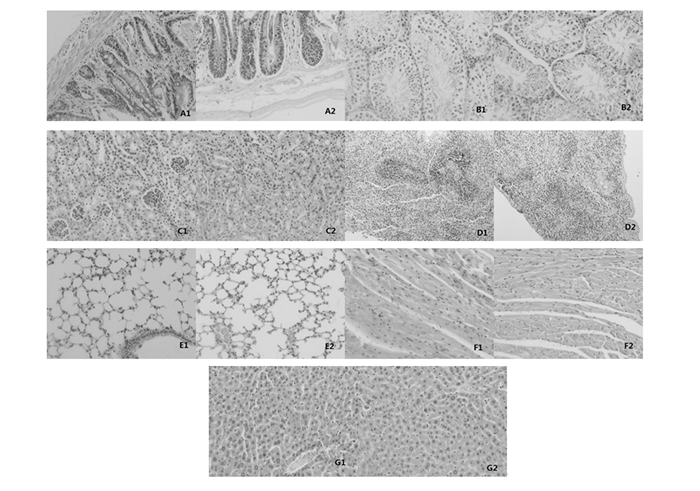
2.4.1 小肠照射后两组小鼠均出现不同程度的小肠粘膜上皮细胞核固缩,细胞坏死,直至实验后期,死亡动物均出现了小肠粘膜下层的坏死、出血,以辐射对照组更趋严重(图 1-A1、A2;图 2-A1、A2;图 3-A1、A2)。

|
图 1 早期死亡小鼠病理 |
|
图 2 中期死亡小鼠病理 |
|
图 3 晚期死亡小鼠病理 |
照射后两组小鼠均出现不同程度的睾丸生精上皮细胞胞核固缩、坏死,上皮脱落,精子生成障碍、至后期部分甚至大部分生精小管内均无精子生成,也以辐射对照组更趋严重(图 1-B1、B2;图 2-B1、B2;图 3-B1、B2)。
3.4.3 肾脏照射后两组小鼠均出现不同范围的肾脏间质充血,局灶肾小管嗜酸性变,以辐射对照组更趋严重,至后期,死亡的辐射对照组动物出现不同程度的肾小球坏死,亚低温干预组肾脏未出现此病变(图 1-C1、C2;图 2-C1、C2;图 3-C1、C2)。
2.4.4 脾脏照射后两组小鼠均出现脾脏白髓、红髓的萎缩及间质纤维组织的增生,病变程度两组大致相同(图 1-D1、D2;图 2-D1、D2;图 3-D1、D2)。
2.4.5 肺脏部分动物尤其是照射后早期即死亡的动物肺脏内间质充血、肺泡腔红细胞及液体的漏出较为严重,充盈整个肺泡腔乃至大部肺小叶,严重影响肺脏的通、换气功能,这可能也是导致实验小鼠较早死亡的直接原因(图 1-E1、E2;图 2-E1、E2;图 3-E1、E2)。
2.4.6 心脏两组动物心脏均未见到明显的病理改变(图 1-F1、F2;图 2-F1、F2;图 3-F1、F2)。
2.4.7 肝脏两组动物肝脏均未见到明显的病理改变(图 1-G1、G2;图 2-G1、G2;图 3-G1、G2)。
2.5 10 Gy照射存活小鼠脏器病理两组小鼠存活的小鼠的病理结果可见:辐射对照组与亚低温干预组出现的脏器病变程度均较轻,以辐射对照组的病变程度相对较严重,见下述。
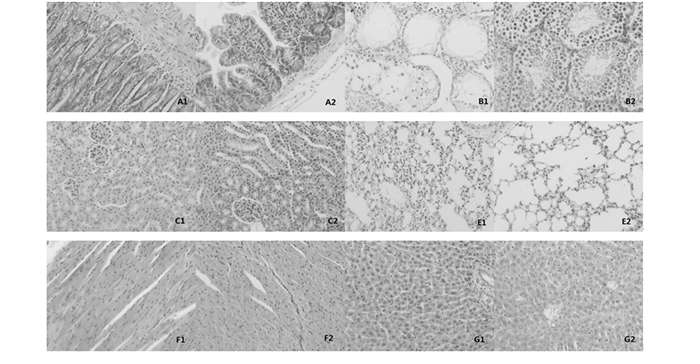
2.5.1 小肠照射后辐射对照组小鼠出现不同程度的小肠粘膜上皮固有层的充血,亚低温干预组未见明显异常(图 4-A1、A2)。
|
图 4 存活小鼠病理(1为辐射对照组,2为亚低温干预组) 注:A.肠B.睾丸C.肾脏D.脾脏(×100,HE) E.肺脏F.心脏G.肝脏(×200,其中脾×100,HE) |
照射后辐射对照组小鼠部分生精小管内生精上皮脱落,无精子生成,亚低温干预组小鼠则表现为部分生精小管内精子细胞轻度减少(图 4-B1、B2)。
2.5.3 肾脏两组动物肾脏均未见到明显的病理改变(图 4-C1、C2)。
2.5.4 肺脏两组动物肺脏均未见到明显的病理改变(图 4-E1、E2)。
2.5.5 心脏两组动物心脏均未见到明显的病理改变(图 4-F1、F2)。
2.5.6 肝脏两组动物肝脏均未见到明显的病理改变(图 4-G1、G2)。
3 讨论近年随着亚低温脑保护在动物实验和临床应用上的成功,有关亚低温(28℃~35℃)治疗在心肺复苏[3]、脊髓损伤[4]、急性肺损伤[5]等其它领域的研究也相继开展。已有研究表明,亚低温治疗作用机制包括降低脑氧代谢率和改善细胞能量代谢[6]、抑制氧自由基的生成,抑制炎性介质释放和炎性反应等[7]。
本研究通过30 d存活率、平均存活天数、外周血象和病理组织学检查初步探讨亚低温对大剂量急性外照射小鼠的保护作用。研究结果显示,在照射后前期,亚低温干预组动物身体状态较辐射对照组好;两组小鼠30天存活率相同,但亚低温干预组小鼠平均存活天数比辐射对照组提高了3.4 d,保护指数达1.216;照后6 h和24 h,亚低温干预组外周血象各指标均高于辐射对照组(P < 0.05);病理结果显示,两组死亡动物各脏器病理组织学结果亚低温干预组损伤较轻,如小肠:辐射对照组至后期肠粘膜下层已经发生严重的出血、坏死,亚低温干预组则无此种现象;如睾丸:同样至实验后期,尚存活的辐射对照组小鼠其睾丸内的部分生精上皮已经坏死殆尽,而相对的亚低温干预组睾丸内的生精上皮大致结构尚存,甚至可见到少量存活的精子。
4 结论通过本研究可发现:小鼠经大剂量急性照射后尽快给予亚低温干预,可延长平均存活天数,减缓其外周血象下降速度,抑制小肠、睾丸等脏器实质细胞因辐射所致的凋亡、坏死等,可见亚低温对大剂量急性外照射损伤初期具有一定的保护作用。
虽然单纯的亚低温干预仅对辐射损伤初期有一定的作用,但是它易于实施的特点可以实现现场救治,并为诊断和其他的治疗措施赢得了时间,或许可以得到更好的治疗效果。亚低温对急性辐射损伤其它指标的影响和作用机制还需进一步研究。
| [1] |
赵斌, 张军帅, 刘培勋. 辐射防护剂研究现状及其进展[J]. 核化学与放射化学, 2012, 34(1): 9-11. |
| [2] |
秦秀军, 田宇, 安全, 等. 富氢水对小鼠辐射损伤的保护作用[J]. 辐射防护通讯, 2013, 33(4): 28-33. DOI:10.3969/j.issn.1004-6356.2013.04.006 |
| [3] |
孙志扬, 李光, 孙庆文, 等. 心肺复苏大鼠行亚低温处理后不同脑区NMDARl表达变化[J]. 中国临床新医学, 2009, 2(9): 889-893. DOI:10.3969/j.issn.1674-3806.2009.09.01 |
| [4] |
费华伟, 程光, 程爱国. 亚低温在脊髓损伤治疗中的研究现状[J]. 中国医药导报, 2012, 9(9): 11-13. DOI:10.3969/j.issn.1673-7210.2012.09.003 |
| [5] |
Mancuso A, Derugin N, Hara K, et al. Mild hypothermia decreases the incidence of transient ADC reduction detected with diffusion MRI and expression of c-fos and hsp70 mRNA during acute focal ischemia in rats[J]. Brain Res, 2000, 887(1): 34-45. |
| [6] |
Yager JY, Asselin J. Effect of mild hypothermia on cerebral energy metabolism during the evolution of hypoxic-ischemic brain damage in the immature rat[J]. Stroke, 1996, 27(5): 919-925. DOI:10.1161/01.STR.27.5.919 |
| [7] |
Wang GJ, Deng HY, Maier CM, et al. Mild hypothermia reduces ICAM-1 expression, neutrophil infiltration And microglia/monocyte accumulation following experimental stroke[J]. Neuro cience, 2002, 114(4): 1081-1090. |




