2. 山东省医学科学院放射医学研究所;
3. 山东省章丘区人民医院
2. The Radiation Medical Institute, Shandong Academy of Medical Sciences;
3. Zhangqiu People Hospital
乳腺癌对我国乃至全世界妇女的健康危害严重,近几年,其发病趋势逐布递增[1]。微钙化是公认的诊断乳腺癌最常见最有意义的影像学表现之一[2]。钼靶摄片中发现细小钙化是非常重要的影像学特点,为乳腺癌的早期检出提供了参考依据。微钙化的定义是指超声和钼靶图像上微小钙化直径小1 mm[3],通常呈针样、细颗粒状或泥沙样,对应病理直径约60~100 μm小圆形或砂体样钙化[4]。它在乳腺癌的初期诊断、术后复发诊断、及其它乳腺疾病的区别中有重要的价值[5-7]。
1 资料及方法 1.1 一般资料我院从2013年10月-2016年10月搜集65例乳腺钼靶摄影发现钙化的女性患者作为研究对象,经手术病理证实,恶性病变31例,良性病变34例。全部患者就诊前均未进行过化疗、放疗、手术、组织活检等治疗方法。
1.2 检查方法应用由德国西门子公司生产的全数字化平面乳腺摄影机并配备一个高清数字快速采集工作站。投照条件40~80 mAs, 25~30 kV。检查时每位病人通常采用一侧或双侧乳腺轴位(CC)和内外斜位(MLO)进行钼靶摄片, 根据情况加照侧位(ML)或局部加压位。有两位高年资影像医师分析乳腺内钙化的大小, 密度, 数目, 形态, 分布方式等,综合判断乳腺病变的良恶性。
1.3 统计方法应用SPSS 19.0软件进行统计分析。
2 结果本研究65例患者病理结果,其中34例良性钙化病变,约占52.31%;证实恶性钙化病变有31例,约占47.69%。良性病变包含乳腺腺体增生12例,12乳腺纤维瘤例,乳腺腺病6例,导管内乳头状瘤2例,乳腺慢性炎症2例。恶性病变包括浸润性导管癌23例,导管原位癌4例,髓样癌3例,嗜酸性细胞癌1例。
钼靶检查显示钙化的形态、数量、大小、分布、密度结果表明:乳腺良性钙化呈圆形,粗颗粒、高密度、大小一致,分布散在;恶性钙化主要表现为沙粒样、短棒状、密度较低、大小不一、成簇分布。详见表 1。P<0.05, 组间差异有统计学意义。
|
|
表 1 乳腺良恶性钙化的钼靶X射线特征对比分析 |
乳腺细胞中含较多的钙磷,容易形成钙化[8]。微小钙化的生成机理现在还没有统一的观点,目前有两种说法:一是坏死组织矿物质钙化论,另一种是细胞过度分泌论,从这两个方面可以看出无论有活力的或者是死亡的癌细胞都可以形成钙化。乳腺的良性钙化主要发生在乳腺间质,大多数恶性钙化发生在小叶腺和者乳腺导管内。
3.1 钙化的形态美国放射影像学数据与报告系统[9]将乳腺钙化分为典型良性钙化,恶性钙化及中间性钙化3种,典型良性钙化为粗钙化(图 1)、数目少,边缘规则光滑,密度均匀清晰,如血管形钙化、爆米花状钙化、蛋壳样钙化等; 中间钙化的形态不规则或边界模糊,如分布为弥散性多为良性,如成簇分布,建议切检。恶性钙化大多数为多形性细小钙化灶,通常直径小于0.5 mm,如泥沙样、分支形、短棒状[10]。分析本次研究,结果显示34例良性钙化灶多为圆点状及粗颗粒状;恶性钙灶化大多数为沙粒状(图 2)及短棒样,本次达31例,均被证实为乳腺癌,对诊断乳腺癌有较高的特异性。可见恶性钙化多数为微钙化。近年来,有报道认为短杆钙化是导管癌的典型钙化特征,分支钙化可作为导管的铸型。经研究,如发现叉样、短棒状、针样微小钙化,即使数目较少,也不能漏诊,误诊[11]。圆点状钙化在良恶性病变中均可见,是造成钼靶组误诊的主要原因。本次研究中有23例病人表现为圆点状钙化,病理证实仅有8例乳腺癌。泥沙样微钙化是比较有特征性的一种影像学表现,恶性率高达83.8%,但也可在一小部分乳腺良性病变中。本次研究中有1例良性疾病表现为泥沙样,术后病理结果为良性乳腺疾病乳腺腺病。乳腺腺病砂粒样钙化,数目少,比较分散,其他X线征象多不伴有,不易与乳腺癌相区别。因此泥沙样钙化密度较高,良恶性在影像学上有相同之处,不易鉴别, 建议病理检查确诊。所以在临床接诊中,如检出不伴有肿块的微钙化,35岁以上患者均须引起足够重视。
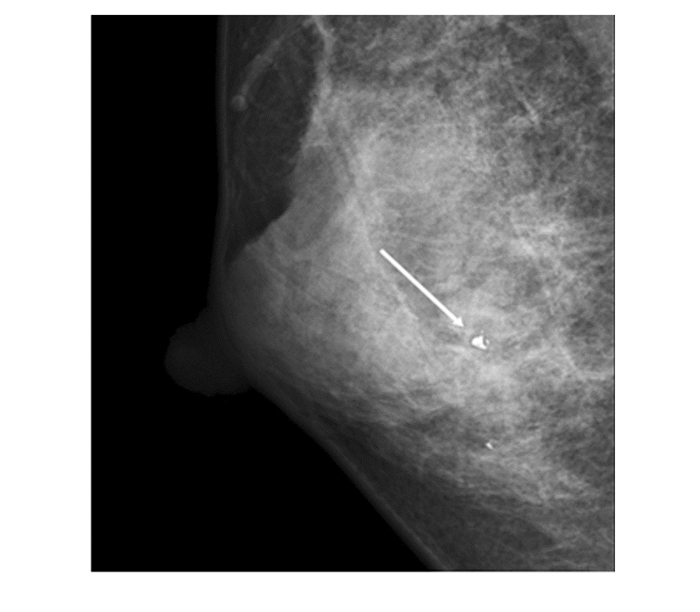
|
图 1 女,32岁,粗钙化,病理 乳腺纤维瘤 |
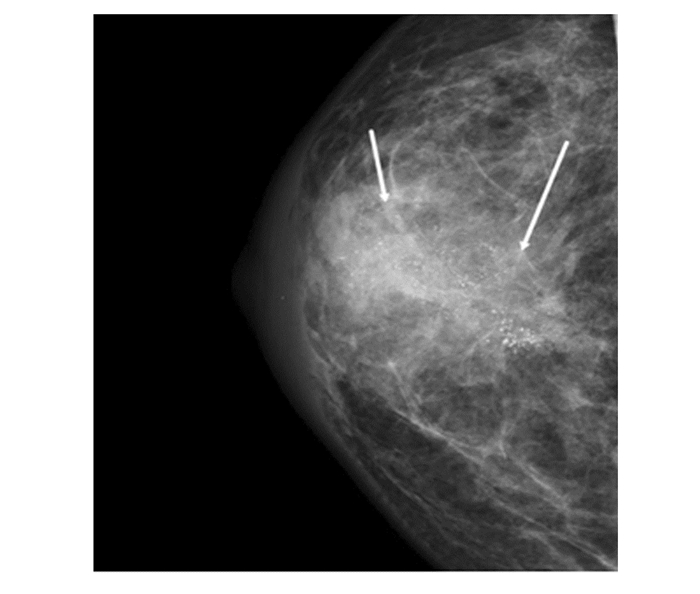
|
图 2 女,46岁,多发泥沙样钙化,病理 乳腺浸润性导管癌 |
微钙化数量指乳腺内钙化的总量(N),分布密度指一平方厘米有多少个钙化点(N/S)。经部分学者研究分析,成簇钙化是指钼靶摄片上每平方厘米钙化点的数目大于5个(N/S)。小砂粒样微小钙化,如果总数>30或N/S≥20个可以被诊断为恶性;当乳房钙化稀疏而且N/S<10枚时,应考虑良性。此次研究表明,钙化点小于5个/cm2的病变:良性病例有18个、恶性病例13个;钙化点数量范围在5~15个/cm2的病变:良性病例14个、恶性病例10个;但单位方厘米钙化点多于15个的病变中仅有2例为良性,8例为恶性病变,差异具有统计学意义。可见钙化灶随密集度的增加而增加。但在实际工作中,良恶性的判断不能单凭单位区间内钙化的数量,而且还可以结合周围腺体结构或其他间接征象。
3.3 钙化的分布乳腺钙化[12]分布分方式分为5种,散在分布、区域分布、簇状分布、线状分布、段形分布。钼靶上乳腺癌微钙化灶的两种常见分布形态为簇状分布(图 3)及区域性分布,良性钙化有时可见,特异性不明显。一般情况下,钙化点数目密集数量越多,越倾向于恶性。本研究发现,簇状分布钙化恶性率较高,有24例恶性钙化成簇分布,占恶性病变的77.4%,但位于肿块内的多形性簇状钙化对于乳腺癌的诊断更有意义。本文的65例乳腺疾病显示的成簇钙化的钙化点主要表现为两类,泥沙样和短棒样。本研究泥沙样钙化的恶性病变占87.5%,说明恶性几率很大。本次19例短棒状钙化,病理证实11例为乳腺癌,因此这类钙化的出现对乳腺癌的诊断有较高的价值。可见如成簇钙化数目增多,形态为短棒状或泥沙样并伴有肿块形成(图 4),需考虑恶性。本研究有22例良性钙化是散在分布,占良性病变的64.7 %,两者之间差异明显,可以得出钙化灶密集程度越高,恶性率越高。所以单纯分析良恶性钙化颗粒总数的差异并无统计学意义(P=0.174),还要结合良恶性钙化灶的分布方式。
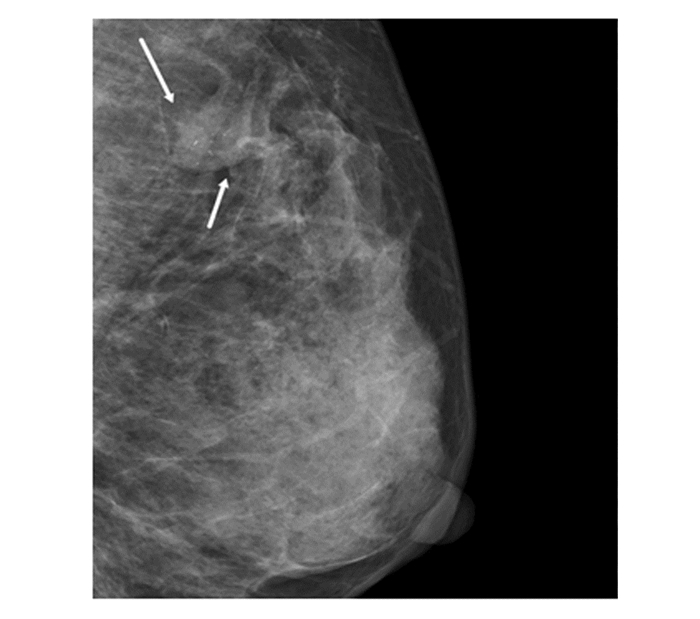
|
图 3 女,49岁,短棒样钙化伴肿块形成,病理乳腺髓样癌 |
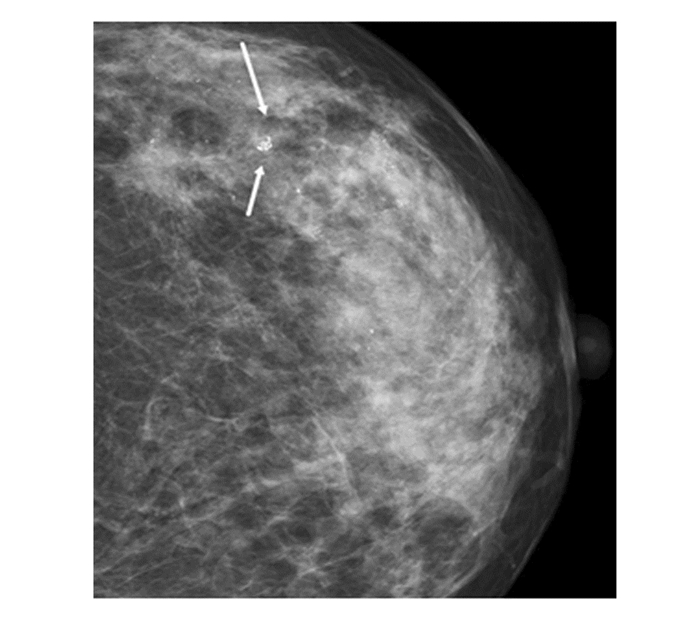
|
图 4 女,38岁,簇状分布沙粒样钙化,病理乳腺浸润性导管癌 |
本次结果可见,呈现高密度的良性钙化有29例,只有5例(14.7%)良性钙化为低密度,但恶性钙化中有12例密度偏低,可占恶性钙化的38.7%。根据钙化密度观察,密度略低而且不均匀的通常为恶性钙化,密度较高且均匀的通常为良性钙化。有关文献[13]研究,钙化密度高低与钙化所含成份有很大关系,乳腺恶性钙化所含主要成分为磷酸钙,主要成分为草酸钙则多见于[14]乳腺良性病变的钙化。翁海莺等[15]研究结果表明,良性钙化大多数较粗大,而恶性钙化多为多形细小,本次研究结果与其相仿,恶性病变中54.8% (17例)钙化颗粒直径<0.5 mm,6.5% (2例)钙化颗粒直径大于1 mm; 良性病变中73.5% (25例)钙化颗粒直径>0.5 mm。另外,本结果显示有77.4% (24例)恶性钙化颗粒大小不一,一半以上约54.3%(19例)的良性钙化颗粒大小均匀一致。所以良性钙化大小较均匀,粗颗粒密度高,易发现,但恶性钙化数量较多,密度较低,颗粒较小,不易发现。
总之,微钙化对乳腺癌的诊断具有重要价值。乳腺癌的典型X射线征象为多发微小钙化沉淀物样的分布、簇状并且沿导管分布。鉴别钙化的特点,区分病变的良恶性,对于乳腺癌诊断率的提高,有重要的临床价值。
| [1] |
陈雪松. 高频超声检测乳腺肿块内钙化类型在诊断乳腺癌中的价值[J]. 广东医学, 2012, 33(10): 1451-1452. DOI:10.3969/j.issn.1001-9448.2012.10.035 |
| [2] |
Tan PH, Ho JT, Ng EH, et al. Pathologic-radiologic correlations in screen-detected ductal carcinoma in situ of the breast:findings of the Singapore breast screening project[J]. Int J Cancer, 2000, 90(4): 231-236. DOI:10.1002/(ISSN)1097-0215 |
| [3] |
Bassett LW. Mammographic analysis of calcifications[J]. Radiol Clin North Am, 1992, 30(1): 93-105. |
| [4] |
Das DK, Mallik MK, Haji BE, et al. Psammomabody and its precursors in papillary thyroid carcinoma:a study by fine-needle aspiration cytology[J]. Diagn Cytopathol, 2004, 31(6): 380-386. DOI:10.1002/(ISSN)1097-0339 |
| [5] |
Machado P, Eisenbrey JR, Cavanaugh B, et al. New image processing technique for evaluating breast microcalcifications:a comparative study[J]. J Ultrasound Med, 2012, 3(6): 885-893. |
| [6] |
Machado P, Eisenbrey JR, Cavanaugh B, et al. Microcalcifications versus artifacts:initial evaluation of a new ultrasound image processing technique to identify breast microcalcifications in a screening population[J]. Ultrasound Med Biol, 2014, 40(9): 2321-2324. DOI:10.1016/j.ultrasmedbio.2014.04.008 |
| [7] |
Grigoryev M, Thomas A, Plath L, et al. Delection of microcalcifications in women with dense breasts and hypoechoicfocal lesions:comparison of mammography and ultrasound[J]. Ultraschall Med, 2014, 35(6): 554-560. DOI:10.1055/s-00000089 |
| [8] |
唐琪玲. 乳腺钼靶X线摄影及乳腺微小钙化灶在临床触诊阴性乳腺疾病诊断中的应用[J]. 中国现代医生, 2015, 17(15): 112-114. |
| [9] |
Liberman L, Menell JH. Breast imaging reporting and datasystem(BI-RADS)[J]. Radiol Clin North Am, 2002, 40(3): 409-430. DOI:10.1016/S0033-8389(01)00017-3 |
| [10] |
刘凤梅, 汤发, 龚柳燕. 簇状钙化对乳腺触诊阴性的良恶性病变的鉴别诊断价值[J]. 放射学实践, 2013, 28(1): 42-45. DOI:10.3969/j.issn.1000-0313.2013.01.013 |
| [11] |
胡永升, 阚秀, 刘金洲, 等. 乳腺癌X线干板十种征像的病理组织探讨[J]. 肿瘤防治研究, 1980(1): 32-34. |
| [12] |
American College of Radiology (ACR). ACR Birads-mammography.4th Edition. In ACR breast imaging reporting anddata system, breast imaging atla[J]. Reston, VA. American College of Radiology, 2003, 100. |
| [13] |
Haka A S, Shafer-Peltier K E, Fitzmaurice M, et al. Identifying microcalcifications in benign and malignant breast lesionsby probing differences in their chemical composition using Raman spectroscopy[J]. Cancer Res, 2002, 62(18): 5375. |
| [14] |
Winston J S, Yeh I T, Evers K, et al. Calcium oxalate is associatedwith benign breast tissue. Can we avoid biopsy[J]. Am J Clin Pathol, 1993, 100(5): 488. DOI:10.1093/ajcp/100.5.488 |
| [15] |
翁海莺, 林月兰, 徐学勤, 等. 乳腺良、恶性疾病钙化的X线表现分析[J]. 实用放射学杂志, 2005(09): 970. DOI:10.3969/j.issn.1002-1671.2005.09.022 |




