科学家Robert Wilson[1]首先提出了质子治疗癌症的潜力和优势,随后世界各地相继开展了治疗实践,国内万杰医院于2004年首次进行了质子治疗实践,2015年上海质子重离子医院开始进行质子和碳离子放射治疗实践。质子治疗相对X射线治疗理论上具有疗效好、适应症广、靶精度高、受体剂量小等优势,近些年质子治疗在国内逐渐得到重视和青睐,但是国内质子治疗缺少相应质量控制检测标准与规范。本文通过研究质子射线束的束流特性,提出了质子束流相关的质量控制检测项并给出了检测项的指标参数。
1 质子束流特性及检测项质子射线束流一般分为被动式散射束流和主动点扫描束流,被动式散射束流主要采用散射体和射程调制器来横向扩展以及纵向调节束流满足临床需求[2-3]; 主动式点扫描束流,也称为笔形束,这种技术主要是利用质子束流出口的偏转磁铁控制束流扫描位置,能量变化调节质子束流纵向分布从而使束流满足临床需求[4-5]。点扫描又细分为调强质子治疗(IMPT)、单野均匀剂量(SFUD)和均匀射野扫描等三类束流模式[6]。均匀射野扫描模式下,需要准直器以及射程补偿来调制束流,其深度剂量分布与散射束流类似。
光子、电子和质子放射治疗皆为外照射束的放射治疗,在临床上其束流在水中具有一些相似的参数特性,射线束深度剂量分布、射野特性和射线束剂量特性等,质子束流水中分布主要参照电子和光子水中分布,并结合质子束流特性以及医用电子加速器质量控制检测(GB 15213-94和GB/T 19046-2013)内容,提出了质子束流特性参数和质量控制指标。
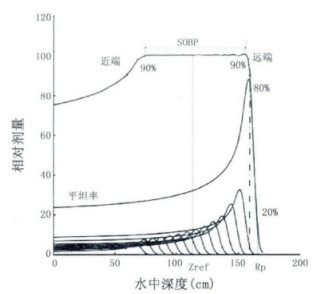
1.1 深度剂量分布在外照射放射治疗中,射线束的深度剂量分布是很重要的指标,该指标可以呈现射线束与物质相互作用的总体效果。质子在水中的深度剂量分布是临床上一项中重要指标,总体来说质子剂量则随着深度增长而增加,在质子射程末端处达到最大剂量值,随后急剧下降,形成所谓的布拉格峰。临床一般要求靶区的剂量要相对均匀分布,为此质子束流需要在横向和纵向进行扩展,形成扩展布拉格峰(SOBP) [7],如图 1所示。
|
图 1 扩展布拉格峰示意图(SOBP) |
一般采用以下几项参数来描述质子在水中的深度剂量分布[8-10]:最大剂量深度值(Rmax); 实际射程(Rp); 剩余射程(Rres); 参考深度(zref); 平坦率(P); 扩展布拉格峰(SOBP); 穿透深度(d); 远端剂量衰减(DDF); 靶区长度,其中前四项参数参考了电子射线束在水中深度剂量分布特性,其定义与电子射线束类似,后五项为质子射线束特性参数,在文中将作重点说明。
1.1.1 最大剂量深度值(Rmax)单能质子射线束在束流中心轴上最大剂量点出的深度值。
1.1.2 实际射程(Rp)单能质子射线束中心轴上最大剂量10%处的深度值,如图 1所示。
1.1.3 参考深度(zref)是位于布拉格峰或者SOBP中间处的深度值,如图 1所示。
1.1.4 剩余射程(Rres)作为质子射线质的参数,其由实际射程(Rp)和参考深度(zref)来决定,公式表示为: Rres = Rp-zref。
1.1.5 平坦率(P)定义为区域内剂量随深度的增加率,一般为质子射线束中心轴100 mm处剂量值与0 mm处剂量值的比。
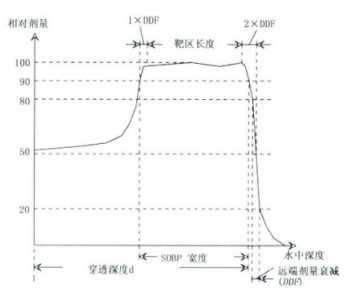
1.1.6 扩展布拉格峰(SOBP)有多种定义方式,比较有代表性的一种定义质子射线束中心轴上扩展布拉格峰近端和远端最大剂量90%之间的宽度为扩展布拉格峰值,如图 2所示; 另外一种定义质子射线束中心轴上近端最大剂量点与远端最大剂量点之间的距离。
|
图 2 质子射线束深度剂量分布 |
在质子射线束中心轴上深度剂量分布远端最大剂量90%处的深度值。散射质子束穿透深度与质子能量和射野大小有关; 主动式点扫描穿透深度与射野大小无关,仅仅与质子能量相关。
1.1.8 远端剂量衰减(DDF)定义质子射线束中心轴上远端剂量值从最大剂量80%处与最大剂量20%处之间的距离。点扫描质子束DDF由两个因素决定,第一,模体中质子能量分散(ΔE/E),第二,模体中质子射程的离散。散射质子DDF除了受到质子能量和质子射程的离散影响外,还与散射体厚度和射程调制器厚度的相关,呈现正比关系。
1.1.9 靶区长度定义为质子深度剂量分布中近端距离90%最大剂量点1倍DDF处与远端距离50%最大剂量点2倍DDF处之间的距离,可见示意图 2。
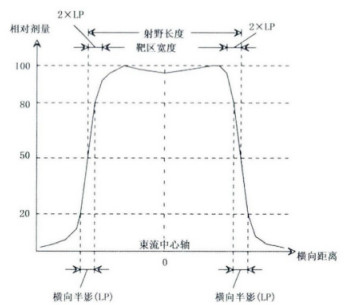
1.2 质子束射野特性质子射线束在水中的横向剂量分布有几项重要参数来描述其特性,主要涉及到:射野、靶区、横向截面平坦度、横向截面对称性和横向半影[9-11]。
1.2.1 质子束射野定义类似于光子射野定义,在质子射线束中心轴上50%最大剂量点处之间的距离。
1.2.2 靶区宽度在射野中心轴参考深度处,横向剂量分布距离50%最大剂量处2倍横向半影点之间的距离,如图 3所示。
|
图 3 质子束横向截面分布特性 |
定义为,F = 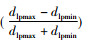
定义为S = 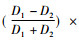
指的是在横向剂量分布剂量从80%最大剂量点至20%剂量点之间的距离,横向半影示意图,见图 3。
散射质子射线束半影受到质子源大小、源位置、光阑位置、射程调制器、空气以及水深度等的影响,在临床上通过优化上述参数来尽可能减少LP值,以便使得靶区获得最大剂量而周边正常组织剂量处于最低水平。
点扫描射线束横向半影受到束斑在水中大小的影响。一般可定义为LP = 1.68* σ,其中σ代表单个束斑高斯分布的标准差。
1.3 质子射线束水中剂量分布 1.3.1 剂量偏差按照ICRU报告内容,外照射束放射治疗剂量偏差一般不大于5%,对于质子治疗该要求同样适用[12-13]。质子束流水中剂量分布见图 4所示,图中第一区也就是靶区,实测剂量与规划剂量偏差应该小于或等于5%,第二、第三和第四区为非治疗靶区,该区域剂量差异较大,而且与治疗计划相关,越是复杂的治疗计划,剂量偏差就可能越大。不同型号和厂家的设备该区域剂量偏差不尽相同。

|
图 4 质子射线束水中剂量分布 |
靶区由图 2的靶区长度和图 3中靶区宽度决定的区域,在该区域散射线束的剂量均匀性好于点扫描射线束,一般来说该区域的剂量均匀性应该在± 4%范围内。
1.3.3 剂量稳定性剂量稳定性主要考查设备的一天内和一周内重复输出剂量能力,一般质子设备靶区剂量稳定性应该± 1%以内,一周内稳定性应该在± 2%以内。
1.3.4 剂量线性在给定条件下实测剂量值与监测计数值应该为线性,两者最大偏差应该± 2%以内。
1.3.5 剂量率值对于散射线束,剂量率大小依赖于散射体设计以及射野大小。射野越大,在给定条件下剂量率越低。点扫描射线束,剂量传递是通过逐点和逐层扫描实现的,点扫描剂量率指的是在单位时间10 cm × 10 cm × 10 cm靶区内任意位置的剂量值。点扫描剂量率值不仅仅与每层的点扫描束流强度相关,还和束流传输系统以及能量切换的时间相关。
2 检测项及典型值质子束流水中分布特性是质子治疗设备质量控制中重点关注的内容,依据医用电子加速器性能检测指标内容,研究了质子束流在水中的深度剂量分布、横向剂量分布以及剂量准确度相关的各个参数,并结合国外质子治疗设备QC内容[9, 10],提取了几项关键检测项目,给出了散射质子束流与点扫描质子束流下参数的异同。见表 1。
|
|
表 1 质子束流检测项及典型指标 |
本文从质子设备质量控制角度研究了质子束流特性,由于外照射束的放射治疗有一些共性的要求,因此参考了医用电子加速器性能检测有关内容,从质子束深度剂量分布、射野和剂量特性三方面进行调查研究。深度剂量分中的前五项参数分别为:最大剂量深度值(Rmax)、实际射程(Rp)、参考深度(zref)、剩余射程(Rres)和平坦率(P),这五项参数主要代表了某一档能量质子的特性。作为检测项可实测值与标称值对比,或者测量相关参数的稳定性,但是从国外质子治疗设备QC项目来说,一般用作深入了解质子束流特性参数,不作为单独的检测项进行检测。SOBP、穿透深度和远端剂量衰减DDF是治疗中很重要的参数,尤其SOBP涉及到有关的放射治疗性能,应该作为重点检测项进行检测,可检测SOBP最大长度、SOBP步长、SOBP实测与标称值偏差或者测量SOBP稳定性等指标。
射野特性参数关注了质子射线束在水中的横向剂量分布,涉及到了射野大小、平坦度、对称性和横向半影,其中前三项相应参数及指标要求见表 1,横向半影作为代表质子治疗重要特点的一项指标,应该重点关注,一般要求尽可能降低横向半影,以便降低肿瘤周边健康组织剂量,由于没有相关具体参数,应该根据设备和射线束类型来确定横向半影的检测内容。
剂量特性内容包括了剂量偏差、剂量稳定性、剂量线性、剂量均匀性和剂量率值等指标,
其中剂量偏差,一般考虑靶区实测剂量与规划剂量的偏差,如果详细考查设备输出剂量性能,应该对于质子束水中剂量分布做全面检测,包括第三区入射通道区,第二区高梯度剂量区与远端剂量陡降区和第四区靶外粒子束区的剂量偏差做详细的测试。其余几项指标的检测内容应该参考表 1所示。
由于国际上尚未有统一的质量控制检测项及参数,不同类型和不同厂家的质子治疗设备各个检测项参数存在差异,例如中国疾病预防控制中心辐射防护与核安全医学所完成了上海质子重离子医院的质子重离子设备质量控制检测,该设备属于点扫描射线束,检测后发现其剂量日稳定性和射野剂量均匀性与表 1中的参数存在差异,因此表 1中给出的参数仅仅作为参考。
| [1] |
Wilson RR. Radiological use of fast protons[J]. Radiology, 1946, 47(5): 487-91. DOI:10.1148/47.5.487 |
| [2] |
Koehler AM, Schneider RJ, Sisterson JM. Flattening of proton dose distributions for large-field radiotherapy[J]. Med Phys, 1977, 4(4): 297-301. |
| [3] |
Sanberg G. Electron beam flattening with an annular scattering foil[J]. IEEE Trans Nucl Sci, 1973, 20(3): 1025-1026. DOI:10.1109/TNS.1973.4327315 |
| [4] |
Goitein M, Chen GTY. Beam scanning for heavy charged particle radiotherapy[J]. Med Phys, 1983, 10(6): 831-840. DOI:10.1118/1.595419 |
| [5] |
Grunder HA, Leemann CW. Present and future sources of protons and heavy ions[J]. Int J Radiat Oncol Biol Phys, 1977, 3: 71-80. DOI:10.1016/0360-3016(77)90230-9 |
| [6] |
Smith A. Vision 20/20: Proton therapy[J]. Med. Phys, 2009, 36(2): 556-568. |
| [7] |
Smith A. Proton therapy[J]. Phys. Med. Biol, 2006, 51(13): R491-R504. DOI:10.1088/0031-9155/51/13/R26 |
| [8] |
Mihai M, Spunei I, Escu ML. Comparison features for proton and heavy ion beams versus photon and electron beams[J]. Romanian Reports in Physics, 2014, 66(1): 212-222. |
| [9] |
Harald Paganetti. Proton Therapy Physics[M]. New York: CRC Press, 2011: 103-125.
|
| [10] |
Charlie Ma CM, Tony Lomax. Proton and Carbon Ion Therapy[M]. New York: CRC Press, 2012: p49-71.
|
| [11] |
ICRU Report 78. Prescribing, Recording, and Reporting Proton-Beam Therapy[R]. London: Oxford UUniversity Press, 2007: 44- 50.
|
| [12] |
David Jette, Weimin Chen. Creating a spread-out Bragg peak in proton beams[J]. Physics in Medicine and Biology, 2011, 56(11): 131-138. DOI:10.1088/0031-9155/56/11/N01 |
| [13] |
ICRU Report 24. Determination of Absorbed Dose in a Patient Irradiated by Beams of X or Gamma Rays in Radiotherapy Procedures[R]. London: Ooxford University Press, 1976: 1-50.
|





