视网膜母细胞瘤(Retinoblastoma,Rb)基因是最早克隆出来的人类肿瘤抑制基因[1],其表达的蛋白质通过对细胞周期中的一个重要调控点G1/S交界处的R点的负性调控,控制细胞的分化与成熟,从而起到抑制细胞恶变的作用,其发生功能异常或缺失时可导致细胞恶变[2]。N端缺失的Rb蛋白-Rb94(野生型全长Rb110的NH2末端缺失112个氨基酸残基)具有比野生型Rb蛋白更强的抑瘤作用[3]。本研究将食管癌K150细胞接种裸鼠建立肿瘤模型,观察Rb94基因联合放射后裸鼠种植瘤组织的病理改变,为肿瘤的基因治疗与放疗联合在临床上的应用奠定基础。
1 材料与方法 1.1 细胞培养食管癌K150细胞培养于含10%血清、青霉素105U/L、链霉素100 mg/L的RPMI 1640培养基,在37℃含5% CO2饱和湿度条件下培养。
1.2 试剂和仪器人食管癌细胞株K150由本实验室保存,Ad-Rb94重组腺病毒由本实验室构建并保存[4],RPMI 1640培养基购自美国Gibco公司,137Cs γ射线照射源由加拿大Atomic Energy公司生产(剂量率为0.873 Gy/min)。
1.3 实验动物雄性BALB/c-nu裸鼠,6周龄,平均体重22 g,由中国医学科学院放射医学研究所实验动物中心提供。所有动物都置于无特定病原体条件下,置恒温(25℃ ± 2℃)、恒湿(45% ~ 50%)、无菌净化屏障系统内饲养。
1.4 裸鼠荷瘤模型建立将处于对数生长期的食管癌K150细胞经胰蛋白酶消化,离心去上清,用无血清培养液离心洗涤2次,制备成1 × 107/ml细胞悬液。于每只裸鼠后腿两侧皮下注射200 μl细胞悬液,每实验组为6只动物。
1.5 动物分组裸鼠接种食管癌细胞后约10天形成肿瘤,当肿瘤最大直径长至3 mm时随机分成五组,分别为对照组(未进行处理)、Ad-LacZ组(含lacZ基因但不含Rb94基因的对照腺病毒,分别于治疗的0 d、3 d、7 d以50 μl Ad-LacZ感染瘤体,感染复数为40)、Ad-Rb94组(分别于治疗的0 d、3 d、7 d以50 μl Ad-Rb94感染瘤体,感染复数为40)、照射组(137Cs γ射线照射源4 Gy局部照射瘤体,分别于治疗的1 d、4 d、8 d进行照射)和Ad-Rb94联合照射组(简称联合组,Ad-Rb94感染后24 h进行4 Gy局部照射,给药剂量与Ad-Rb94组相同,照射时间与照射组相同)。
1.6 病理组织学检查于治疗的第18天采用过量的二氧化碳吸入法处死裸鼠,仔细检查裸鼠种植瘤的大体形态、生长部位、肿瘤附近区域转移和远处转移情况。并取肿瘤组织固定于10%福尔马林溶液中,用标准方法石蜡包埋,组织切片最大断面切成5μm厚,H. E染色后封片镜检,进行组织病理学分析。计数最少在400倍放大的4个视野观察到的凋亡小体,半定量标准是:-(0个),1 + (每个视野1-5个),2 + (每个视野5-10个),3 + (每个视野>10个)。肿瘤瘤体的最大截面用Image-Pro Plus 5.1软件计算。
1.7 统计学处理实验数据用均数±标准差(x±s)表示。采用SPSS 16.0软件进行分析,多组间资料比较采用完全随机设计的单因素方差分析,以P ﹤ 0.05为差异有统计学意义。
2 结果 2.1 裸鼠种植瘤瘤体的横断面面积比较荷瘤裸鼠接受治疗的第18天后被处死,取肿瘤组织切片,计算瘤体的横断面面积。对照组和Ad-LacZ组肿瘤的横断面面积较大,两者差异无统计学意义; 与对照组相比,Ad-Rb94组、照射组和联合组瘤体的横断面明显减少,以联合组瘤体的横断面面积最小,与Ad-Rb94组和照射组比较有统计学差异(F = 22.5、27.8,P ﹤ 0.01),见图 1。

|
图 1 裸鼠种植瘤瘤体的横断面面积 注: **与联合组相比,P<0.01。 |
病理显示,对照组和Ad-LacZ组生长活跃,而Ad-Rb94组和照射组肿瘤细胞出现生长抑制和凋亡; 与其他组相比,联合组有较少的核分裂、较浅的核深染。结果表明,联合组的抑瘤效应好于单独Ad-Rb94组或单独照射组。
|
|
表 1 裸鼠种植瘤组织的病理改变 |
肿瘤组织H.E染色显示:对照组(A)和Ad-LacZ组(B)肿瘤细胞生长良好,Ad-Rb94组(C)肿瘤的生长受到抑制,照射组(D)出现肿瘤细胞凋亡和异生; 联合组(E)核分裂最少,肿瘤细胞数最少,异生水平最高,肿瘤细胞消失(F),见图 2。结果表明,裸鼠种植瘤对Ad-Rb94联合放射治疗的敏感性大大增加。
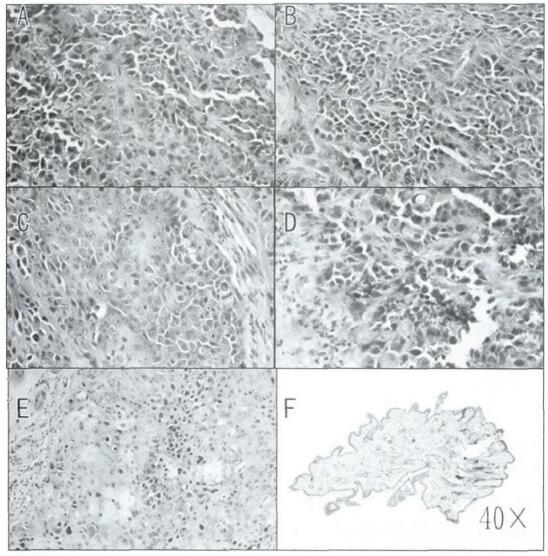
|
图 2 裸鼠种植瘤组织的HE染色图(× 400) |
Rb基因是第一个被克隆出来的人类抑癌基因,具有调控细胞周期、抑制肿瘤细胞增殖和促进肿瘤细胞分化的作用。Rb基因是基因治疗的良好靶基因,如果将具有正常功能的野生型Rb基因通过各种途径转染至肿瘤细胞中,重建失活的抑癌基因功能,恢复细胞的正常生长表型,就能达到控制肿瘤细胞异常生长的目的。有研究表明,腺病毒介导的Rb94基因转染头颈部鳞癌[5]、膀胱癌[6]、胰腺癌[7]等细胞株,可导致细胞株转基因表达,具有明显的肿瘤抑制效应。
放射治疗是肿瘤治疗的传统手段。近年来,肿瘤基因治疗是肿瘤治疗领域的热点研究方向[8]。研究发现,放射与基因联合应用于肿瘤治疗可发挥协同效应,显著提高肿瘤治疗的效果[9-11]。Wu等[11]发现,单纯照射组在治疗后36天肿瘤体积缩小至对照组的11%,治疗后50天有1只裸鼠(1/7)肿瘤完全消退; 联合治疗组于治疗后20天肿瘤完全消退,仅有1只(1/7)在治疗后36天复发,其余均达到完全治愈。为评价Rb94基因联合放射对肿瘤的抑瘤效应,本研究将食管癌K150细胞接种裸鼠建立肿瘤模型,采用构建好的Ad-Rb94重组腺病毒,对裸鼠种植瘤组织进行了病理分析。通过H.E染色,观察了肿瘤边缘、核异型性、核分裂、凋亡小体、肿瘤异质性等肿瘤特性。同时也计算了种植瘤瘤体的横断面面积,它是代表肿瘤生长的指标。结果发现,联合组肿瘤细胞出现明显的良性转变,核分裂最少,异生水平最高,肿瘤组织不明显,与上述文献结果一致。结果说明,Rb94基因或照射均能抑制肿瘤的生长,而Rb94基因与放射联合比单纯照射或单纯Rb94基因处理具有更好的抑瘤效应。提示,Ad-Rb94转染能提高肿瘤放疗的疗效,降低放疗的剂量,从而减轻放疗导致的不良反应。
前期实验我们发现,Rb94基因联合放射对体外食管癌K150细胞的抑瘤效应明显高于单独Rb94基因或单独照射处理[12]。本实验通过观察Rb94基因与放射联合后裸鼠种植瘤的病理改变,也发现Rb94基因与放疗联合应用对肿瘤生长具有协同抑瘤效应,显著增加食管癌联合治疗的疗效。前期体外结果与本研究体内结果一致验证了基因联合放射疗法对肿瘤治疗具有相互促进作用这一结论。本实验为临床开展Rb94基因联合放射治疗肿瘤奠定了基础。
| [1] |
Chakraborty S, Khare S, Dorairaj SK, et al. Identification of genes associated with tumorigenesis of retinoblastoma by microarray analysis[J]. Genomics, 2007, 90(3): 344-353. |
| [2] |
Sun A, Bagella L, Tutton S, et al. From G0 to S phase: A view of the roles played by the retinoblastoma (Rb) family members in the Rb-E2F pathway[J]. J Cell Biochem, 2007, 102(6): 1400-1404. DOI:10.1002/(ISSN)1097-4644 |
| [3] |
Araki K, Ahmad SM, Li G, et al. Retinoblastoma RB94 enhances radiation treatment of head and neck squamous cell carcinoma[J]. Clin Cancer Res, 2008, 14(11): 3514-3519. DOI:10.1158/1078-0432.CCR-07-4538 |
| [4] |
李进, 王芹, 宋力, 等. 采用GatewayTM系统构建人Rb94基因重组腺病毒载体[J]. 肿瘤防治研究, 2010, 37(9): 1-5. |
| [5] |
Li D, Day KV, Yu S, et al. The role of adenovirus mediated retinoblastoma 94 in the treatment of head and neck cancer[J]. Cancer Res, 2002, 62(16): 4637-4644. |
| [6] |
Zhang X, Multani AS, Zhou JH, et al. Adenoviral-mediated retinoblastoma 94 produces rapid telomere erosion, Chromosomal crisis, and caspase-dependent apoptosis in bladder cancer and immortalized human urothelial cells but not in normal urothelial cells[J]. Cancer Research, 2003, 63(4): 760-765. |
| [7] |
Roig JM, Molina MA, Cascante A, et al. Adenovirus-mediated retinoblastoma 94 gene transfer induces human pancreatic tumor regression in a mouse xenograft model[J]. Clinical Cancer Research, 2004, 10(4): 1454-1462. |
| [8] |
张耀文, 李进, 王芹, 等. 基因治疗联合放射治疗恶性肿瘤的研究进展[J]. 国际放射医学核医学杂志, 2008, 32(4): 247-250. DOI:10.3760/cma.j.issn.1673-4114.2008.04.017 |
| [9] |
赵艳芝, 李进, 王芹, 等. 恶性肿瘤基因治疗和放射治疗相互作用的机制及联合治疗展望[J]. 国际放射医学核医学杂志, 2006, 30(4): 250-253. DOI:10.3760/cma.j.issn.1673-4114.2006.04.019 |
| [10] |
王芹, 王敬敏, 徐畅, 等. 沉默XRCC2基因表达联合电离辐射对结肠癌细胞增殖能力的影响[J]. 国际放射医学核医学杂志, 2015, 39(4): 282-286. |
| [11] |
Wu C, Li X, Tian M. Effect of pEgr-TNFalpha gene radiotherapy on mice melanoma[J]. Melanoma Res, 2005, 15(3): 185-190. DOI:10.1097/00008390-200506000-00007 |
| [12] |
王蕾, 李进, 姜恩海, 等. 人Rb94基因联合γ射线照射对K150细胞生长影响的体外研究[J]. 中华放射医学与防护杂志, 2009, 29(6): 8-11. |





