2. 天津市免疫分析技术企业重点实验室;
3. 天津市协和医药科技集团有限公司;
4. 天健生物制药天津有限公司
2. Union Medical & Pharmaceutical Technology Group(Tianjin) Ltd., 300457 China;
3. Key Lab of Immunoassay Technology for Tianjin's Companies, Tianjin 300457 China;
4. Tianjian Biological Pharmacy(Tianjin) Co., Ltd. Tianjin 300457 China
鳞状细胞癌抗原(Squamous Cell Carcinoma Antigen,SCCA)是一种宫颈癌组织中分离获得的一种肿瘤相关蛋白,由两个类似的约45 kD的蛋白质组成,属于丝氨酸蛋白酶抑制剂家族,SCCA在于不同器官的正常组织中含量极微,恶性病变的上皮细胞中[1]。SCCA在正常的鳞状上皮细胞中抑制细胞调亡和参与鳞状上皮层的分化,在肿瘤细胞中参与肿瘤的生长,它有助于所有鳞状上皮细胞起源癌的诊断和监测,对原发性宫颈鳞癌敏感性在80%以上; 复发癌敏感性为87% ~ 100%,特异性92% ~ 96%;其血清学水平与肿瘤发展、侵犯程度及有否转移相关。在宫颈癌根治术后SCCA浓度显著下降; 可及早提示复发它可以作为独立风险因子加以应用[2-3]。SCCA水平与肺鳞癌肿瘤的进展程度相关,它配合CYFRA21-1,和CEA联合检测可提高肺癌患者诊断的灵敏性[4-5]。
本研究的目的是制备高亲和力、高特异性的SCCA配对单克隆抗体,研制SCCA免放分析试剂盒,评价试剂盒的灵敏度、回收率、精密度,并通过血清标本的检测来探讨本SCCA免放试剂盒在宫颈癌及肺鳞癌临床诊断中的价值,为这两种癌症的临床早期诊断及疗效观察、预后评价提供比较可靠的依据。
1 材料及方法 1.1 材料和仪器重组人SCCA抗原购买自上海领潮生物技术公司; Na125I是委托中国同位素公司代购美国PerkinElmer公司的产品; SP2/0骨髓瘤细胞和蛋白A亲和层析柱由天健生物制药(天津)有限公司提供; HALB/C小鼠购自北京维通利华实验动物公司,DMEM高糖培养基购买自美国Gibeo公司; 弗氏佐剂购自Sigma公司; 羊抗鼠IgG及HRP标记的兔抗鼠IgG购买自自美国Scanbody公司; Multiscan MK3型酶标仪为芬兰雷勃公司产品; 紫外分光光度计为北京普析通用仪器有限公司产品,GC-911型γ计数放免分析仪为科大创新股份有限公司产品。
1.2 实验方法 1.2.1 动物免疫① 首次免疫:取8只6周龄的HALB/C小鼠,将弗氏完全佐剂与SCCA重组抗原乳化后进行腹腔注射,免疫剂量为60 μg/只。②加强免疫:将弗氏不完全佐剂与SCCA重组抗原乳化后进行腹腔注射,每2周进行一次加强免疫注射,免疫剂量为30 μg/只。加强免疫4次后,通过小鼠静脉采血,用ELISA测定血清中抗体效价。当抗体效价达到1: 60 000时,于细胞融合前4 d时再进行一次加强免疫,对小鼠进行腹腔注射,免疫剂量为60 μg/只。
1.2.2 细胞融合本实验室采用最优化的标准细胞融合技术,选取抗体效价最好的小鼠,收集脾淋巴细胞,用低分子量的聚乙二醇诱导与SP2/0骨髓瘤细胞融合。
1.2.3 阳性细胞筛选及亚克隆将融合后的杂交瘤细胞接种到96微孔细胞培养板上,对培养基中的杂交瘤细胞进行最优化的酶联免疫吸附检测程序进行筛选。将筛选出的阳性杂交瘤细胞克隆猪24孔培养皿上进行扩大培养。将确定为阳性的细胞克隆进行亚克隆以获得能产生抗体并进行稳定传代的细胞系。
1.2.4 单克隆抗体的亚型测定用羊抗鼠IgG二抗包被96孔酶标板,在各孔中加入50 μl杂交瘤细胞培养液上清,并进行空白对照。37℃温育1h后,再往各孔中分别加入50 μl HRP标记的兔抗鼠IgG,37℃温育30 min。洗板3次,加入100 μl TMB底物显色,加入终止液后用酶标仪测定其450 nm处的OD值。
1.2.5 单克隆抗体的批量制备及纯化针对每株杂交瘤细胞进行一次小批量的腹水生产(5只小鼠/株),用蛋白A层析柱从腹水样本中分离纯化单克隆抗体。通过紫外分光光度计测定抗体的浓度,用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定抗体纯度。
1.2.6 SCCA标准品的配制用胎牛血清与0.02 M,pH值为7.3的PBS配制基础缓冲液,然后加入重组人SCCA抗原,配制出浓度分别为0,1,3,10,30,100 ng/mL的标准品。
1.2.7 包被管的制备SCCA抗体包被管的制备采用物理吸附法直接包被,具体步骤如下:
配制pH值为9.0的0.01 M碳酸盐缓冲液,作为包被缓冲液; 向包被缓冲液中加入SCCA单克隆抗体,浓度为3 mg/L; 将配制好的包被液按150 μl/管,加入的聚苯乙烯塑料管内; 2℃ ~ 8℃放置24 h,倒掉液体,加入1.0 ml PBS洗管2次; 200 μl/管封闭液(0.01 M PBS,10 g/L BSA,10 g/L),2℃ ~ 8℃放置2小时后,将封闭液倒掉,凉干待用。
1.2.8 标记物的制备方法取80 μg(80 μl)鼠抗人SCCA单克隆抗体加入反应杯中,加入1.2 mCi Na 125I,边搅拌边加入Cl-T 20 μl(4.0 mg/ml)反应40 s。在反应杯内加入Na2S2O3 40 μl(4.0 mg/ml)反应30 s。标记反应完成后用凝胶层析柱纯化分离,用PBS - BSA缓冲液配制标记物工作液,使100 μl标记物的CPM测定值为20万左右,2℃ ~ 8℃保存待用。
1.2.9 SCCA免疫放射分析方法的建立试剂盒上述主要组分制备完成以后,经过一系列的对比筛选试验,最终确定了SCCA试剂盒的最佳操作方法和温育条件。
1.2.10 分析灵敏度的测定连续测定20管零标准品,将其CPM值做统计,求出其均值(x)及标准偏差(SD),取x + 2SD在标准曲线上所对应的浓度值即为本方法的分析灵敏度。
1.2.11 精密度测定① 批内变异性:取低、高两个不同浓度的混合血清样品进行检测。每个样品做20管,计算测定浓度的平均值(x)及标准偏差(SD),然后计算x/SD × 100%,即为本方法的批内变异性。②批间变异性:测定低、高样品各10管,重复3次,计算三次测定结果的变异性。
1.2.12 回收率测定取一定量的SCCA抗原,将其溶解于人血清中,配制成高、中、低三个不同浓度的样品,用本方法测定其浓度值,然后计算实际测定值与理论值之间的比例即为本分析方法的回收率。
1.2.13 正常值范围的确定采集180例正常人血清,用本SCCA免放试剂盒测定其浓度值,计算测定浓度的平均值(x)及标准偏差(SD),计算x + 2SD即为正常参考值上限,小于该值即为正常。
1.2.14 临床标本的检测分别测定测定116例宫颈癌105例肺鳞癌患者的血清样本,计算结果的阳性率,测定160例正常人的血清样本,计算其阴性率。
2 结果 2.1 细胞融合及阳性细胞株筛选经过对免疫小鼠血清抗体效价的测定,选取了2号、4号、5号共小鼠进行细胞融合,经阳性克隆筛选及亚克隆后,共获得了2株可以稳定分泌抗体的细胞株,分别为2F3和4G6,并对这两株细胞所分泌的抗体进行了亚型测定,结果显示均为IgG1型单抗。
2.2 单抗的批量制备及纯化将上述2F3和4G6细胞株分别接种5只小鼠后,分别得腹水16.3 ml和15.8 ml,用蛋白A层析柱分离纯化后各得单克隆抗体56 mg和51.7 mg。用紫外分光光度计测定抗体的浓度分别为5 mg/ml和4.6 mg/ml。
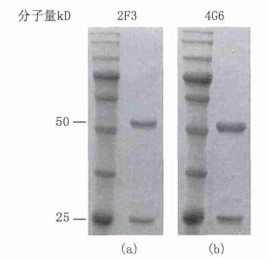
2.3 单抗的纯度鉴定将2F3和4G6两株单抗分别进行SDS-PAGE凝胶电泳,电泳条带为图 1所示,两株单抗的电泳结果均为两条带,分别为50 kD的重链和25 kD的轻链。经扫描图谱分析后计算得两株单抗的纯度均>96%。
|
图 1 纯化SCCA单抗的SDS-PAGE电泳图 注:(a)为2F3的电泳图;(b)为4G6的电泳图。 |
对两株抗体分别按2.2.7节和2.2.8节述方法进行包被和125I标记,经过一系列的筛选试验,最终确定本试剂盒的操作方法为:取50 μl标准品及血清标本加入包被试管,然后再加入100 μl 125I标记的单抗工作液,室温振荡1小时,吸去管中液体,加入1.0 ml洗液洗管2次,然后再用γ计数器测定每管1 min内的放射性强度计数,测定结果如图 1所示。
从表 1和图 2可以看出,2株SCCA单克隆抗体配对结果较好,非特异性结合率低,标准品各点的结合率梯度拉差明显,标准曲线的线性良好。
|
|
表 1 SCCA-IRMA免放分析标准曲线数据 |

|
图 2 SCCA免疫放射分析法测定的标准曲线 |
通过测定20管零标准品,根据2.2.11节所述的计算方法,得出本试剂盒的分析灵敏度为0.08 ng/mL。
2.6 精密度测定结果通过对浓度分别为3和20 ng/mL的两个血清样本测定,计算出其批内变异性分别为5.43%和4.61%,其批间变异性分别为8.36%和6.84%。
2.7 回收率测定结果取高中低三个血清样本进行测定,其浓度分别为3、20、100 ng/mL,计算出其回收率分别为104.6 %、99.45%、97.54%。
2.8 正常值范围的测定结果测定了180例正常人血清,计算浓度其平均值x = 0.98 ng/mL,SD = 0.256,则x + 2SD = 1.492 ng/mL。因此,确定本试剂盒测定的正常值范围为<1.5 ng/mL。
2.9 临床标本的检测测定116例宫颈癌患者和105例肺鳞癌患者的血清样本,计算结果的阳性率,测定160例正常人的血清样本,计算其特异性。见表 2。
|
|
表 2 SCCA免放分析方法的临床样本测定结果统计 |
本研究制备了一对高亲和力、高特异性的SCCA单克隆抗体,用其研制出了SCCA免疫放射分析试剂盒,并对该试剂盒的检测灵敏度及特异性进行了考察分析,经对116例宫颈癌患者血清、105例肺鳞癌患者血清和160例正常人血清样本的检测结果进行分析,对宫颈癌和肺鳞癌的临床测定的敏感度分布可达92.24% (107/116)和89.52% (94/105),特异性为98.75% (158/160)。
由于目前目前国内市场上的SCCA类产品主要被罗氏、康乃格等进口产品所垄断,价格十分昂贵。本研究试剂盒与进口产品相比价格可降低一半左右,因此,可广泛应用于宫颈癌及肺鳞癌的早期筛查,有效提高宫颈癌及肺鳞癌的早期检出率,做到早诊断早治疗,降低死亡率,提高患者的生活质量。
| [1] |
李卫鹏, 张蕾蕾. 鳞状细胞癌抗原研究进展[J]. 放射免疫学杂志, 2010, 23(1): 34-36. DOI:10.3969/j.issn.1008-9810.2010.01.020 |
| [2] |
Kato H, Morioka H, Aramaki S, et al. Radioimmunoassay for Tumor-Antigen of Human Cervical Squamous Cell Carcinoma[J]. Cell Mol Biol Inel Cyto Enzymol, 1979, 25(1): 51-56. |
| [3] |
冯晓宇, 刑汝东. 鳞状细胞癌抗原的研究进展[J]. 国际口腔医学杂志, 2009, 36(4): 429-431. DOI:10.3969/j.issn.1673-5749.2009.04.016 |
| [4] |
Hashimoto K, Kiyoshima T, Matsuo K, et al. Effect of SCCA1 and SCCA2 on the suppression of TNF-alpha-induced cell death by impeding the release of mitochondrial cytochrome c in an oral squamous cell carcinoma cell line[J]. Tumour Biol, 2005, 26(4): 165-172. DOI:10.1159/000086949 |
| [5] |
Parenti A, Porzionato A, Pizzi S, et al. Expression pattern of squamous cell carcinoma antigen in oesophageal dysplasia and squamous cell carcinoma[J]. Histology and Histopathology, 2007, 22(9): 989-995. |




