2. 中国原子能科学研究院同位素研究所;
3. 原子高科股份有限公司;
4. 中国同辐股份有限公司
2. Department of Isotopes, China Institute of Atomic Energy;
3. HTA CO., Ltd.;
4. China Isotope & Radiation Corporation
非霍奇金淋巴瘤是临床常见的恶性肿瘤之一,采用放射性核素标记单克隆抗体进行放射免疫显像和治疗为淋巴瘤的诊断和治疗提供了一种新的方法。因此本研究使用2种DOTA及DTPA类衍生物进行利妥昔单克隆抗体的177Lu标记,初步探索其最佳标记条件,为进一步的临床研究提供有价值的实验资料。
1 材料和方法 1.1 试剂及仪器① 利妥昔单克隆抗体(Rituximab,100 mg/10 mL) :瑞士Roche公司; Chelex-100离子交换树脂:美国Sigma-Aldrich公司; p-SCN-Bz-DOTA,p-SCN-Bz-DTPA:美国Macrocyclics公司; 177LuCl3 [1.04 TBq/mg (28.2 Ci/mg,RCP ≥ 97%)〕 :美国PerkinElmer公司; 其他试剂均为分析纯:国药集团化学试剂有限公司。②LC-20AT型高效液相色谱仪:日本岛津制作所; TSK-Gel G3000SWXL (直径7.8mm,长度300 mm)凝胶色谱柱:日本TOSOH公司; HPLC放射性检测系统,B-MS-1000放射性薄层扫描仪:美国Bioscan公司; CRC-15R放射性活度计:美国Capintec公司; TDL-6C低速台式离心机:上海安亭科学仪器厂; TS-1加热温控振荡仪:北京昊诺斯生物科技有限公司; Mili-Q超纯水系统,Amicon Ultra-2离心过滤管:美国Millipore公司。
1.2 螯合过程Rituximab预先使用NaHCO3缓冲溶液(50 mM,pH = 8.3 ~ 9.5)洗涤10次,去除原有体系中的小分子物质,同时将体系转换成偶联时所需要的缓冲溶液体系。以EP管作反应容器,加入1 mg纯化后的Rituximab,分别加入一定量(抗体和螯合剂反应摩尔比分别为1: 10,1: 100,1: 500,1: 1000) p-SCN-Bz-DOTA,p-SCN-Bz-DTPA(1.0 × 10-2 M,pH = 8.3 ~ 9.5),4℃下反应17 ~42 h。反应结束后,将反应液移至Amicon Ultra-2离心过滤管,转入1 mL CH3COONH4缓冲溶液(0.25 M,pH =7.0)中,4℃冷藏待用。
1.3 标记过程① 取上述螯合液,用1: 10氨水或1: 10醋酸将pH值分别调至5.0、6.0、7.0和8.0; ②加入4.44 MBq(0.12 mCi) 177LuCl3,涡旋混匀; ③分别在25 ℃、40 ℃或50℃反应15 min、30 min、60 min或90 min。
1.4 实验设计通过优化设计考察标记过程中的关键因素对标记率的影响,具体实验条件见表 1。
|
|
表 1 利妥昔单抗的177Lu标记的具体试验条件 |
各取反应混合液3 μL,于10 mM DTPA溶液体系中上行展开,空气中自然晾干,用ITLC测量其标记率。
1.6 样品放化纯度测量 1.6.1 样品的纯化采用排阻色谱法纯化标记抗体:以PD-10柱为支持体,PBS(0.1 M,pH = 7.2)作为淋洗液,收集洗脱液。
1.6.2 高效液相柱准备采用配制好的0.05% NaN3/0.9% NaCl溶液处理TSK-Gel G3000凝胶柱,冲洗柱子时流速为0.5 ml/min,测量时为1.0 ml/min。
1.6.3 测量操作各取25 μL标记抗体,加样入高效液相仪,检测并计算放化纯度。
1.7 数据处理以各样品的标记率为考察指标,比较分析22个样品之间的标记率差异,确定最佳标记条件。
2 结果 2.1 标记情况标记抗体高效液相放化纯度鉴定结果见图 1,与标准品Rituximab高效液相紫外色谱对比可以看出,放射性出峰时间与蛋白出峰时间均在7.2 ~ 8.5 min之间,基本重合,说明177Lu成功标记至利妥昔单抗。由图 1可知,经PD-10柱分离后,标记物的放化纯度>99%。

|
图 1 标记物177Lu-Rituximab高效液相放化纯度鉴定 注:1:177Lu-p-SCN-Bz-DOTA-Rituximab,tR=7.39min; 2:177Lu-p-SCN-Bz-DTPA-Rituximab,tR=7.93min。 |
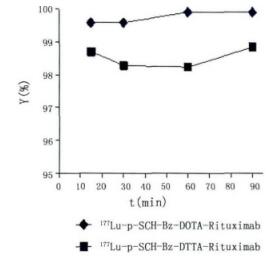
不同pH及反应时间标记率测定结果如图 2和图 3。从图 2可以看出,反应液的pH分别为5.0、6.0、7.0和8.0时,177Lu-p-SCN-Bz-DOTA-Rituximab的标记率分别为3.58%、64.67%、99.59%和50.27%,177Lu-p-SCN-Bz-DTPA-Rituximab的标记率分别为98.36%、97.76%、98.28%和38.97%,以上结果表明,标记抗体的标记率依赖于反应体系的pH,偏酸性条件下可获得高标记率。延长反应时间,标记率没有显著提高。

|
图 2 pH值对标记率的影响 |
|
图 3 反应时间对标记率的影响 |
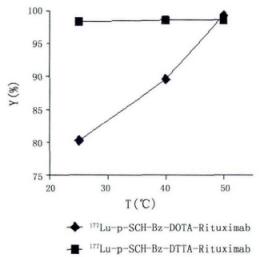
不同温度条件下标记率测定结果如图 4,结果显示,随着温度的提高,偶联物的标记率都有不同程度的提高。
|
图 4 温度对标记率的影响 |
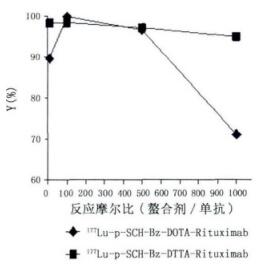
改变螯合剂和单抗的反应摩尔比,观察其对标记率影响,结果显示,螯合剂与单抗的摩尔比分别为10、100、500和1000时,177Lu-p-SCN-Bz-DOTA-Rituximab的标记率分别为89.57%、99.78%、96.59%和71.07%,177Lu-p-SCN-Bz-DTPA-Rituximab的标记率分别为98.28%、98.34%、97.09%和94.89%。此结果表明,在一定范围内,螯合剂与单抗摩尔比的增大有利于反应的进行,在采用0.4587 mg p-SCN-Bz-DOTA、0.4333 mg p-SCN-Bz-DTPA和1 mg单抗时,螯合剂与单抗的摩尔比为100: 1,反应30 min,标记率皆高于98%,见图 5。
|
图 5 螯合剂用量对标记率的影响 |
非霍奇金淋巴瘤的放射免疫治疗始于20世纪80年代。近几年,淋巴瘤的放射免疫治疗研究已从小规模阶段进入了多中心的Ⅲ期临床试验阶段,对B细胞淋巴瘤的有效率已达70% ~ 80%,完全缓解率达35% ~ 40%,毒性反应可控制[1]。目前最常用的单抗为抗CD20单抗。
Rituximab是第一个用于临床的抗肿瘤单克隆抗体,它是一种人鼠嵌合型免疫球蛋白,通过转染相应基因到中国仓鼠细胞后表达的基因产物,与CD20具有高亲合性,能特异性结合B淋巴细胞表面CD20抗原,通过多种机制对肿瘤细胞发生作用。
177Lu是近年来非常受关注的一种用放射性核素,具有适宜的物理半衰期(6.7d),发射最大能量为0.5 MeV的β粒子,在组织中的平均射程为0.28 mm,低能量的β粒子可以获得更理想的肿瘤/非肿瘤摄取比值,因此更适合于治疗如淋巴瘤类的小体积或者弥散性肿瘤[2-3]; 另外,它还发射最大能量为208 keV的β射线,可用于显像,监测和指导治疗过程,患者接受的辐射剂量也较少,起到“一药两用”的作用[4-5]。作为一种金属核素,177Lu一般通过双功能螯合剂标记单克隆抗体,当前,DOTA及DTPA类衍生物是针对177Lu研究较多的两类双功能螯合剂。因此本研究使用2种DOTA及DTPA类衍生物进行Rituximab的177Lu标记。
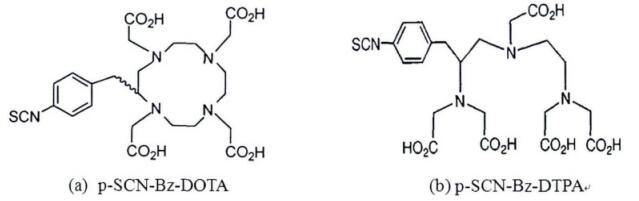
本研究以标记率为考察指标,确定最佳标记条件为:单抗和螯合剂反应摩尔比为1: 100,pH值6.0 ~ 7.0,40℃反应30 min。在第一步的螯合反应中,单抗和螯合剂的摩尔比问题值得关注。研究发现,每个单抗上平均结合的螯合剂数目对单抗的免疫活性有重大的影响,当单抗和螯合剂反应摩尔比为1: 100时,每个单抗上平均结合的螯合剂数目为6.0 ~ 8.0个[6],是否会对单抗的免疫活性产生影响,尚需后续实验证明。有关第二步标记反应的条件,本研究选择标记反应pH = 6.0 ~ 7.0,主要是为了防止177Lu水解沉淀,同时避免强酸性环境对单抗活性的损伤; 延长反应时间,标记率提高不大,选择标记时间为30 min。反应温度方面,其对标记率影响较小,考虑到人体内环境的温度为37℃左右,选择在40℃下进行标记。p-SCN-Bz-DOTA在较高温度下可获得高标记率,这可能与螯合剂的空间结构有关,p-SCN-Bz-DOTA是大环类螯合剂,温度的提高加快了分子运动,有利于与177Lu螯合后形成稳定的配位键,而p-SCN-Bz-DTPA为无环螯合剂,线性结构使其在常温下即可迅速与177Lu螯合,见图 6。本工作为进一步研制开发用于非霍奇金淋巴瘤放射免疫诊断和治疗的放射性药物打下了一定的基础。
|
图 6 DOTA及DTPA类衍生物结构图 |
| [1] |
Jacobs SA, Swerdlow SH, Kant J, et al. Phase Ⅱ trial of short-course CHOP-R followed by 90Y-ibritumomab tiuxetan and extended rituximab in previously untreated follicular lymphoma[J]. J Clin Cancer Res, 2008, 14(21): 7088-7094. DOI:10.1158/1078-0432.CCR-08-0529 |
| [2] |
Bernhardt P, Forssell-Aronsson E, Jacobsson L, et al. Low-energy electron emitters for targeted radiotherapy of small tumours[J]. Acta Oncol, 2001, 40: 602-608. DOI:10.1080/028418601750444141 |
| [3] |
Bernhardt P, Benjegard SA, Kolby L, et al. Dosimetric comparison of radionuclides for therapy of somatostatin receptor-expressing tumors[J]. Int J Radiat Oncol Biol Phys, 2001, 51: 514-524. DOI:10.1016/S0360-3016(01)01663-7 |
| [4] |
Tapas D.M.R.A.P.. Options to meet the future global demand of radionuclides for radionuclide therapy[J]. Nucl Med Biol, 2013, 40: 23-32. DOI:10.1016/j.nucmedbio.2012.09.007 |
| [5] |
Reilly RM. Monoclonal Antibody and Peptide-Targeted Radiotherapy of Cancer[M]. New Jersey: John Wiley & Sons, Inc, 2010.
|
| [6] |
马秀凤.177Lu标记利妥昔单克隆抗体及其初步生物学评价[D].北京: 中国原子能科学研究院同位素研究所, 2014: 28-30.
|



